应用石墨烯改良PLCL/Gel纳米纱支架材料的可行性分析
2020-07-20艾雪峰朱晶晶颜冰倩宫艺其谭瑶王会景徐徐付炜莫秀梅王伟
艾雪峰 朱晶晶 颜冰倩 宫艺其 谭瑶 王会景 徐徐 付炜 莫秀梅 王伟
静电纺丝技术已有数百年历史,其制备方式简便易行,制备成本相对低廉,各种有机[1-3]、无机高分子材料[4-5]以及复合高分子材料[6]均可进行静电纺丝。如今,静电纺丝材料已广泛应用于组织工程[7-8]、传感元器件[9-10]、滤膜[11-12]等多个领域。
通过高压静电纺丝技术获得的支架材料拥有纳米级直径的纤维、较高的孔隙率和良好的生物相容性,与细胞外基质非常相似,常用于组织工程研究中的细胞培养和各种体内研究。大量研究表明,通过改变纺丝参数,如溶液浓度、纺丝速度、电压、接收器等,可调整纤维支架的直径、孔隙率;也可通过添加天然生物材料,如胶原、丝素蛋白,来提高其生物相容性或改变其力学性能[13];还可通过添加石墨烯、羟基磷灰石等无机材料以使电纺膜获得某些特殊的性能。
石墨烯(Graphene,Gr)是21世纪最具开发潜力的材料之一[14],其独特的二维结构(六边形蜂巢晶格结构)和超薄的厚度(单原子层厚)使其具有优异的理化性能,是已知的机械强度最高的材料之一,目前已成为生物医学、能源、材料等各个领域的研究热点。
本研究在已有的水纺PLCL/Gel纳米纱支架材料基础上,加入1%Gr,探索PLCL/Gel/Gr材料进行水纺的可行性,并对其力学性能、微观形貌、生物相容性和皮下移植后细胞浸润情况进行研究。
1 材料与方法
1.1 实验试剂与仪器
DMEM高糖培养基、0.25%胰蛋白酶、PBS缓冲液、青霉素+链霉素(Hyclone公司,美国);胎牛血清(Gibco公司,美国);CCK-8试剂盒(Dojindo公司,日本);石墨烯(昂新新型碳材料常州有限公司);PLCL(济南岱罡生物科技有限公司);六氟异丙醇(百灵威科技有限公司)、酶标仪(Thermo公司,美国)、扫描电镜(QUANTA 250,美国)。
1.2 水纺纳米纱材料制备
将Gel和PLCL按照质量比25∶75混合后溶于六氟异丙醇中,配置成质量体积分数为12%的纺丝液。将纺丝液分为两组:实验组加入质量体积分数为1%的Gr,对照组不作处理。将实验组纺丝液放置在磁力搅拌器上搅拌48 h,再使用超声波振荡器进行超声分散60 min,然后继续磁力搅拌24 h;对照组纺丝液放置在磁力搅拌器上搅拌72 h。使用自制动态液体电纺装置[15]进行纳米纱支架制备,具体静电纺参数为:注射泵速度为1 mL/h,针头到接收平面的高度为15 cm,电压15 KV,滚筒半径5 cm,转速60 r/min。所制备的纳米纱支架置于-80 ℃冷冻过夜后放入冻干机中冻干,放真空干燥箱中干燥保存。
1.3 结构性能表征
1.3.1体视显微镜和扫描电镜检测
将充分干燥的材料从真空干燥箱中取出,使用体视显微镜观察两种支架材料的表面结构,表面喷金后扫描电镜观察支架微观结构和表面形貌,最后利用Image J软件统计分析支架材料纤维直径分布,并绘制材料直径分布图。
1.3.2力学性能和吸水性检测
将材料放入真空干燥箱中1周,充分干燥后,使用英斯特朗拉力机检测支架材料力学性能。每组材料5个样本。绘制并统计材料的应力-应变曲线、杨氏模量等。将充分干燥的材料裁剪成小块,干燥称重结果记作W1,称重后浸泡双蒸水5 min,取出后使用吸水纸将材料表面蒸馏水吸去,再次称重质量记作M2,A表示吸水率,根据以下公式计算材料的吸水性能。
A=(M2-M1)/M1×100%
1.4 细胞增殖实验
将两组支架材料分别裁剪成24孔板大小,75%乙醇浸泡30 min,PBS漂洗5~6次,以5×104个/孔的密度接种3T3细胞。在培养第1、4、7天使用CCK-8试剂盒进行检测,酶标仪检测反应液在450 nm处的吸光度,每组设4个复孔。将培养第7天的材料取出,固定包埋后行HE染色。
1.5 支架材料皮下移植及组织学染色
将支架材料裁剪成直径8 mm大小的圆片,紫外线照射杀菌,每面照射30 min。使用1%异氟烷麻醉大鼠,将两组支架分别移植至大鼠皮下两侧(n=3),分别于4 d和7 d后取材,4%多聚甲醛固定,石蜡包埋、切片,HE染色,观察分析材料的细胞浸润情况。
1.6 统计学分析
2 结果
2.1 PLCL/Gel/Gr材料的制备及表面形貌观察
经过磁力搅拌混匀后获得两种不同纺丝液,对照组呈现无色透明状液体;实验组因添加石墨烯而呈深黑色,石墨烯均匀分散在溶液中,无明显块状沉淀出现,整体颜色均匀一致。水纺获得的纳米纱支架干燥后大体观察显示,对照组为白色疏松状,实验组呈均匀一致的黑色,提示石墨烯在材料中均匀分散(图1)。

A:自制纳米纱静电纺丝装置;B:左边白色为未加石墨烯纺丝溶液,右边为加石墨烯纺丝溶液;C:PLCL/Gel纳米纱;D:Gr/PLCL/Gel纳米纱 A: Self-made electrostatic spinning device; B: The white on the left is spinning solution without graphene, and the right is spinning solution with graphene; C: PLCL/Gel nanoyarn; D: Gr/PLCL/Gel nanoyarn图1 纳米纱支架材料的制备Fig. 1 Preparation of nanoyarn scaffold material
体视显微镜观察发现,两组材料整体都呈现疏松的结构形态,表面不平坦,纤维束间存在沟壑状间隙,纤维束分布具有一定的方向性;实验组支架材料可见Gr颗粒均匀分布在支架中(图2)。
扫描电镜观察发现,两组材料的纤维束都呈平行排列,均未出现串珠样纤维,每一根纤维束由多根纳米纤维构成,表面相对光滑,对照组纤维束平均直径(0.988±0.045)μm,实验组纤维束平均直径(1.157±0.089)μm,表明加入Gr后纤维变粗,但差异无统计学意义(P>0.05)(图2)。
2.2 机械性能
根据拉伸试验数据绘制的应力-应变曲线显示,两组材料拉伸长度和吸水性能没有明显差异(P>0.05),但实验组的杨氏模量和断裂点强度都显著高于对照组(P<0.05)(图3)。
2.3 体外生物相容性
各组吸光度值均随培养时间延长而呈增加趋势,第1、4、7天实验组吸光度值均高于对照组和空白对照组(P<0.05),对照组吸光度值高于空白对照组(P<0.05)。HE染色显示,培养至第7天,细胞已经从材料表面慢慢往材料内部爬行生长,材料具有良好的生物相容性(图4)。
2.4 皮下细胞浸润实验
体内培养4 d,两种材料均已完全被宿主细胞浸润,浸润细胞主要以炎症细胞为主,对照组炎症细胞浸润明显多于实验组;体内培养7 d,浸润细胞进一步增多,对照组炎症细胞浸润依然多于实验组(图5)。
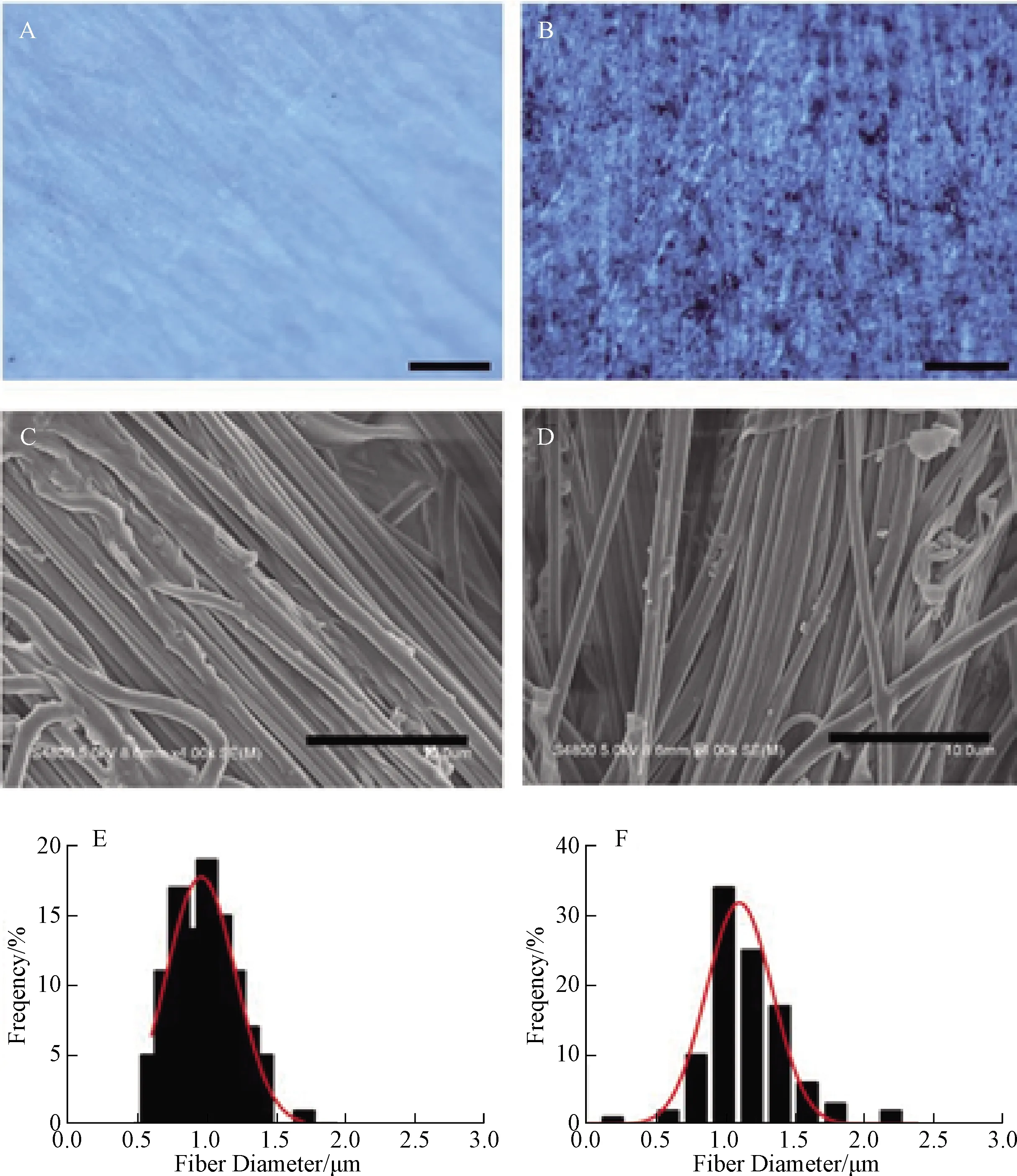
A、B:分别为PLCL/Gel和Gr/PLCL/Gel纳米纱支架体视显微镜观察(标尺=200 μm);C、D:分别为PLCL/Gel和Gr/PLCL/Gel纳米纱支架扫描电镜观察(标尺=40 μm);E、F:分别为PLCL/Gel和Gr/PLCL/Gel纳米纱支架纤维直径分布图 A, B: Stereo microscope observation of PLCL/Gel and Gr/PLCL/Gel nanoyarn scaffold (Scale bars=200 μm); C, D: Scanning electron microscopy results of PLCL/Gel and Gr/PLCL/Gel nanoyarn scaffold (Scale bars=40 μm); E, F: Fiber diameter distribution statistics of PLCL/Gel and Gr/PLCL/Gel nanoyarn scaffold图2 纳米纱支架材料的表征Fig. 2 Characterization of nanoyarn scaffold materials

A:纳米纱支架应力-应变曲线;B~D:纳米纱支架的断裂强度、拉伸量和杨氏模量比较;E:纳米纱支架的吸水性能比较 A: Stress-strain curve of nanoyarn scaffolds; B-D: Comparison of fracture strength, tensile strength and Young's modulus of nanoyarn scaffolds; E: Comparison of water absorption performance of nanoyarn scaffolds图3 纳米纱支架材料力学性能及吸水性能检测Fig. 3 Testing of mechanical properties and water absorption properties of nanoyarn scaffold materials
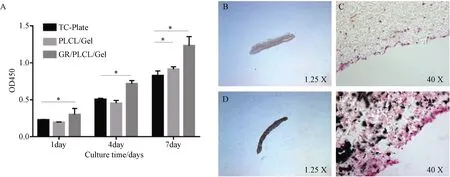
A:接种3T3细胞后第1、4、7天细胞增殖情况;B、C:PLCL/Gel组培养第7天HE染色;D、E:Gr/PLCL/Gel组培养第7天HE染色 A: Cell proliferation on days 1, 4, and 7 after inoculation of 3T3 cells; B, C: HE staining of PLCL/Gel group on the 7th day of culture; D-E: HE staining of Gr/PLCL/Gel group on the 7th day of culture图4 纳米纱支架材料的细胞增殖实验Fig. 4 Cell proliferation experiments of nanoyarn scaffold materials

A、B:PLCL/Gel组皮下移植4 d;C、D:Gr/PLCL/Gel组皮下移植4 d;E、F:PLCL/Gel组皮下移植7 d;G、H:Gr/PLCL/Gel组皮下移植7 d A, B: PLCL/Gel group after subcutaneous transplantation for 4 days C, D: Gr/PLCL/Gel group after subcutaneous transplantation for 4 days E, F: PLCL/Gel group after subcutaneous transplantation for 7 days G, H: Gr/PLCL/Gel group after subcutaneous transplantation for 7 days图5 纳米纱支架材料皮下移植4 d和7 d后组织学观察(HE染色)Fig. 5 HE staining of nanoyarn scaffold materials after subcutaneous transplantation for 4 days and 7 days
3 讨论
静电纺丝技术制备的支架材料是组织工程材料的重要来源之一。但静电纺丝材料多由纳米级纤维的堆积形成,使得材料过于致密,材料孔径偏小,移植体内后细胞难以穿过并浸润支架材料。另外,由于致密多孔和材料多为开放环境制备等多种原因,使得静电纺丝支架材料易发生污染,移植后易出现炎症反应。本实验利用石墨烯良好的抗炎抗菌特性[16],加入石墨烯改良水纺方法获得的静电纺丝纳米纱支架。
扫描电镜观察显示,水纺方法获得的静电纺丝纳米纱支架是由数根粗细约1 μm的纤维互相缠绕形成的纤维束组成,并呈现出一定的取向性,这种取向性的形成与传统静电纺支架不同,纳米纱支架的取向性主要由纺丝液在静电作用下拉伸成丝状落入水面后,再由水面中间的旋涡形成相互缠绕的纤维束,通过水面下方旋转的滚筒接收,获得取向性支架材料。理论上滚筒的接收速度对材料的取向性无明显影响。但如果单纯使用滚筒接收来获得取向性支架,滚筒的旋转速度必须达到3 000 r/min[17]。通过水纺的方法制备取向性支架可明显降低转筒的旋转速度,更节能和安全。我们发现,加入石墨烯后同样可以制备出具有取向性的支架,并且未出现串珠样纤维,证明含石墨烯纺丝液可通过静电纺丝设备获得合适的纳米纱支架材料。HE染色发现,石墨烯均匀分散于材料中。拉伸试验的应力-应变曲线显示,PLCL/Gel纳米纱支架具有良好的力学性能,加入石墨烯后,杨氏模量明显提高。纳米纱结构疏松,无论有无石墨烯,支架亲水性都极强,接触材料表面的水滴能立即被材料浸润吸收,以至于亲水角仪器都无法捕捉到确切数据。虽然本研究中含石墨烯PLCL/Gel纳米纱支架的亲水性优于PLCL/Gel纳米纱支架,但是差异无统计学意义(P=0.806)。正是这种大孔隙的疏松结构更利于细胞的浸润生长。细胞增殖实验结果显示,两组支架材料均具有良好的生物相容性和极低的细胞毒性,这与体内实验的组织学染色结果一致;体内实验结果还表明,含石墨烯支架材料具有明显的抗炎作用,这可能与石墨烯具有良好的抗菌消炎作用有关。
综上所述,应用石墨烯改良PLCL/Gel纳米纱支架材料,可获得具有合适力学性能、亲水性、生物相容性的纳米纱支架材料,在组织工程皮肤等方面具有应用潜能。
