PGS构建特定形状脂肪组织的可行性研究
2020-07-20鲍婉婷曹丽辰魏昊余力周广东郭善禹
鲍婉婷 曹丽辰 魏昊 余力 周广东 郭善禹
全世界每年约有140万人被诊断为乳腺癌,我国仅2015年新发的乳腺癌患者就高达27.2万余人。根治切除导致的乳房缺失带给患者长期的心理问题不容忽视。因此,在不断改进乳腺癌手术方法的同时,“乳房重建”的概念日趋受到重视。除了现行的肌皮瓣转移、硅胶假体植入以及自体脂肪移植,组织工程技术的发展也为乳房重建开辟了新的途径,通过组织工程技术构建大体积脂肪组织在乳房再造中具有潜在的应用前景。
结合正常乳房组织特点,脂肪组织工程支架应具备一定的韧度与强度,因为不仅要抵抗细胞收缩力引起的形状改变,还要承受在组织再生过程中的切口收缩力。此外,在睡眠和体育活动中,乳房区域也承受着较高的生物力学负荷,因此组织构建物必须有一定的刚度[1]。然而,值得注意的是,刚性支架虽然在组织再生的过程中可起到保护作用,但若造成明显的不适感,其临床价值也是有待商榷的。相关研究中,合成聚合物支架(如PLA、PCL等)都刚性偏大。Patric[2]认为这类聚合物多孔支架可能并非乳房组织工程的最佳选择。材料学和工程学的发展,使制备富有弹性、可降解、力学性能接近或稍高于正常乳房乳腺组织的三维多孔支架成为可能。
聚葵二酸甘油酯(PGS)是一种新型可生物降解的弹性聚合材料[3-4],其弹性模量介于肌腱与韧带之间,并且细胞相容性好,动物体内周围组织炎症、纤维化反应轻,以表面侵蚀的方式降解,不伴有膨胀或变形。基于以上良好的生物学及力学性能,PGS主要应用于软组织替代以及软组织工程,比如心肌[5]、神经[6]、角膜修复[7]、动脉重建[8]、软骨组织工程[9]、鼓膜修补[10]等。然而,鲜有报道将其用于脂肪组织工程领域。
本研究将探讨PGS支架构建大体积特定形状脂肪组织的可能性,以期为乳腺癌术后采用组织工程技术构建乳房奠定基础。
1 材料与方法
1.1 实验试剂及仪器
低糖DMEM培养液、0.25%胰蛋白酶、青霉素-链霉素-两性霉素B、胎牛血清(Gibco,美国);Ⅰ型胶原酶(Sigma,美国);成脂诱导分化培养基试剂盒、成骨诱导分化培养基试剂盒(Cyagen,美国);SEM(Philips XL-30,荷兰);生物力学分析仪(Instron,美国);PGS支架(上海锐图生物材料有限公司)。
1.2 实验动物
4周龄雌性裸鼠(上海斯莱克实验动物有限责任公司)。本实验遵守实验动物伦理原则。
1.3 PGS支架的制备及表征分析
PGS用四氢呋喃溶解,按PGS∶盐=9∶1加入经标准筛过筛后的标准盐(粒径224~300 μm),充分搅拌均匀后,清洗去除溶剂。将可流动的共混物加入定制的半球形模具中,待成型后脱模,用去离子水进行盐析处理。
扫描电镜观察多孔支架内部结构与形态,测量孔径大小。支架的孔隙率按照称重法进行测量:①比重瓶装满乙醇称重为W1;②支架称重Ws, 完全浸入比重瓶乙醇中使其充分浸透;③加满比重瓶中乙醇,称重W2;④取出支架,剩下部分称重W3。支架孔隙率E=(W2-W3-Ws)/(W1-W3)×100%。
1.4 脂肪及脂肪干细胞(ADSCs)的获取
脂肪来自于我院抽脂手术的健康成人,事先经过患者知情同意。本研究经我院伦理委员会审核通过。
抽脂获取的脂肪采用静置法除掉肿胀液后,按1∶1加入0.1% Ⅰ型胶原酶消化1.5 h,离心取沉淀进行原代细胞接种分离培养。3 d后,待细胞密度达80%~90%时,用0.25%胰酶消化后传代培养。选取生长良好的第3代ADSCs行多向分化鉴定。
1.5 体外细胞黏附实验
PGS支架经环氧乙烷消毒后,PBS预湿,置于24孔板中。选取生长良好的第3代ADSCs,消化后制成细胞悬液,细胞浓度均调整为2×105cells/mL。将1 mL细胞悬液缓慢滴加到支架表面后,24孔板放入37 ℃、5%CO2培养箱培养7 d,复合物取出后电镜固定液固定,扫描电镜观察。
1.6 体内脂肪复合实验
将抽脂获得的脂肪组织用PBS洗涤后,剔除肉眼可见的血管和结缔组织,然后用组织剪反复剪切直到呈均一匀浆状。将组织匀浆经双层无菌医用纱布过滤后离心(19 g)1 min,吸弃上层油脂,余下部分振荡混匀,将灭菌后的PGS支架浸入脂肪处理物中30 min,备用。
将空白PGS支架(对照组,n=2)以及经处理的PGS支架(实验组,n=2)植入裸鼠背部皮下,术后4周时连同周围组织取材行组织学检测,HE染色和Masson染色观察材料降解情况和组织再生情况。
2 结果
2.1 PGS支架表征分析
PGS多孔支架大致呈半球形,直径约10 mm,厚度4 mm,疏松多孔,内部呈海绵样结构;支架表面电镜扫描显示,多孔支架的孔隙分布均匀,孔径形状较规则,大小在200~300 μm之间(图1),孔隙率约为88%。

图1 支架的大体观察与电镜观察Fig. 1 Gross view and SEM observation of the scaffold
2.2 ADSCs的培养与鉴定
ADSCs原代细胞经分离培养传代后,第3代细胞呈细长梭形,贴壁生长(图2 A)。ADSCs具有成骨、成脂分化能力,成脂诱导培养后油红O染色可见大量脂滴红染(图2B),成骨诱导培养后茜素红染色可见大量被红染的矿结节(图2C)。

A:第3代ADSCs(40×);B:油红O染色(100×);C:茜素红染色(100×) A: P3 ADSCs (40×); B: Oil red O dyeing (100×); C: Alizarin red staining (100×)图2 ADSCs的体外培养及诱导分化。Fig. 2 In vitro culture and induced differentiation of ADSCs
2.3 体外细胞黏附观察
ADSCs接种于PGS支架后7 d后,SEM观察显示,支架上可见细胞黏附并大量增殖,显示出良好的细胞相容性(图3)。

A、 B:PGS支架;C、D:ADSCs接种PGS支架7 d A, B: PGS scaffolds; C, D: 7 days after ADSCs seeded on the PGS scaffolds图3 扫描电镜观察Fig. 3 SEM observation
2.4 动物实验大体与组织学观察
体内培养4周后取材,对照组PGS支架高度及直径显著减小,但依然维持类半球外形(图4A、5B),HE染色可见支架疏松多孔,内部及边缘浸润少量红染的炎性细胞(图4C)。实验组支架高度及直径明显大于对照组,大体标本可见复合物表面不规则分布淡黄色的脂肪组织,组织表面有丰富的血管网(图4D、5E),HE染色可见支架周围有空泡样细胞浸润生长,考虑为存活的脂肪细胞,复合物内部红染的炎性细胞大量浸润,表面有一层致密纤维组织包裹(图4F)。
为了进一步分析实验组的细胞浸润生长情况,对组织切片进行Masson染色,显示植入物周围包裹了一层蓝染的胶原纤维组织,为增生的纤维包膜(图5A);包膜下支架周围浸润生长着色浅或无的脂肪细胞,侧面(图5D)脂肪细胞浸润面积明显多于底部(图5C),底部可见到融合的大空泡,考虑脂肪坏死形成的脂滴(图5C)。在支架内部,未见到明显的细胞浸润,多为支架和核深染的炎性细胞(图5A、B)。

图4 体内培养4周后大体及组织学观察Fig. 4 Gross and histological observation after 4 weeks’ culture in vivo
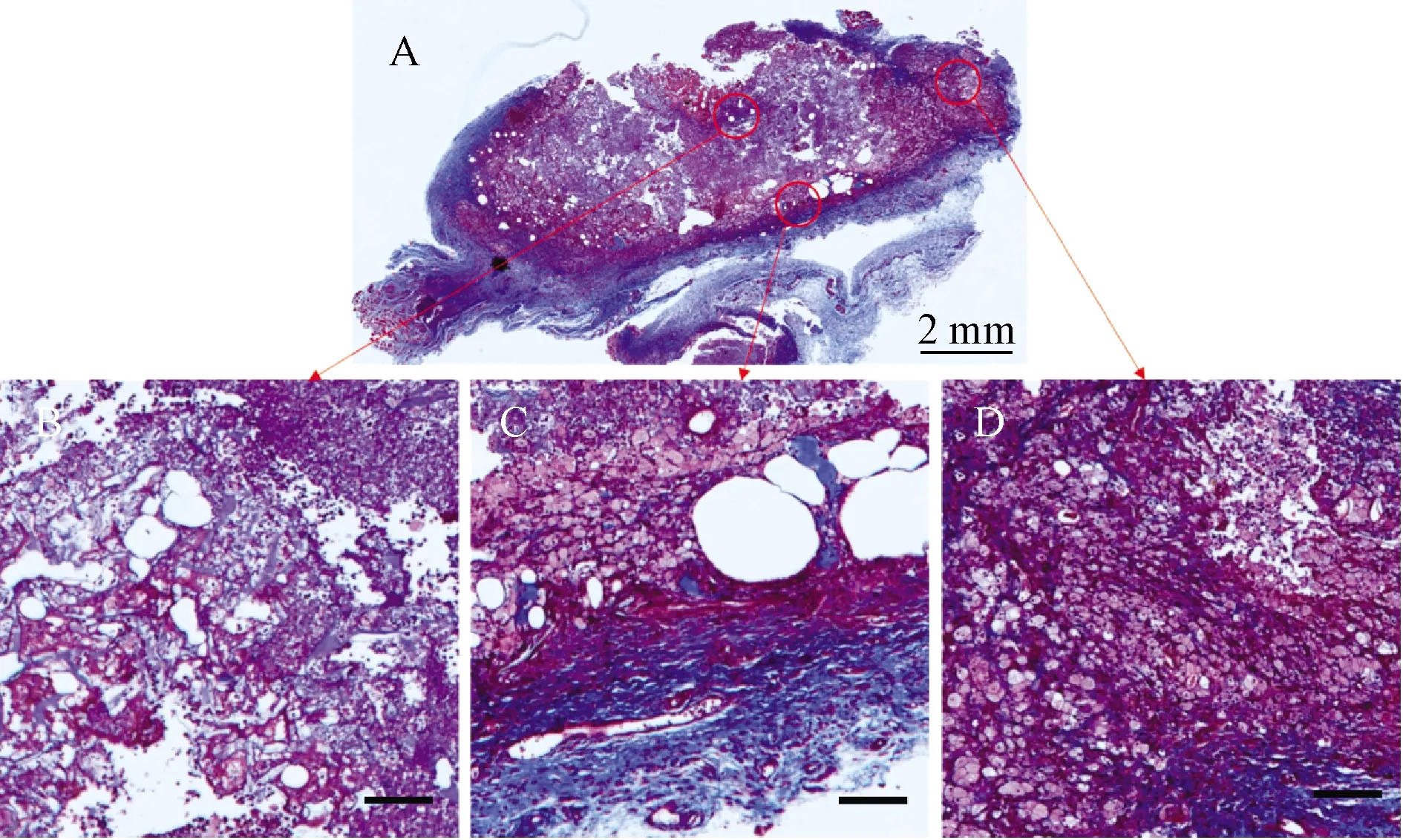
图5 实验组Masson染色观察(B、C、D标尺为500 μm)Fig. 5 Masson staining of the experimental group (Scale bars of B, C, D=500 μm)
3 讨论
PGS盐析支架蓬松,具有弹性,内部疏松多孔。在细胞相容性实验中,ADSCs接种支架7 d后,电镜观察可见ADSCs在支架表面黏附并成群增殖,验证了PGS支架良好的细胞相容性。在动物实验中,大体和组织学观察显示:①PGS支架可降解,并在降解过程中基本维持原有的外形。PGS材料体内降解期约60 d,以表面侵蚀的方式进行降解,降解过程中能够维持外形不变和表面完整而质量线性下降[4]。②体内培养4周,植入物内炎性细胞浸润,比较对照组与实验组浸润情况,我们认为脂肪处理物加剧了炎症反应。一般情况下,脂肪移植过程中会尽量除掉油份,避免诱发、加剧机体炎症反应。同时,我们也不能排除脂肪在处理过程中被污染。③植入物表面形成纤维包膜,且实验组较对照组更明显。包膜挛缩是假体隆乳术后最为常见的并发症,也有多项研究表明纤维包膜形成与假体表面材料类型、切口选择、血肿发生、引流充分与否,以及植入区附近的亚临床感染等因素相关[12-13]。脂肪处理物的潜在污染以及油脂诱发的炎症渗出,都可能是导致实验组纤维包膜厚于对照组的原因。④PGS支架仅见外周脂肪细胞浸润生长,其侧面脂肪细胞存活情况优于底面。本实验中,采用浸没的方式不能充分保证脂肪处理物完全渗透进支架内部,同时,可能由于支架内部缺乏血管供应,氧气弥散距离有限,脂肪细胞即使浸润分布到中央,存活比较困难。对于支架侧面和底面脂肪细胞存活状态的差异,机械压力或许能够解释原因。当脂肪组织受到压力时,组织间微血管压缩或闭塞,另外有研究表明机械力本身也会抑制ADSCs向脂肪分化[14]。
从机械性能和生物相容性方面来看,PGS支架对于构建特定外形脂肪组织具有潜在的应用价值。3D打印基于计算机辅助系统(CAD),可以制作结构和体系明确的三维定制多孔支架,能够实现乳房外形支架的精准化和个性化。但是,由于PGS黏性较低,较少通过3D打印成型,多以静电纺丝或传统盐析法制作支架[7,15-16];并且因其固化需经高温处理,过程繁琐,对于制作复杂外形支架具有局限性。然而,PGS经修饰后可以获得温敏[17]或光敏性能[18],能够实现打印过程中快速即时固化。如能籍此将3D打印与PGS材料结合,就有可能制备出具有类似乳房结构的生物弹性支架而应用于乳房组织工程。
