化橘红柚皮苷对α-葡萄糖苷酶活性的抑制作用
2020-07-18姜翠翠董舒梅邱松山周英彪
姜翠翠,董舒梅,邱松山*,周英彪
广东石油化工学院果蔬加工与贮藏工程技术开发中心(茂名 525000)
糖尿病已成为严重威胁人类健康的三大慢性疾病之一[1-2]。在治疗2型糖尿病的药物中,以阿卡波糖为代表的α-葡萄糖苷酶抑制剂通过延缓肠道对碳水化合物的消化吸收,进而降低餐后血糖浓度,从而达到对血糖的控制[3]。但该类药物常会引起腹泻、胃肠胀气、腹痛等不良反应[4],因而从天然药用植物中寻找和开发能有效治疗糖尿病的药物已成为新的研究热点。近年来研究发现很多黄酮糖苷类天然产物具有较好的降糖作用,Ezzat等[5]对α-葡萄糖苷酶抑制剂进行研究,结果表明在测定条件下所测试的黄酮类化合物比阳性对照阿卡波糖对抑制α-葡萄糖苷酶活性更有效;Chen等[6]研究表明微囊藻叶中三种黄酮苷类化合物对α-葡萄糖苷酶均有较好的抑制作用,提示微生菌叶是开发中草药抗糖尿病药物的候选药物;Nguyen等[7]通过试验发现高粱籽粒中黄酮苷对血凝有潜在抑制作用及对α-葡萄糖苷酶有较强的抑制作用,其富含黄酮类化合物的提取物可视为对糖尿病具有有益作用的功能性食品。
化橘红由芸香科植物化州柚或柚的接近成熟或未成熟的外层果皮经干燥加工而来,素有“南方人参”之称,研究表明化橘红富含多糖、黄酮、香豆素等多种生物活性成分,药用价值较高[8-9],其中柚皮苷类化合物是化橘红的主要有效活性成分[10],具有抑菌[11]、抗氧化[12]、抗病毒[13]等生物活性。化橘红中的黄酮类物质主要是柚皮苷、野漆树苷及新橙皮苷等物质,此类物质一般以C6—C3—C6为基本碳架,分子中有1个酮式羰基结构,分子上的酚羟基数目及位置对其物质的生物活性有较大影响[14]。关于化橘红中的柚皮苷抗氧化活性研究报道较多,而抑制α-葡萄糖苷酶活性的研究较少,试验以化橘红柚皮苷为研究对象,采用体外α-葡萄糖苷酶抑制模型,测定其对α-葡萄糖苷酶的抑制率并分析其抑制类型,考察反应时间对α-葡萄糖苷酶活性抑制作用的影响,同时测定其清除DPPH自由基能力,以期为化橘红柚皮苷进一步开发功能食品或药品奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 化橘红柚皮苷的制备
柚皮苷的制备参考文献[15]的方法进行,有改动。取产自广东化州杨梅镇经干燥的化橘红,隔水蒸软切片,粉碎,过40目筛,备用。取100 g过筛粉末,加入2 L 50%乙醇,超声波辅助萃取50 min,超声功率180 W,在60 ℃条件下提取1 h,萃取结束后过滤,晾干的滤渣再加入1 L 50%乙醇提取1 h,过滤收集滤液,合并2次滤液,减压浓缩至200 mL,离心除去杂质,在清液中加入95%乙醇进行醇沉,0 ℃静置24 h,过滤,冷冻干燥得精制柚皮苷,经测定纯度为92.5%,备用。
1.1.2 主要试剂
α-葡萄糖苷酶(E.C.3.2.1.20,美国Sigma公司);4-硝基苯-β-D-吡喃葡萄糖苷(PNPG,Mym Biologigal Technology Company);阿卡波糖(Acarbose,50 mg/片,德国拜耳医药公司);碳酸钠、磷酸氢二钾、磷酸二氢钾、氯化钠等(均为国产分析纯);超纯水。
1.1.3 主要仪器与设备
HH-A型数显恒温水浴锅(常州国华电器有限公司);UV-5100B紫外分光光度计(上海元析仪器有限公司);DGG-916A恒温鼓风干燥箱(上海齐欣科学仪器有限公司);NRY-1102C立式恒温摇床(上海南荣实验室设备有限公司);ME104型分析天平(梅特勒-托利多仪器(上海)有限公司);VC890C+数字多用表(西安北成电子有限责任公司)。
1.2 试验方法
1.2.1 抑制α-葡萄糖苷酶活性试验
参考程艳刚等[16]的方法进行,有改动。以PNPG为底物,利用α-葡萄糖苷酶催化水解PNPG产生对硝基酚(PNP),以一定时间内反应体系中PNP含量变化来计算化橘红柚皮苷对α-葡萄糖苷酶的抑制活性。以0.1 mol/L磷酸钾缓冲液(PBS,pH 6.8)为溶剂,分别配制0.2 U/mL α-葡萄糖苷酶溶液和2.5 mmol/L底物PNPG溶液,配制样品浓度分别为0.02,0.04,0.06,0.08,0.10和0.12 mg/mL,备用。具体反应体系:分别吸取1 500 μL pH 6.8的0.1 mol/L的PBS及250 μL 0.2 U/mL α-葡萄糖苷酶溶液于试管中,加入250 μL不同浓度的样品溶液,混匀后于37 ℃恒温反应10 min,加入250 μL 2.5 mmoL/L的PNPG溶液启动反应,混匀后于37 ℃恒温反应20 min,加入1 000 μL 0.2 moL·L-1的Na2CO3溶液终止反应,并于405 nm波长下测定吸光度,记作A样品。以PBS代替样品,其它条件同A样品,记作A对照。以PBS代替酶,其它条件同A样品,记作A空白。以Acarbose为阳性对照,重复测定3次取平均值;根据式(1)计算样品对α-葡萄糖苷酶的抑制率;应用SPSS软件计算样品与Acarbose的IC50。

1.2.2 反应时间对α-葡萄糖苷酶活性抑制试验
在1.2.1的反应体系中加入相应的试剂,分别设定反应过程中的反应时间5,10,15,20,25和30 min,终止反应后于405 nm处测定吸光度OD,根据式(1)计算抑制率,比较不同反应时间化橘红柚皮苷对α-葡萄糖苷酶活性抑制的影响。
1.2.3 抑制α-葡萄糖苷酶活性的动力学试验
在测定体系中保持α-葡萄糖苷酶浓度(0.2 U/mL)不变,改变PNPG浓度,分别设置5个不同PNPG浓度(1.0,1.5,2.0,2.5和5.0 mmol/L),3个不同化橘红柚皮苷样品浓度(0,0.04和0.08 mg/mL),按1.2.1 的方法测定吸光度,以底物浓度的倒数(1/S)为横坐标,以反应速度的倒数(1/V)为纵坐标,经Lineweaver-Burk双倒数作图,探讨化橘红柚皮苷对α-葡萄糖苷酶的抑制类型。
1.2.4 抑制α-葡萄糖苷酶作用分析
底物PNPG浓度(2.5 mmoL/L)不变,设置6个不同的α-葡萄糖苷酶浓度(0.1,0.2,0.4,0.6,0.8和1.0 U/mL),3个不同化橘红柚皮苷样品浓度(0,0.04和0.08 mg/mL),按1.2.1的方法测定,以酶浓度为横坐标,反应速率为纵坐标,探讨柚皮苷类物质对α-葡萄糖苷酶的抑制作用是否可逆。
1.3 化橘红柚皮苷清除DPPH·能力
参考Bajpai等[17]清除DPPH自由基的方法,有改动,分析柚皮苷样品对DPPH自由基的清除能力。取6支试管,分别加入2 mL 0.02 mmoI/L DPPH·甲醇溶液置于10 mL的试管中,依次加入2 mL浓度为0,0.02,0.04,0.06和0.08 mg/mL的柚皮苷样品溶液,迅速混匀,避光37 ℃温水浴30 min,于波长517 nm处测定吸光度,根据式(2)计算样品对DPPH自由基的清除率。
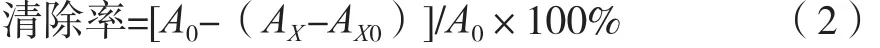
式中:A0为空白对照样品的吸光度;AX为待测溶液样品的吸光度;AX0为样品溶液加甲醇的吸光度。
1.4 数据处理
所有试验均重复3遍,结果表示为平均值±标准偏差,应用SPSS软件通过单因素方差(One-way ANOVA)分析进行多组间比较,p<0.05则认为样品间具有显著性差异。
2 结果与分析
2.1 化橘红柚皮苷对α-葡萄糖苷酶活性的抑制能力
采用体外α-葡萄糖苷酶抑制模型检测柚皮苷类物质对α-葡萄糖酶活性的抑制能力,结果如图1所示。
由图1可知,在0.02~0.12 mg/mL浓度范围内化橘红柚皮苷对α-葡萄糖苷酶的抑制作用随着浓度升高而逐渐增加,其抑制活性呈现一定的剂量依赖性。Peng等[18]研究山奈酚对α-葡萄糖苷酶的抑制作用和抑制机理,结果表明山奈酚能够插入α-葡萄糖苷酶的活性位点,占据酶的催化中心,导致PNPG底物无法进入并诱导α-葡萄糖苷酶的构象变化。IC50值表示化橘红柚皮苷对α-葡萄糖苷酶抑制的能力,IC50值越小其抑制效果越好,通过回归分析可知化橘红柚皮苷与阿卡波糖的IC50分别为0.008和0.026 mg/mL,表明化橘红柚皮苷具有较强的抑制α-葡萄糖苷酶活性,同时其抑制活性优于阳性对照阿卡波糖(p<0.05),这与文献[18]报道的结果比较一致,柚皮苷分子具有类似的酚羟基及分子结构,柚皮苷分子可能是通过抑制α-葡萄糖苷酶活性来实现降血糖功效的。
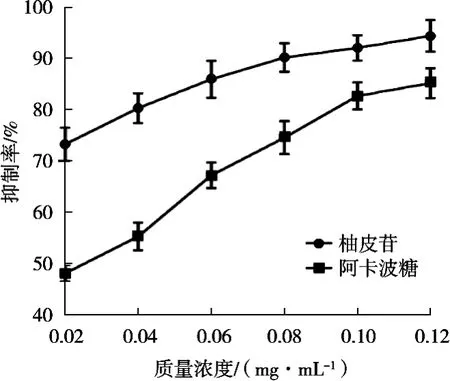
图1 化橘红柚皮苷对α-葡萄糖苷酶活性的抑制作用
2.2 反应时间对α-葡萄糖苷酶活性的抑制作用影响
探讨不同作用时间柚皮苷对α-葡萄糖苷酶活性的抑制作用,确定化橘红柚皮苷对酶活性的抑制是否具有时间依赖性,结果如图2所示。
化橘红柚皮苷对α-葡萄糖苷酶活性的抑制作用在前15 min,随时间增加其抑制率明显增加,但在15~20 min以后,其抑制率随时间增加而趋于平缓,表明化橘红柚皮苷对α-葡萄糖苷酶活性的抑制作用与作用时间有关,在20 min时其抑制率达到最大,抑制作用具有一定时间依赖性,这与文献报道[19]的结果比较一致。
2.3 柚皮苷类物质对α-葡萄糖苷酶的抑制作用类型
根据抑制剂与底物的结合关系,抑制类型可以分为3种:竞争性抑制、反竞争性抑制和非竞争性抑制。化橘红柚皮苷对α-葡萄糖苷酶的抑制作用类型,结果如图3所示。
由图3可知,基于不同浓度样品对α-葡萄糖苷酶活性的抑制数据进行线性回归,无抑制剂组的线性回归方程为:y=8.731 0x+4.891 0。0.04 mg/mL抑制剂组的线性回归方程为:y=14.627 0x+4.824 7。0.08 mg/mL抑制剂组的线性回归方程为:y=21.124 0x+4.879 8。R2均大于0.998 7。由线性回归方程可知随着化橘红柚皮苷质量浓度的增大,直线的横轴截距变小,而纵轴的截距固定不变,即Km变大,Vm不变;底物浓度相同时,抑制剂浓度从0 mg/mL增加到0.08 mg/mL,反应速率降低。由此可推断化橘红柚皮苷对α-葡萄糖苷酶的抑制作用为竞争性抑制,这与文献[20]报道的结果比较一致。

图2 不同时间柚皮苷对α-葡萄糖苷酶活性的抑制作用

图3 柚皮苷对α-葡萄糖苷酶活性抑制作用曲线
2.4 柚皮苷类物质的抑制作用的可逆性分析
采用1.2.4的方法,进一步判断柚皮苷的抑制作用是否可逆,结果如图4所示。
由图4可知,在测定酶活体系中加入不同质量浓度的化橘红柚皮苷类物质后,所得的直线均通过原点,且加入的化橘红柚皮苷质量浓度越大,直线斜率越低;由此可以推测化橘红柚皮苷对α-葡萄糖苷酶的抑制作用是可逆的,这与文献[21]报道的结果较为一致。
寻找有效的天然提取物作为α-葡萄糖苷酶抵制剂具有重要的意义,研究表明天然产物中的黄酮类物质对糖尿病及并发症具有积极的防治作用,柚皮苷属于黄酮中的一种活性物质,柚皮苷类物质不但具有显著的抗氧化、清除自由基的能力,还具较强的抑制α-葡萄糖苷酶活性的能力,研究表明杨梅中的黄酮类化合物与α-葡萄糖苷酶的相互作用力主要是疏水相互作用,通过混合型抑制表现较强的α-葡萄糖苷酶抑制活性,从而降低血糖值[3],地锦草总黄酮对α-葡萄糖苷酶具有显著抑制作用,且其抑制活性呈现一定的剂量依赖[16],另有研究表明五味子中总黄酮对α-葡萄糖苷酶抑制活性约60%,通过竞争抑制调节控制血糖的作用[21],化橘红柚皮苷分子中有类似的酮式羰基结构,分子上的酚羟基位置与数目对α-葡萄糖苷酶的抑制活性影响较大[14],碳原子的游离羟基可增强其对α-葡萄糖苷酶的抑制作用,因此化橘红柚皮苷可作为α-葡萄糖苷酶抑制剂的良好来源。

图4 化橘红柚皮苷对α-葡萄糖苷酶活性抑制作用的可逆性分析
2.5 化橘红柚皮苷对DPPH自由基清除能力
采用1.3的方法比较柚皮苷和抗坏血酸对DPPH自由基清除能力,结果如图5所示。

图5 柚皮苷和抗坏血酸对DPPH自由基的清除能力比较
从图5可知,随着柚皮苷浓度升高,样品对DPPH自由基清除能力增强(p<0.05),但在低浓度下柚皮苷对DPPH自由基的清除能力不明显,其对自由基清除能力低于抗坏血酸,质量浓度0.08 mg/mL时,其DPPH自由基清除率达到73.6%,高于相同质量浓度的抗坏血酸对DPPH自由基的清除能力,表明0.08 mg/mL浓度的柚皮苷具有较好的DPPH自由基清除能力,这与文献[17]的报道较为一致,因此可进一步开发柚皮苷的抗氧化功效。
3 结论
化橘红中的黄酮类物质主要是柚皮苷、新橙皮苷及野漆树苷等,此类物质分子中有酮式羰基结构,分子上的酚羟基位置及数目对其抑制α-葡萄糖苷酶的活性有较大影响。试验结果表明化橘红中的柚皮苷对α-葡萄糖苷酶活性具有较强的抑制作用,其抑制作用具有剂量依赖性和时间依赖性,其对α-葡萄糖苷酶的抑制作用是可逆的。抑制曲线试验表明最大反应速度随化橘红柚皮苷质量浓度的变化而变化,柚皮苷类物质对α-葡萄糖苷酶活性的抑制作用优于阿卡波糖,其对α-葡萄糖苷酶的半抑制浓度IC50为0.008 mg/mL,阳性对照物阿卡波糖的IC50为0.026 mg/mL,且对α-葡萄糖苷酶的抑制类型为竞争可逆型,同时0.08 mg/mL浓度的柚皮苷具有较强的DPPH自由基清除能力,因此化橘红可作为天然的α-葡萄糖苷酶抑制剂的良好来源,这为化橘红柚皮苷的降血糖及抗氧化功能食品或药品的开发及利用提供思路。
