脂多糖对真皮成纤维细胞纤维化相关因子的表达及瘢痕形成的影响
2020-07-18石珊李梦凡王玲古兰田雨欣舒欢
石珊,李梦凡,王玲,古兰,田雨欣,舒欢
空军军医大学西京医院烧伤与皮肤外科,西安 710032
烧伤后创面愈合是一个复杂的病理生理过程,包括炎症、细胞增殖、伤口收缩、胶原代谢,以及细胞、胞外基质与细胞因子间繁杂的相互作用[1]。 作为创面愈合修复的重要效应细胞,成纤维细胞在伤后瘢痕形成及伤口的再塑过程中起着关键性的作用[2-3]。烧伤创面愈合往往形成增生性瘢痕(hypertrophic scar,HS),严重影响患者的生活质 量[4-9]。因此,加速创面愈合、预防或减少增生性瘢痕的形成已成为烧伤领域的重要研究课题[10-12]。烧伤造成的皮肤屏障破损往往引起微生物的侵袭,革兰阴性(G-)菌是烧伤感染常见的微生物,能够在伤口表面释放大量的内毒素(endotoxin),对细胞及胞外基质成分造成损害,延缓创面愈合,甚至引起伤口严重感染。脂多糖(lipopolysaccharide,LPS)作为内毒素的化学成分,其活性、细胞毒性及免疫性往往预示着伤口愈合及瘢痕形成的情况[13-14]。本研究利用体外培养的正常皮肤及增生性瘢痕组织的成纤维细胞,观察LPS作用下细胞纤维化相关因子的表达及亚显微结构的变化,并基于小鼠创面愈合模型,探讨LPS对真皮成纤维细胞纤维化相关因子及增生性瘢痕形成的影响。
1 资料与方法
1.1一般资料 选取2017年11月-2018年11月西京医院烧伤与皮肤外科收治的烧伤早期增生性瘢痕手术患者24例,其中男11例,女13例,年龄11~52(37.3±6.8)岁。纳入标准:①烧伤创面愈合时间12个月以内;②前期未接受其他瘢痕增生治疗或防治;③无感染、器质性疾病、自身免疫性疾病等;④临床表现:烧伤受损部位瘢痕高出体表,充血明显,色泽潮红,伴疼痛、瘙痒等症状;⑤患者知情同意并经医院伦理委员会审查批准。取患者增生性瘢痕组织(面颈部6例,躯干9例,上肢7例,下肢2例)及其周围正常皮肤组织用于实验。
1.2试剂与仪器 LPS购自美国Sigma公司;抗Ⅰ型胶原(collagen Ⅰ,ColⅠ)兔多克隆抗体、抗Ⅲ型胶原(collagen Ⅲ,ColⅢ)兔多克隆抗体购自英国Abcam公司;抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔单克隆抗体、抗β-actin兔单克隆抗体购自美国Cell Signaling公司。ABI7500荧光定量PCR仪购自美国ABI公司;JEM-123透射电镜购自日本JEOL公司。
1.3增生性瘢痕组织病理形态学观察 取患者组织制作石蜡切片,行常规HE染色及Masson染色;每张切片镜下选取6个视野,扫描成纤维细胞数目及胶原灰度,以胶原蛋白指数即灰度所占比例反映增生性瘢痕组织(HS组)与正常皮肤组织(NS组)成纤维细胞合成胶原蛋白的情况。
1.4真皮成纤维细胞的培养 切取适量增生性瘢痕组织及正常皮肤组织,分别剪切成0.5~1.0 mm3小块,用弯头吸管将其均匀接种在培养瓶中,翻转置于37 ℃孵育6 h;将培养瓶转正,加入含10%胎牛血清的DMEM培养基常规培养;待成纤维细胞爬满,用0.25%胰蛋白酶消化、传代、冻存,取第3~5代成纤维细胞用于实验。
1.5LPS致瘢痕形成细胞模型的建立 将冻存的成纤维细胞复苏培养至融合度90%~100%时传代。设正常皮肤成纤维细胞对照组(NSFs组)、正常皮肤成纤维细胞LPS处理组(NSFs+LPS组)、同代增生性瘢痕组织成纤维细胞组(HSFs组)。细胞融合度70%~80%时用于实验。
1.6纤维化相关因子表达水平检测 采用反转录实时定量PCR(reverse transcription-qPCR,RT-qPCR)检测纤维化相关因子mRNA的表达水平。提取患者正常皮肤、增生性瘢痕组织及体外培养的成纤维细胞总RNA,反转录合成cDNA,以其为模板行qPCR,以GAPDH为内参,测定纤维化相关因子ColⅠ、ColⅢ、α-SMA的mRNA相对表达水平。引物序列见表1。
采用免疫组织化学和Western blotting法检测纤维化相关因子蛋白的表达水平。取患者组织的石蜡切片或固定的成纤维细胞爬片,进行ColⅠ、ColⅢ、α-SMA的免疫组化染色,计算阳性着色强度或阳性细胞率。另取培养细胞样品,充分裂解后提取蛋白,进行纤维化因子的Western blotting检测,评价其蛋白表达情况。
1.7成纤维细胞亚显微结构的观察 体外培养的成纤维细胞用2.5%戊二醛固定,离心后再次固定,常规透射电镜制片,观察细胞亚显微结构。

表1 纤维化相关因子的引物序列Tab.1 The primer sequences of fibrosis-related factors
1.8LPS对小鼠创面愈合模型的影响 6~8周龄18~20 g雄性BALB/c小鼠12只,购于本校动物实验中心,常规环境饲养。应用10% NaS脱去小鼠背毛,隔天制备1.0 cm×0.5 cm创面;随机均分为LPS组和PBS组,分别按5 mg/kg体重腹腔注射LPS或等体积PBS;并于第3天、第5天各追加一次;经3周后创面愈合,脱臼处死小鼠,采集愈合组织,制备石蜡切片,进行HE染色、Masson染色,光镜下观察创面大小及其真皮形态结构。
1.9统计学处理 采用SPSS 22.0软件进行统计分析。计量资料以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1增生性瘢痕组织的病理形态学变化 HE染色后,视野内可见嗜苏木精着蓝色的细胞核、伊红染色的细胞质和胞外基质成分。统计显示,增生性瘢痕组织与正常皮肤组织成纤维细胞数的比值为2.43±0.48,增生性瘢痕组织中成纤维细胞明显增多(P<0.05,图1A-C)。Masson染色结果显示,增生性瘢痕组织中胶原纤维粗大,排列紊乱,有些成漩涡状,染色深;正常皮肤组织胶原纤维排列规则,整齐有序,染色较浅;灰度扫描结果显示增生性瘢痕组织与正常皮肤组织胶原蛋白指数的比值为3.90±1.23,增生性瘢痕组织中胶原蛋白明显增多(P<0.01,图1D-F)。
2.2增生性瘢痕组织中纤维化相关因子的表达水平分析 RT-qPCR检测结果显示,与正常皮肤组织(NS)或其成纤维细胞(NSFs)相比,增生性瘢痕组织(HS)与其成纤维细胞(HSFs)的ColⅠ、ColⅢ、α-SMA mRNA相对表达水平均明显增高,差异有统计学意义(图2,P<0.05)。
免疫组化染色显示,增生性瘢痕组织与正常皮肤组织ColⅠ、ColⅢ阳性着色强度的相对比值分别为6.12±1.24(图3A-C,P<0.01)、5.31±1.63(图3D-F,P<0.05);增生性瘢痕组织与正常皮肤组织α-SMA阳性细胞的相对比值为10.21±3.67(图3G-I,P<0.01)。
2.3LPS对成纤维细胞纤维化相关因子表达的影响 RT-qPCR检测结果显示,0.5 μg/ml LPS刺激正常皮肤组织成纤维细胞24 h后,ColⅠ、ColⅢ、α-SMA的mRNA相对表达水平均较正常皮肤成纤维细胞显著增高(P<0.01,图4A)。

图1 增生性瘢痕组织(HS)与正常皮肤组织(NS)的HE与Masson染色(n=6)Fig.1 HE and Masson staining in hyperplastic scar tissue (HS) and normal skin tissue (NS) (n=6)
Western blotting检测结果显示,与正常皮肤组织成纤维细胞对照组相比,正常组织成纤维细胞LPS处理组、同代增生性瘢痕组织成纤维细胞组ColⅠ、ColⅢ、α-SMA蛋白表达水平均明显增高 (P<0.01),而后两组比较差异无统计学意义(P>0.05,图4B-D)。

图2 增生性瘢痕组织(HS)、正常皮肤组织(NS)及其成纤维细胞(HSFs、NSFs)纤维化相关因子mRNA的表达(n=3)Fig.2 mRNA expressions in HS, NS, and their fibrosis-related factors HSFs and NSFs of fibroblasts (n=3)
免疫组织化学染色结果显示,正常皮肤成纤维细胞LPS处理组与正常皮肤成纤维细胞对照组ColⅠ阳性着色强度之比为5.84±1.56,差异有统计学意义(P<0.01,图5A、B、D);同代增生性瘢痕组织成纤维细胞组与正常皮肤成纤维对照组ColⅠ阳性着色强度之比为7.27±1.88,差异有统计学意义 (P<0.01,图5A、C、D);而正常皮肤成纤维细胞LPS处理组与同代瘢痕组织成纤维细胞组ColⅠ阳性着色强度相比没有明显差异(P>0.05,图5B-D)。
2.4 L P S对成纤维细胞亚显微结构的影响 透射电镜观察显示,正常皮肤组织成纤维细胞具有规则扁平的内质网、适量的溶酶体或自噬溶酶体及囊泡状结构(图6 A);L P S刺激的正常皮肤组织成纤维细胞则呈现出肿胀的内质网、萎缩的溶酶体及少量囊泡状结构(图6 B);增生性瘢痕组织成纤维细胞中内质网膨胀,含丰富的自噬溶酶体及囊泡状结构 (图6 C)。
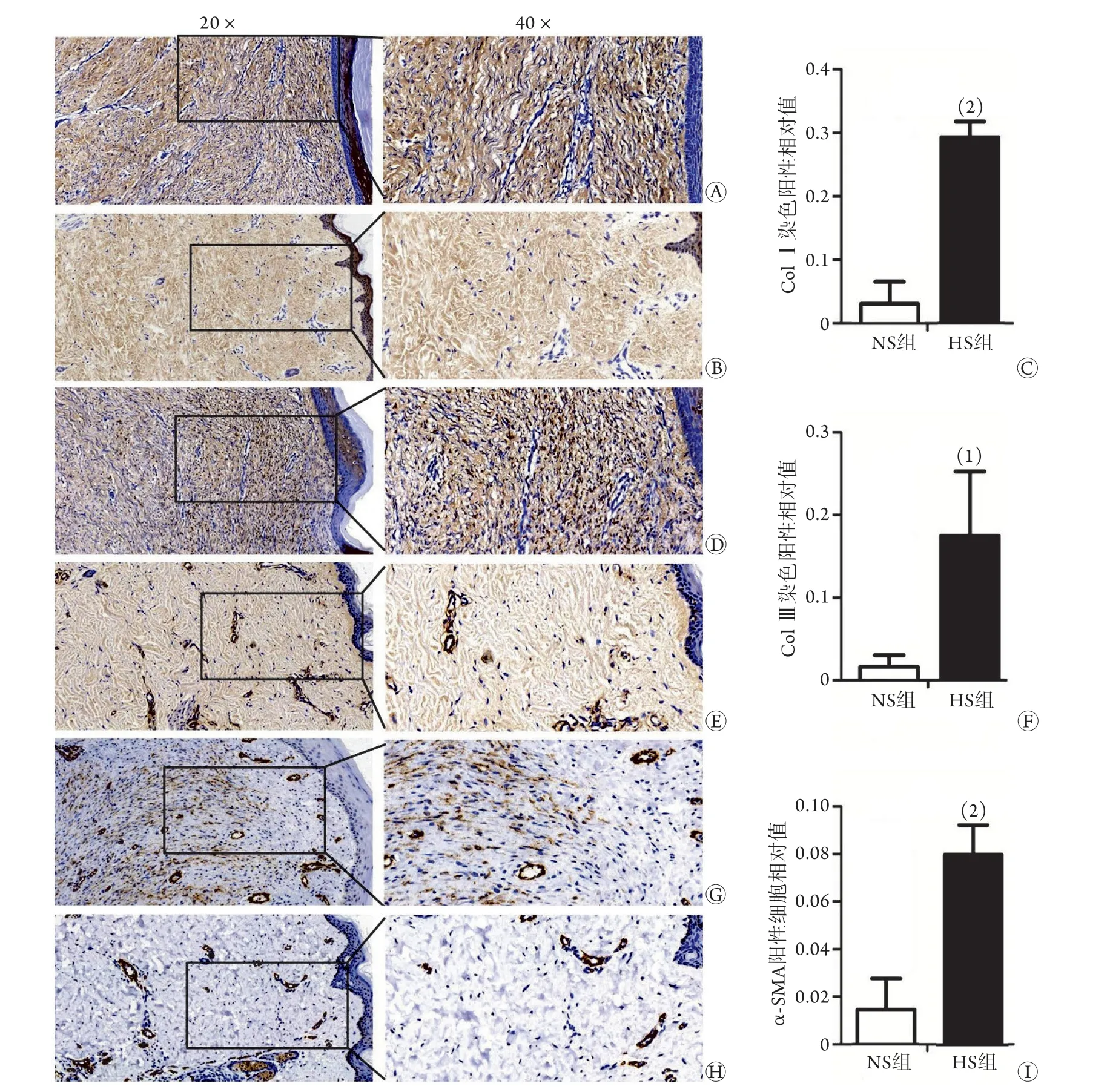
图3 增生性瘢痕组织(HS)与正常皮肤组织(NS)中纤维化相关因子的免疫组化染色(n=6)Fig.3 Immunohistochemical staining for fibrosis-related factors in HS and NS (n=6)

图4 LPS对正常皮肤组织成纤维细胞纤维化相关因子表达水平的影响(n=3)Fig.4 Effects of LPS on the expression levels of NSFs (n=3)

图5 LPS对成纤维细胞Col Ⅰ表达影响的免疫组织化学分析(n=6)Fig.5 Immunohistochemical analysis of the effect of LPS on fibroblast Col Ⅰ (n=6)
2.5LPS对小鼠创面愈合及瘢痕形成的影响 HE染色与Masson染色结果显示,愈合创面周围出现大量的毛囊结构,LPS注射3周后愈合的创面真皮层(切口宽度为0.5 cm)在宽度上与PBS组相比有明显差异(图7A-D,箭头所指)。愈合创面真皮层胶原纤维在PBS组规则有序(图7C),LPS组紊乱无序(图7D),而两组胶原蛋白的分布未观察到明显差异(图7C、D)。

图6 LPS对成纤维细胞亚显微结构的影响Fig.6 Effects of LPS on the ultrastructure of fibroblasts

图7 LPS对小鼠创面愈合及瘢痕形成的影响Fig.7 Effects of LPS on wound healing and scar formation in mice
3 讨 论
伤口创面经炎症期、增殖修复期和再塑期愈合而形成瘢痕。炎症期是创面愈合过程中的关键时期,决定着创面愈合的时间及愈后瘢痕的外观。烧伤患者往往形成增生性瘢痕[10-11,15-18]。虽然目前增生性瘢痕的发生机制尚不明确,但越来越多的研究表明细菌成分及其延长的炎症反应起着关键性的调节作用[13-14,19-21]。增生性瘢痕的发生往往是由创面发生感染引起的,且与慢性炎症存在一定的相关 性[22-23],LPS可能是其重要作用分子。
增生性瘢痕作为一种严重的皮肤纤维化疾病,其显著特点是胞外基质蛋白代谢紊乱及过度沉积,主要包括Ⅰ、Ⅲ型胶原,以及成纤维细胞向肌成纤维细胞的转化(以α-SMA为标志蛋白)[19-21]。本研究发现,LPS可使正常皮肤组织成纤维细胞纤维化相关因子的表达明显升高,胞外基质蛋白过度沉积,诱导正常皮肤成纤维细胞向增生性瘢痕成纤维细胞转化,促进瘢痕的形成。透射电镜观察显示,正常皮肤组织成纤维细胞具有规则扁平的内质网、适量的溶酶体或自噬溶酶体及囊泡状结构,而LPS作用后正常皮肤组织的成纤维细胞呈现内质网肿胀,与增生性瘢痕组织成纤维细胞中内质网极度膨胀结构相似。内质网在纤维化相关因子的合成、加工和运输方面起着重要作用,提示LPS可增加成纤维细胞的异常分化,致使胞外基质蛋白过度合成、分泌并沉积,引起正常皮肤成纤维细胞向增生性瘢痕成纤维细胞表型转化,进而导致增生性瘢痕的形成,这与既往的研究结果相似[24-25]。本研究小鼠创面愈合模型结果显示,LPS能够延缓伤口愈合,导致愈合创面真皮结构胶原纤维排列紊乱,增加了创面的瘢痕化,提示LPS是瘢痕形成的重要因素。
综上所述,LPS作为炎性介质能够使正常皮肤成纤维细胞内质网结构及功能发生改变,造成胞外基质蛋白的过度沉积,从而引起成纤维细胞代谢、增殖、分化等生物学功能的改变,诱导正常成纤维细胞向增生性瘢痕成纤维细胞转化,最终导致增生性瘢痕的形成。
