血清CER、HA和FT3对慢性乙型肝炎肝纤维化的诊断价值
2020-07-18谭立明叶舒慧华蕾郭斌赵永雷张皓承胡泽宇曹梓超吴洋曾婷婷田永建余建林李华陈娟娟
谭立明,叶舒慧,华蕾,郭斌,赵永雷,张皓承,胡泽宇,曹梓超,吴洋,曾婷婷,田永建,余建林,李华,陈娟娟
1南昌大学第二附属医院检验科/江西省检验医学重点实验室,南昌 330006;2南昌大学公共卫生学院,南昌 330006;3宜春市万载县妇幼保健院,江西宜春 336100;4南昌大学第二临床医学院,南昌 330006
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)感染所致。目前,全世界至少有3.5亿CHB患者[1]。HBV不直接杀伤肝细胞,但HBV的活跃复制、肝脏细胞的炎性反应及坏死易使CHB患者肝脏发生纤维化,最终发展成肝硬化及肝细胞肝癌(hepatocellular carcinoma,HCC)。监控CHB患者肝脏纤维化程度,抑制HBV DNA复制、减轻肝脏细胞受损程度,可延缓肝衰竭、肝硬化失代偿及HCC等严重并发症的发生,改善CHB患者的预后和生活质量[2]。肝脏是人体铜蓝蛋白(ceruloplasmin,CER)、游离三碘甲腺原氨酸(free triiodothyronine 3,FT3)代谢的主要器官,透明质酸(hyaluronic acid,HA)是肝脏细胞外基质的重要成分,肝脏功能异常会导致血清CER、HA和FT3水平异常。本研究探讨了血清CER、HA和FT3水平对CHB患者肝脏纤维化程度的评估价值。
1 资料与方法
1.1研究对象 南昌大学第二附属医院2014年7月-2018年1月确诊的患者200例,包括CHB 136例、乙型肝炎后肝硬化44例、HBsAg阳性原发性肝癌20例。随机选取同期50例健康体检者作为对照组。所有患者均符合纳入排除标准,所有标本均在患者知情同意条件下获得。本研究获得南昌大学第二附属医院伦理委员会批准许可。
1.2纳入标准 ①CHB患者均符合2018年美国肝病研究学会制定的CHB诊断标准[3];②肝硬化患者符合《慢性乙型肝炎防治指南》病理诊断标准[1],肝纤维化分期等级≥S4期;③乙型肝炎后肝硬化患者与HCC患者均按照《APASL临床实践指南:肝细胞癌的管理》[4]经过肝脏活检、肝脏影像学检查及临床医师确诊。
1.3排除标准 ①甲、丙、丁、戊型肝炎病毒及人类免疫缺陷病毒(HIV)感染者;②酒精性肝炎、自身免疫性肝炎、原发性胆汁性肝硬化及肝脏转移性癌症者;③合并糖尿病,自身免疫性疾病,严重心脑血管、心脏、肾脏、血液系统疾病者;④近期接受过影响凝血功能的相关治疗者;⑤近期接受过抗肝纤维化治疗或抗病毒治疗者。
1.4方法 所有研究对象均取3 ml晨起空腹外周静脉血,静置30 min后放入离心机中1026×g离心15 min,留取上层血清待检。血清CER的检测采用免疫比浊法(美国贝克曼公司产IMMAGE 800型全自动特定蛋白分析系统及配套试剂)。血清HA和FT3的检测采用化学发光法(美国西门子全自动化学发光免疫分析系统ADVIA Centaur XP)。血小板(PLT)测算采用电阻抗法(SISMEX全自动血液分析仪,型号:XE-2100),谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)的检测使用Beckman AU5800全自动生化分析仪。所有操作均严格遵循各试剂说明书及南昌大学第二附属医院质量管理标准 文件。
1.5肝纤维化无创性诊断 采用AST/PLT比率指数(AST-to-platelet ratio index,APRI)与基于4因子的肝纤维化指标(fibrosis index based on four factors,FIB-4)两种模型分别计算CHB、肝炎后肝硬化及HCC的肝脏纤维化程度。APRI=([AST/ULN*]/PLT)×100;FIB-4=(年龄×AST)/(PLT×ALT0.5)[5-6]。 其中,ULN*为正常值上限40 U/L,AST、ALT单位为U/L,年龄单位为年,PLT单位为109/L。
1.6统计学处理 所有检测结果经EXCEL 2016软件整理分类,利用SPSS 20.0软件进行统计学分析。正态分布数据以±s表示,非正态分布数据以M(P25,P75)表示。对各组数据进行正态性检验和方差齐性检验(Levene's检验)。若同时满足正态性和方差齐性,采用单因素方差分析(one-way ANOVA)进行组间比较,两两比较采用Dunnet t检验、SNK法。未同时满足正态性和方差齐性的数据采用秩和检验,两两比较采用完全随机设计多个样本间多重比较的正态近似法。相关性分析采用Pearson法和Spearman秩相关分析。P<0.05为差异有统计学意义。对检验数据行受试者特征(receiver operating characteristic,ROC)曲线分析,计算ROC曲线下面积(area under the curve,AUC),AUC=0.5~0.7为有较低的诊断准确性,AUC=0.7~0.9为有一定的诊断准确性,AUC>0.9为有较高的诊断准确性。
2 结 果
2.1一般资料 各组间性别比较差异无统计学意义;CHB组和肝硬化失代偿组年龄与对照组比较差异有统计学意义(P<0.05);重度CHB组、失代偿期肝硬化组CER水平均低于对照组,差异有统计学意义(P<0.05);重度CHB组、肝硬化组HA水平均高于对照组,差异有统计学意义(P<0.05);肝硬化组、HCC组FT3水平均低于对照组,差异有统计学意义(P<0.05);中重度CHB组、HCC组AST水平均高于对照组,差异有统计学意义(P<0.05);重度CHB组ALT水平高于对照组,差异有统计学意义(P<0.05);CHB组、肝硬化组、HCC组PLT均低于对照组,差异有统计学意义(P<0.05,表1)。
2.2CER、HA、FT3与肝纤维化APRI、FIB-4的相关性分析 Pearson相关分析结果显示,CER与APRI、FIB-4呈负相关,HA、FT3与APRI、FIB-4均呈正相关(表2)。
2.3CER、HA、FT3诊断肝硬化的可靠性分析 以肝脏活检结果为标准,评价CER、HA和FT3水平诊断肝纤维化分期等级≥S4期的可靠性,结果显示CER、HA敏感度(均为79.1%)高于FT3,FT3的特异度最高,为89.1%(表3)。
2.4CER、HA、FT3诊断肝硬化的ROC曲线分析 CER、HA、FT3诊断肝硬化的AUC分别为0.608、0.826、0.831,三者均具有良好的诊断价值,其中FT3的AUC最大。联合诊断的诊断效能从高到低依次为CER+HA+FT3、HA+FT3、CER+HA和CER+FT3(图1)。
3 讨 论
据世界卫生组织估计,全球约有2.4亿慢性HBV感染者,中国35%~62%的人检出HBV感染标志物[5-6]。CHB的自然过程可以按照病毒-宿主相互作用分为4个阶段:免疫耐受、免疫清除、低复制或无复制及活化。CHB的发病机制较为复杂,迄今尚未完全阐明。研究表明,HBV不直接杀伤肝细胞,其引起的免疫应答是肝细胞损伤及炎症的主要发生机制,而炎症反复存在是CHB进展为肝硬化甚至HCC的重要因素[7]。肝纤维化严重程度是影响CHB患者预后的一个重要因素,此外,它可以辅助确定患者开始进行抗病毒治疗的具体时间,评估抗病毒治疗的疗效,确定开始监测的最佳时间,分析肝癌、肝硬化的发生风险[8]。因此,对CHB患者进行肝纤维化评估至关重要。

?
CER是血清中分离出的一种由肝脏合成的α2-糖蛋白,属于急性期蛋白,在感染、炎症和创伤期其血清水平会上升,机制是炎性细胞因子介导肝细胞基因转录[9]。本研究中,重度CHB患者和CHB后肝硬化进展为失代偿患者血清CER水平显著低于健康对照组;在CHB由轻度发展为重度,肝硬化从代偿状态转变为失代偿状态的过程中,CER水平逐渐降低,这与Zeng等[9]、Yin等[10]的研究一致;ROC曲线分析显示,CER诊断肝硬化的AUC为0.668,提示CER是判断肝脏损害程度的良好指标。肝细胞受到HBV在其内复制带来的免疫损伤后,分泌出的大量细胞因子会引起肝损害甚至肝衰竭,使CER的合成减少[11]。但本研究中,HBV阳性的HCC组患者CER水平升高,可能与HCC导致的CER核心盐藻糖基化修饰有关[10]。
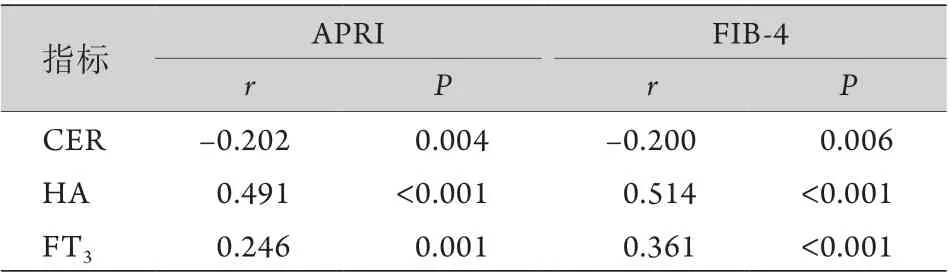
表2 CER、HA、FT3与肝纤维化诊断模型的相关性Tab.2 Correlation analysis of serum CER, HA and FT3 with the diagnostic model of the liver fibrosis

表3 CER、HA、FT3诊断肝硬化的可靠性分析Tab.3 Analysis of the reliability of CER, HA and FT3 for diagnosis of hepatic cirrhosis

图1 CER(A)、HA(B)、FT3(C)及其联合应用(D)诊断肝硬化的ROC曲线分析Fig.1 ROC curve of CER, HA, FT3 and combined detection on the diagnosis of liver cirrhosis
HA是肝细胞外基质的一种重要成分,主要由肝内储脂细胞合成。当肝脏发生纤维化时,纤维细胞和间质细胞增生,导致HA合成增加。同时,肝脏受损又使其分解HA的能力下降,进一步升高了体内HA水平[12]。绝大多数肝病患者血清HA水平呈不同程度上升,尤其是在肝硬化患者中。本研究结果显示,重度CHB组、肝硬化组HA水平高于对照组,差异有统计学意义(P<0.01),且HA与肝纤维化无创诊断模型指数具有中度相关性;HA检测已发生肝硬化患者的AUC为0.826,有较好的诊断价值,提示HA是评价肝脏纤维化程度的良好指标。鉴于早期的肝纤维化是可逆的,而肝硬化是不可逆的[13],因此,可通过对CHB患者进行HA检测以监测其肝脏纤维化程度,从而早期发现、早期治疗肝脏纤维化。
肝脏是众多激素代谢的主要场所,CHB患者易并发甲状腺疾病。转化生长因子-β(transforming growth factor-β,TGF-β)是最主要的促进纤维化的细胞因子,通过激活SMAD转录因子发挥作用[14]。而3,5,3,-三碘甲腺原氨酸(triiodothyronine,T3)可通过与核受体结合抑制TGF-β/SMAD通路转录激活,从而抑制纤维化的发生。CHB患者肝脏功能受损,代谢激素能力减弱,且肝脏纤维化导致合成代谢降低、分解代谢升高,进一步降低了甲状腺激素水平,有学者指出肝纤维化患者甲状腺激素水平越低,预后越差[15]。FT3是甲状腺激素T3的活性部分,故血清FT3水平与肝脏纤维化有密切关系[16]。 本研究结果显示,肝硬化组、HCC组FT3水平均低于对照组,差异有统计学意义,且血清FT3水平与肝纤维化无创诊断模型具有相关性。FT3诊断肝硬化的ROC曲线下面积为0.831,有较好的诊断价值。提示血清FT3水平也是评价肝脏纤维化及CHB患者预后的较好指标。
早期监测CHB患者肝脏纤维化及肝功能损害程度至关重要[17]。目前,肝纤维化诊断的金标准仍是肝脏活检,但由于其具有侵入性、风险性和价格较高等特点,且肝脏标本选取位置及观察视野的差异等也会导致最终结果出现偏差,故不能用于CHB患者肝纤维化程度的持续监控[18]。而血清学标本可重复、多次采集,并可实现持续监控。本研究证实血清CER、HA、FT3水平在CHB进展为肝硬化、HCC的过程中有提示作用,且与肝纤维化无创诊断模型相比,三者与肝纤维化水平均具有相关性,联合诊断肝硬化的检验效能良好。
