NaC1胁迫对甜瓜幼苗相关生理指标的影响
2020-07-18郝永胜刘熙汪季涛李甜竹胡克玲
郝永胜, 刘熙, 汪季涛, 李甜竹, 胡克玲
NaC1胁迫对甜瓜幼苗相关生理指标的影响
郝永胜1, 刘熙1, 汪季涛2, 李甜竹1, 胡克玲1
(1. 安徽农业大学 园艺学院, 安徽 合肥, 230036; 2. 安徽中烟工业有限责任公司,安徽 合肥, 230088)
以NaC1作为盐胁迫处理, 采用水培方式, 研究盐胁迫对甜瓜幼苗生长和相关生理特性的影响。本试验处理分别为T1表示对照, T2表示NaC1胁迫处理浓度为50 mmol/L、T3表示NaC1胁迫处理浓度为100 mmol/L、T4表示NaC1胁迫处理浓度为150 mmol/L、T5表示NaC1胁迫处理浓度为200 mmol/L, 分析NaC1胁迫对甜瓜幼苗生长、光合速率及抗氧化酶活性等相关生理生化指标的影响。结果显示: 随着NaC1胁迫浓度的增加, 抑制了甜瓜幼苗的生长; 降低了光合色素含量和叶片光合速率; SOD活性、CAT活性、脯氨酸含量、GSH含量和GSH/GSSG比值呈现先增加后降低的趋势, 但是POD活性、H2O2含量、GSSG含量和GSH+GSSG含量呈现逐渐增加的趋势。结果表明, 在NaC1胁迫下, 甜瓜幼苗通过调节自身的反应缓解NaC1胁迫的危害, 但随着盐胁迫浓度的增加, 甜瓜幼苗产生了不可逆的伤害。
甜瓜; NaC1胁迫; 生理指标
随着现代化农业的发展, 我国的设施农业发展非常迅速, 但我国设施栽培的可控性和栽培管理手段较落后, 作物栽培过程极易受到环境的影响, 如低温弱光、土壤盐渍化、干旱等, 其中盐胁迫容易导致作物失水、离子失衡、营养亏缺等[1], 在世界范围内仍旧是影响作物产量和质量的主要因素之一[2–3], 容易引起作物代谢紊乱如活性氧生成与清除的失衡、光合作用下降等, 造成设施作物产量大幅降低和品质下降[4–5]。
盐胁迫影响植物的营养物质吸收, 产生渗透胁迫, 降低植物的光合作用, 也会产生氧化胁迫, 抑制植物的生长[5–7]。孙超等研究发现, 盐胁迫导致黄瓜幼苗光合色素含量、净光合速率、暗呼吸速率和蒸腾速率显著降低[8]。此外, 盐胁迫还会扰动离子的动态平衡, 使细胞膜透性增大, 随着胁迫浓度增大和时间的延长, 可能会对植物产生不可逆的伤害[9]。活性氧(ROS)一直被认为是导致膜脂过氧化、蛋白质变性、核酸突变等损伤细胞的有害物质, 盐胁迫也影响了植物活性氧的代谢。研究发现, 随着盐胁迫浓度的增加, 侧柏幼苗叶片H2O2等含量增加[10]。为了适应这种逆境环境, 植物体也产生了相应的清除系统, 由酶和非酶系统组成, 主要有SOD、POD、CAT、谷胱甘肽和脯氨酸等来维持植物的平衡状态。
甜瓜(L.)是深受人们喜爱的一种园艺产品, 随着设施农业的发展, 甜瓜的设施栽培面积也在逐年扩大, 开展盐胁迫对甜瓜的不良影响的研究具有十分重要的意义。因此, 本试验以甜瓜幼苗为试材, 研究了NaC1胁迫下甜瓜幼苗形态指标、相关抗氧化酶的活性以及光合色素含量等指标的变化, 以期在一定程度上对甜瓜栽培提供理论指导。
1 材料与方法
1.1 试验材料与处理
本试验在安徽农业大学温室进行, 以甜瓜“小麦酥”为试验材料, 种子由市场购买。在人工气候箱内进行催芽, 温度保持在28 ℃, 种子露白后播种于营养钵中。采用基质育苗, 营养钵内基质为蛭石与草炭, 按体积比控制在1﹕1。当3叶1心时, 采用水培, 先以1/2 Hoagland营养液培养1周, 第2周用Hoagland营养液培养, 第3周进行相关处理。
本试验选用NaC1作为盐胁迫处理, 以清水处理作为对照, NaC1处理浓度分别为50、100、150、200 mmol/L。处理时按NaC1胁迫浓度从小到大依次将5组处理标记为T1(对照)、T2、T3、T4、T5。每个处理重复3次, 处理7 d后进行相关指标的测定。
1.2 相关指标测定方法
1.2.1 形态指标测定
用直尺测量甜瓜株高; 茎粗用游标卡尺进行测量; 地上部鲜重用电子天平称量。
1.2.2 光合速率测定
选取甜瓜幼苗同叶位叶片, 采用便携式光合测定仪LCpro+(英国ADC公司), 于9: 00~11: 00进行光合速率的测定。
1.2.3 光合色素和脯氨酸含量测定
采用ELISA法检测血清透明质酸含量,具体方法如下:清晨抽取患者空腹外周血4 ml,室内静置2小时后,采用3 000 r/min速度离心12 min,分离上清液后置于-70℃环境下保存待检,采用美国cell signal公司生产的ELISA试剂盒进行测定,操作按照试剂盒说明进行,采用酶标仪MK3测量。
取0.3 g叶片, 分别放入研钵中, 用80%的丙酮研成匀浆, 再加95%乙醇10 mL, 继续研磨至组织变白, 按照李合生的测定方法, 在波长665、649、470 nm下测定吸光度[11]。
1.2.4 抗氧化酶活性测定
取0.3 g叶片, 加入2 mL的PBS缓冲液, 冰浴中匀浆, 4oC环境12 100 g离心15 min, 取上清液。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)测定方法参考Hu的测定方法[12]。
1.2.5 GSH含量测定
称取0.3 g叶片, 加入5%TCA研磨, 获得提取液, 2 000 g离心15 min, 取上清液进行测定[13]。
1.2.6 H2O2含量测定
称取0.3 g叶片, 在液氮中研磨均匀, 加入2 mL浓度为0.2 M的HClO4, 倒入10 mL离心管中再加入0.2 mL的0.2 M的HClO4, 4oC环境2 700 g离心30 min, 取上清液加入4 M KOH至上清液调pH值, 用活性炭吸附色素, 涡旋后, 4oC环境12 000 g离心5 min, 取上清液过膜待测[13]。
1.2.7 脯氨酸的测定方法
取0.3 g叶片, 放入大管中, 然后向管中加入5 mL的3%磺基水杨酸溶液, 在沸水浴中提取10 min冷却后过滤于干净的试管中。吸取2 mL提取液于干净的带玻塞试管中, 加入2 mL冰醋酸及2 mL酸性茚三酮试剂, 在沸水浴中加热30 min, 冷却后加入4 mL甲苯, 摇荡30 s, 静置片刻, 取上层液至10 mL离心管中, 在1 000 g下离心5 min, 待测[11]。
1.2.8 数据分析
作图采用Excel, 采用SAS 8.0进行数据显著差异性分析。
2 结果与分析
2.1 NaCl胁迫对甜瓜幼苗生长的影响
甜瓜幼苗的株高、茎粗、鲜重等指标是反映幼苗生长情况最直接的生理指标。由表1可知, 随着NaCl胁迫浓度的增大, 甜瓜幼苗的各项指标均呈减少的趋势。与对照相比, 50 mmol/L NaCl处理下的甜瓜幼苗各指标差异不显著, 但100~200 mmol/L NaCl处理下株高和茎粗达差异显著, 鲜重在NaCl处理浓度大于150 mmol/L 时达差异显著。100 mmol/L NaCl胁迫处理与150 mmol/L NaCl胁迫处理对比发现, 甜瓜幼苗各指标没有显著差异。说明在本试验条件下当NaCl处理浓度越高, 盐胁迫对甜瓜幼苗生长抑制程度越大。
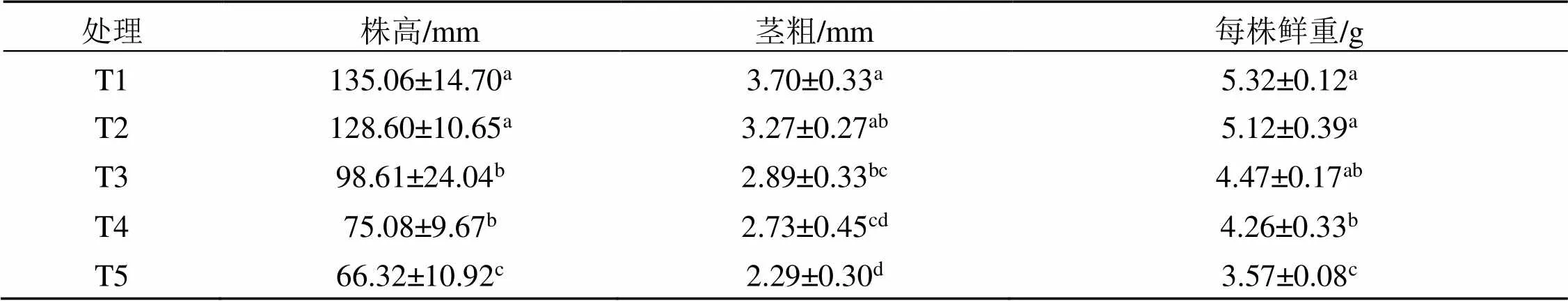
表1 不同浓度NaCl胁迫处理对甜瓜幼苗生长指标的影响
注: 表中同列不同字母表示不同处理在5%水平上具有显著差异; T1: 对照, T2: 50 mmol/L NaCl胁迫处理, T3: 100 mmol/L NaCl胁迫处理, T4: 150 mmol/L NaCl胁迫处理, T5: 200 mmol/L NaCl胁迫处理, 下同。
2.2 NaCl胁迫对甜瓜幼苗光和色素含量的影响
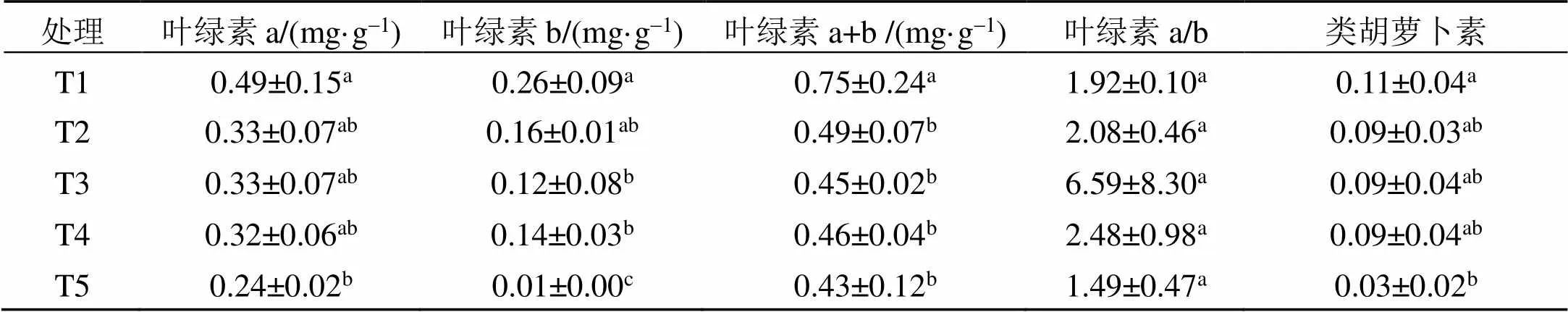
表2 不同浓度NaCl胁迫处理对甜瓜幼苗光合色素含量的影响
表2为不同浓度NaCl胁迫处理对甜瓜幼苗光合色素含量的影响, 由表2可知: 随着NaCl胁迫处理浓度的提高, 叶绿素a、叶绿素b和叶绿素a+b、类胡萝卜素呈现相似的变化规律, 均呈现递减的趋势, 说明在NaCl胁迫条件下导致了甜瓜幼苗叶片光合色素的降解, 其中叶绿素a和类胡萝卜素含量在200 mmol/L NaCl胁迫处理与对照相比达差异显著; 叶绿素b含量在50 mmol/L NaCl胁迫处理与对照相比差异不显著, 其他处理均达到差异显著水平; 叶绿素a+b各处理均与对照相比达差异显著水平, 但处理之间差异不显著; 在本试验条件下, 叶绿素a/b的值没有发生变化。

图1 不同浓度NaCl胁迫处理对甜瓜幼苗光合速率的影响
注: 图中不同字母表示在5%水平上具有显著差异; T1: 对照, T2: 50 mmol/L NaCl胁迫处理, T3: 100 mmol/L NaCl胁迫处理, T4: 150 mmol/L NaCl胁迫处理, T5: 200 mmol/L NaCl胁迫处理, 下同。
2.3 NaCl胁迫对甜瓜幼苗光合速率的影响
图1为不同浓度NaCl胁迫处理对甜瓜幼苗光合速率的影响。由图1可知, 随着NaCl胁迫浓度的增加, 与对照相比, NaCl胁迫处理均达到差异显著水平, 说明NaCl胁迫处理下, 直接影响了甜瓜幼苗的光合作用, 但是处理之间差异不显著。
2.4 NaCl胁迫对甜瓜脯氨酸、H2O2含量和抗氧化酶活性的影响
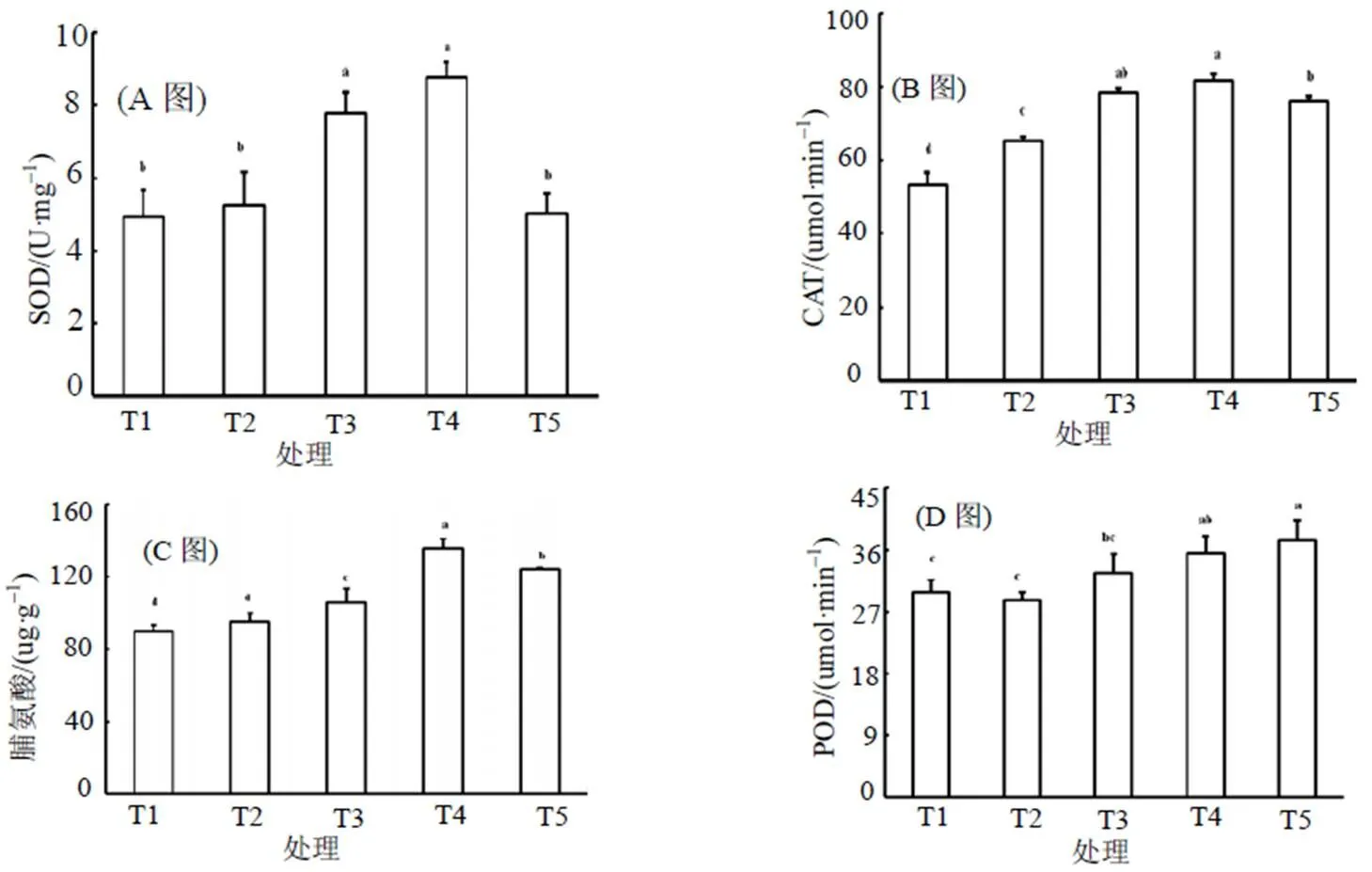
植物在逆境胁迫下, 能增强自身的防御系统以抵抗不良环境。从图2可知, 与对照相比, 在本试验中低浓度(50 mmol/L) NaCl胁迫仅提高CAT活性, 对SOD活性、POD活性、脯氨酸和H2O2含量均没有显著影响; 但随着NaCl胁迫浓度的增加, 脯氨酸含量、SOD和CAT活性呈现先增加后降低的趋势, 其中脯氨酸含量和CAT活性, 在NaCl胁迫浓度在100~200 mmol/L时, 均与对照达差异显著水平。在NaCl胁迫浓度大于100 mmol/L时, POD活性和H2O2含量随着处理浓度呈现递增趋势。
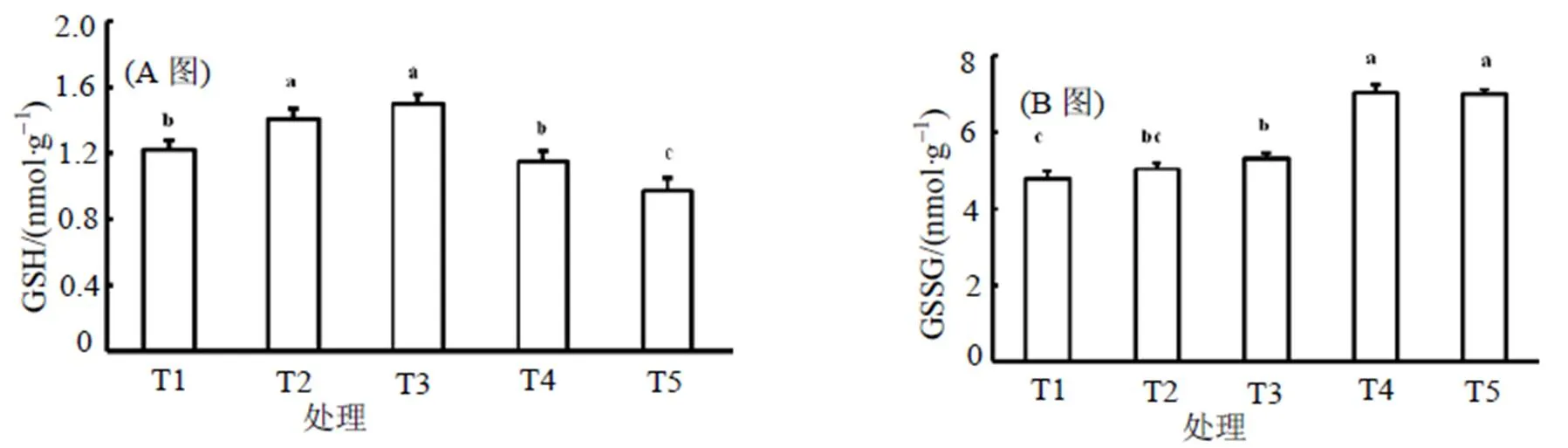
2.5 NaCl胁迫对甜瓜幼苗谷胱甘肽氧化还原状态的影响
图3为不同浓度NaCl胁迫处理对甜瓜幼苗谷胱甘肽含量的影响。由图3可知, 随着NaCl胁迫浓度的增加, GSH含量和GSH/GSSG呈现先增加后降低的趋势, 在NaCl胁迫浓度50~100 mmol/L时, 比对照显著增加; 而GSSG含量和GSH+GSSG含量呈现逐渐增加趋势, GSSG含量在NaCl胁迫浓度大于100 mmol/L时比对照显著增加, GSH+GSSG含量在NaCl胁迫浓度大于50 mmol/L时比对照显著增加。
3 讨论
盐胁迫影响了甜瓜幼苗的生长, 并且随着盐浓度的增加, 对植株生长的影响呈现加重的趋势(表1), 这可能是由于随着盐胁迫浓度的提高, Na+和Cl-抑制了植株对水分和相关营养物质的吸收[14], 影响了植株的生长发育[15]。夏世龙也发现在盐碱胁迫下对甜瓜的植株生长具有浓度依赖性[16]。
光合色素是光能的受体, 在植物的光合作用中具有非常重要的作用, 是反映植物光合能力的一个重要指标, 但也容易受到环境因子等因素的影响[15, 17]。本试验结果表明, NaCl胁迫下甜瓜幼苗的叶绿素产生了降解, 这与王玉萍等[17]研究的结果是一致的, 可能是由于NaCl胁迫下, 对植物的叶绿体造成了伤害, 进而使叶绿素含量降低。但陈友根等[18]研究发现, 随着盐胁迫处理浓度的增加, 甜瓜叶绿素含量呈现先增加后降低的趋势, 这可能是由于试验选择的甜瓜品种、NaCl胁迫的浓度及处理时间等不同有关[19]。类胡萝卜素也在植物中参与光吸收, 也具有防止膜脂过氧化的作用[20]。在本试验中, 类胡萝卜素含量和光合速率随着盐胁迫浓度增加呈现降低的趋势, 这个结果与郑州元等[21]和孙超等[8]的结果一致。气体交换参数能反映作物受逆境伤害的程度, 当植株处在盐胁迫时的光合速率会明显受到抑制[22]。
盐胁迫使作物体内活性氧含量增加, 为了清除活性氧, 酶和非酶系统都展开了积极的响应。但随着盐浓度的提高, 甜瓜体内ROS不能被有效的清除, 导致作物受到了盐胁迫的危害。H2O2是植物一种很重要的活性氧, 本试验发现随着胁迫程度的加深, 导致了H2O2的积累, 并且积累量不断增加, 加重了植物的膜质过氧化。SOD和POD的活性在适宜NaCl胁迫浓度下是增加的, 也是植物对逆境的自我保护。CAT能将逆境胁迫条件下生产的H2O2分解为H2O和O2, 在本试验中, 随着NaCl胁迫程度的加深, H2O2的含量是逐渐增加的, 但CAT的活性是呈现先增加后降低的趋势, 这可能是由于在200 mmol/L处理条件下, 对植株的伤害达到了不可逆转的程度, 不能缓解盐胁迫对植物带来的伤害。在逆境胁迫下, 植物可以通过调节脯氨酸等物质来缓解逆境的伤害, 有研究发现随着NaCl 胁迫浓度的增加, 脯氨酸含量呈增加趋势[23], 但在本试验条件下随着NaCl胁迫浓度的增加, 脯氨酸含量先增加后减少的趋势, 这可能是由于品种的耐盐性存在一定的差异导致的。
本试验研究中发现, 低浓度的NaCl胁迫、GSH含量和GSH/GSSG升高可能是植物对胁迫的一种适应性反应, 来清除ROS, 减轻ROS对甜瓜的伤害。随着NaCl胁迫浓度的增加, GSH含量降低, GSSG含量升高, GSH/GSSG逐渐降低, 说明甜瓜幼苗对盐胁迫引起的逆境已经失去了自我调整的能力, 也说明了谷胱甘肽参与了植物对盐胁迫的调控。
综合分析得知, 随着NaCl胁迫程度的增加, 使H2O2更多的释放, 细胞内物质外渗, 造成光合色素降解, 破坏植物的光合机构, 降低了植物的光合速率, 甜瓜幼苗的酶和非酶系统展开抵抗, 但随着NaCl胁迫程度继续加强, 给植株造成不可逆的伤害, 显著抑制了作物的生长发育。
[1] Maia J M, Costa de Macedo CE, Voigt EL, et al. Antioxidative enzymatic protection in leaves of two contrasting cowpea cultivars under salinity [J]. Biologia Plantarum, 2010, 54 (1): 159–163.
[2] Tarchoune I, Sgherri C, Izzo R, et al. Changes in the antioxidative systems ofL. (cv. Fine) under different sodium salts [J]. Acta Physiology Plant, 2012, 34: 1 873–1 881.
[3] 马梅, 刘冉, 郑春芳, 等.油菜素内酯对盐渍下油菜幼苗生长的调控效应及其生理机制[J]. 生态学报, 2015, 35(6), 1–11.
[4] Parul P, Samiksha S, Rachana S, et al. Effect of salinity stress on plants and its tolerance strategies: a review [J]. Environ Sci Pollute Res, 2015, 22: 4 056–4 075.
[5] 赵莹, 杨克军, 赵长江, 等. 外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫[J]. 中国农业科学, 2014, 47(20): 3 962–3 972.
[6] 夏世龙, 张宇, 孙爽, 等. 盐碱胁迫对甜瓜幼苗生长和物质积累的影响[J]. 吉林农业科学, 2015, 40(5): 97–101.
[7] 王素平, 郭世荣, 胡晓辉, 等. 盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J]. 江西农业大学学报, 2006, 28(1): 32–38.
[8] 孙超, 单楠, 王慧娟, 等. 盐胁迫对黄瓜幼苗光合作用及其关键酶基因表达特性的影响[J]. 2016(8): 29–34.
[9] 刘倩, 高娅妮, 柳旭, 等. 植物对盐碱胁迫的响应机制研究进展[J]. 生态学报, 2017, 3: 25.
[10] 姚侠妹, 纪敬, 岳剑云, 等. ABA对盐胁迫下侧柏活性氧代谢及其相关基因表达的研究[J]. 西北植物学报, 2017, 37(1): 0105–0114.
[11] 李合生. 植物生理生化实验原理和技术[M]. 1版. 北京: 高等教育出版社, 2000.
[12] Hu K L, Zhang L, Wang J T, You Y. Influence of selenium on growth, lipid peroxidation and antioxidative enzyme activity in melon (L.) seedlings under salt stress [J]. Acta Soc Bot Pol, 2013, 82(3): 193–197.
[13] 姜玉萍. 氧化还原信号介导的表油菜素内醋对黄瓜光合作用的调控[D]. 杭州: 浙江大学, 2010.
[14] Tavakkoli E, Fatehi F, Coventry S, et al. Additive effects of Na+and Cl-ions on barley growth under salinity stress [J]. J Exp Bot, 2011, 62: 2 189–2 203.
[15] 王素平, 李娟, 郭世荣, 等. NaC胁迫对黄瓜幼苗植株生长和光合特性的影响[J]. 西北植物学报, 2006, 26(3): 455–461.
[16] 夏世龙, 张宇, 孙爽, 等. 盐碱胁迫对甜瓜幼苗生长和物质积累的影响[J]. 吉林农业科学, 2015, 40(5): 97–101.
[17] 王玉萍, 王映霞, 白向利, 等. 硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响[J]. 草业学报, 2015, 24(5): 108–116.
[18] 陈友根, 章敏, 王冬良, 等. 甜瓜幼苗对NaCl胁迫伤害的生理响应[J]. 安徽农业科学, 2009, 37(8): 3 390–3 392.
[19] Megdiche W, Hessini K, Gharbi F, et al. Photosynthesis and photosystem 2 efficiency of two salt-adapted halophytic seashore Cakile maritima ecotypes [J]. Photosynthetica, 2008, 46(3): 410–419.
[20] 霍培, 季静, 王罡, 等. 植物类胡萝卜素生物合成及功能[J]. 中国生物工程杂志, 2011, 31(11): 107–113.
[21] 郑州元, 林海荣, 崔辉梅. 外源硫化氢对盐胁迫下加工番茄幼苗生理生化特性的影响[J]. 华北农学报, 2017, 32(1): 208–214.
[22] 束胜, 郭世荣, 孙锦, 等. 盐胁迫下植物光合作用的研究进展[J]. 中国蔬菜, 2012(18): 53–61.
[23] 张玉鑫, 康恩祥, 马凌之, 等. NaCl 胁迫对甜瓜幼苗叶片膜脂过氧化和渗透调节物质的影响[J]. 果树学报, 2007, 24(2): 194–198.
Effect of NaC1 stress on growth and related physiological characteristics of melon seedling
Hao Yongsheng1, Liu Xi1, Wang Jitao2, Li Tianzhu1, Hu Keling1
(1. Department of Horticulture, Anhui Agriculture University, HeFei 230036, China; 2. China Tobacco Anhui Industrial Co LTD, Hefei 230088, China)
The effects of salt stress by using NaC1 on the growth and related physiological characteristics of melon seedlings is studied by using hydroponics. T2 showed NaC1 stress treatment concentration of 50 mmol/L, T3 said NaC1 stress treatment concentration of 100 mmol/L, T4 said NaC1 stress treatment concentration of 150 mmol/L, T5 indicated NaC1 stress treatment concentration of 200 mmol/L in this experiment, the effects of NaC1 stress on the growth, photosynthetic rate and antioxidant enzymes and so on of melon seedlings were analyzed. The results showed that with the increase of NaC1 stress concentration, the growth of melon seedlings was inhibited; the photosynthetic pigment content and leaf photosynthetic rate were reduced; SOD activity, CAT activity, proline content, GSH content and GSH/GSSG ratio increased first and then decreased, but the contents of POD, H2O2, GSSG and GSH + GSSG increased gradually. The results indicated that under the NaC1 stress, melon seedlings could relieve the damage of NaC1 by regulating their reaction, but with the increase of salt stress, melon seedlings produced irreversible damage.
melon; NaC1 stress; physiological characteristics
S 501
A
1672–6146(2020)03–0059–06
10.3969/j.issn.1672–6146.2020.03.011
郝永胜, 614285156@qq.com;胡克玲, klhu@ahau.edu.cn。
2019–10–18
安徽省重点研究与开发计划项目(201834040011); 安徽省教育厅自然科学研究重点项目(KJ2018A0154); 安徽农业大学大学生创新创业训练计划项目(201810364185); 安徽农业大学教学研究项目(2017aujyxm098)。
(责任编校: 郭冬生)
