基于肠道特异性丙酮酸激酶M2基因敲除小鼠研究布拉氏酵母菌治疗溃疡性结肠炎的作用及机制
2020-07-18步楠范彦秋赵春红
步楠 范彦秋 赵春红
佳木斯市中心医院消化内科(黑龙江佳木斯154002)
溃疡性结肠炎(ulcerative colitis,UC)是一类发病机制未完全阐明的非特异性炎症性肠病,临床上也缺乏特效的治疗手段。现有的研究认为炎症反应及免疫应答异常、肠道菌群紊乱、肠黏膜屏障破坏与UC 的发生密切相关[1-2]。布拉氏酵母菌是具有耐热耐酸特性的微生态制剂,进入肠道后能够调节肠道菌群平衡,已有研究报道布拉氏酵母菌用于UC 小鼠治疗能够抑制肠道炎症反应、改善肠黏膜屏障功能[3-4],但布拉氏酵母菌发挥上述治疗作用的机制仍未阐明。因此,本研究将对布拉氏酵母菌治疗UC 的分子机制进行深入探讨。
丙酮酸激酶(pyruvate kinase,PK)是糖酵解过程中的关键酶,PK包括PKL、PKR、PKM1、PKM2四种亚型,其中PKM2还具有转录辅助因子的作用,在恶性肿瘤发生发展过程中参与细胞增殖、凋亡的调控。近年来有研究报道PKM2 表达异常与UC 的发病有关,在UC患者肠黏膜中,PKM2的表达明显减少;在葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎小鼠中,敲除PKM2 能够加重肠黏膜炎症、破坏肠黏膜上皮紧密连接、增加炎症因子含量[5]。本课题组前期的预实验发现,布拉氏酵母菌对肠黏膜中PKM2 的表达具有促进作用,但目前关于布拉氏酵母菌是否通过PKM2 在UC 治疗中发挥抑制炎症反应、改善黏膜屏障的作用仍未明确。为此,本实验将以肠道特异性PKM2 基因敲除小鼠为对象,一方面验证布拉氏酵母菌治疗UC 的作用,另一方面探究布拉氏酵母菌治疗UC 的机制,旨在为今后临床使用布拉氏酵母菌治疗UC的奠定理论基础。
1 材料与方法
1.1 动物野生型C57BL/6J 小鼠购自上海西普尔-必凯实验动物公司,生产许可SCXK(沪)2018-0006;Villin-Cre 小鼠(遗传背景C57BL/6J)、PKM2FLOX/+小鼠(遗传背景C57BL/6J)购自上海南方模式生物科技公司。
1.2 试剂与仪器布拉氏酵母购自法国百科达制药厂,HE 染色试剂盒购自上海歌凡生物,RIPA 蛋白裂解液、BCA 蛋白定量试剂盒购自上海贝博生物科技公司,闭锁小带蛋白-1(zonula occludens protein 1,ZO-1)、闭锁蛋白(Occludin)、Claudin-1 的单克隆抗体购自Abcam 公司,二胺氧化酶、D-乳酸、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)的酶联免疫吸附法(enzyme-linked immunosorbent assay,Elisa)试剂盒购自上海西唐公司。
1.3 方法
1.3.1 肠道特异性PKM2 基因敲除小鼠的获取Villin-Cre 小鼠与PKM2FLOX/+小鼠同笼,获得PKM2+/+Cre+、PKM2FLOX/+Cre+、PKM2FLOX/FLOXCre+的后代小鼠,剪取尾巴末端约0.5 cm,采用基因组DNA 提取试剂盒提取DNA,采用北京唯德生物科技有限公司提供的引物对DNA进行PCR扩增,PCR产物进行琼脂糖凝胶电泳,产物为一条带的即为PKM2FLOX/FLOXCre+小鼠,Cre 酶可以剪切PKM2 两个loxP位点间的序列,进而实现PKM2基因的敲除。
1.3.2 动物分组、造模及给药野生型C57BL/6J小鼠随机分为PKM2-WT 组、PKM2-WT+UC 组、PKM2-WT+UC+布拉氏酵母菌组,PKM2FLOX/FLOX-Cre+小鼠随机分为PKM2-KO 组、PKM2-KO+UC组、PKM2-KO+UC+布拉氏酵母菌组,每组各10只。UC 造模方法如下:自由引用含有2.5%DSS 的高压灭菌饮用水、连续7 d;布拉氏酵母菌组干预方法如下:2.6×107CFU/mL 布拉氏酵母菌液0.2 mL/次灌胃、2 次/d、连续7 d。
1.3.3 疾病活动指数(disease activity index,DAI)的评估开始造模及干预后,每天观察小鼠进食、饮水、活动等一般状况,称重并记录,观察粪便性状及便血情况,参照HARNAMOTO 等[6]的标准进行DAI 评分,DAI 评分越高、UC 病情越重。
1.3.4 肠黏膜HE 染色及组织病理评分造模后处死小鼠,收集适量结肠组织,生理盐水清洗后用4%多聚甲醛固定、石蜡包埋并切片,HE 染色后在400 倍显微镜下观察肠黏膜的病理改变,参照文献进行组织病理评分,包括中性粒细胞及淋巴细胞浸润0~3 分、潘氏细胞和杯状细胞脱颗粒0~2分、上皮细胞反应0~3 分、炎症病灶0~3 分,各项评分相加即为组织病理评分,评分越高、肠黏膜病理损伤越重。
1.3.5 血清中二胺氧化酶、D-乳酸含量的检测造模后处死小鼠,收集外周血3~5 mL,静置0.5 h后3 000 r/min 离心获得血清样本,采用Elisa 试剂盒测定血清中二胺氧化酶(DAO)、D-乳酸(D-LA)的含量。
1.3.6 肠黏膜中PKM2、ZO-1、Occludin、Claudin-1表达的检测另取适量结肠组织,分离肠黏膜后采用RIPA 裂解液提取组织中的蛋白,采用BCA试剂盒测定蛋白测定蛋白含量,取含有20 μg 蛋白的样本进行Western Blot,将样本加入SDS-聚丙烯酰胺凝胶后进行电泳、电转PVDF 膜,5%脱脂牛奶室温封闭PVDF 膜1 小时PKM2、ZO-1、Occludin、Claudin-1 一抗4 ℃孵育PVDF 膜过夜。次日,HRP 二抗室温孵育PVDF 膜1 h,最后在凝胶成像仪中显影得到蛋白条带,根据条带灰度值计算蛋白表达量。
1.3.7 肠黏膜中TNF-α、IL-1β 含量的Elisa 检测按照1.3.6 中相同的方法获得肠黏膜组织的蛋白样本并测定蛋白含量,采用Elisa 试剂盒测定TNF-α、IL-1β 的含量,计算每毫克蛋白中TNF-α、IL-1β 的含量。
1.4 统计学方法采用SPSS 22.0 进行数据统计,计量资料采用均数±标准差表示,多组间的比较采用方差分析,P<0.05 为差异有条件学意义。
2 结果
2.1 各组小鼠DAI 的比较第3 天起,PKM2-WT+UC 组小鼠的DAI 明显高于PKM2-WT 组(P<0.05),PKM2-KO+UC 组小鼠的DAI 评分均低于PKM2-WT+UC 组(P<0.05);第4 天起,PKM2-WT+UC+布拉氏酵母菌组小鼠的DAI 明显低于PKM2-WT+UC 组(P<0.05),PKM2-KO+UC+布拉氏酵母菌组小鼠的DAI 明显高于PKM2-WT+UC+布拉氏酵母菌组(P<0.05);PKM2-KO 组小鼠的DAI 评分与KM2-WT 组比较差异无统计学意义(P>0.05)。
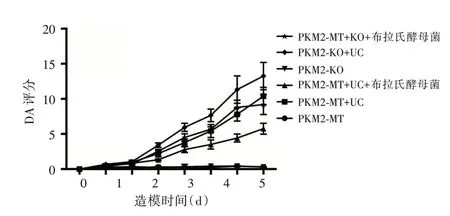
图1 各组小鼠DAI 的比较Fig.1 Comparison of DAI among each groups
2.2 各组小鼠肠黏膜中PKM2 表达的比较PKM2-WT+UC 组小鼠肠黏膜中PKM2 的表达量明显低于PKM2-WT 组(P<0.05);PKM2-WT+UC+布拉氏酵母菌组小鼠肠黏膜中PKM2 的表达量明显高于PKM2-WT+UC 组(P<0.05)。PKM2-KO组、PKM2-KO+UC 组、PKM2-KO+UC+布拉氏酵母菌组小鼠肠黏膜中PKM2 均不表达。

图2 各组小鼠肠黏膜中PKM2 表达的比较Fig.2 Comparison of PKM2 expression in intestinal mucosa among each groups
2.3 各组小鼠肠黏膜HE 染色及组织病理评分的比较PKM2-WT+UC 组小鼠肠黏膜的组织病理评分明显高于PKM2-WT 组(P<0.05);PKM2-WT+UC+布拉氏酵母菌组小鼠肠黏膜的组织病理评分明显低于PKM2-WT+UC 组(P<0.05);PKM2-KO+UC+布拉氏酵母菌组小鼠肠黏膜的组织病理评分明显高于PKM2-WT+UC+布拉氏酵母菌组(P<0.05);PKM2-KO+UC 组小鼠肠黏膜的组织病理评分明显高于PKM2-WT+UC 组(P<0.05);PKM2-KO 组小鼠肠黏膜的组织病理评分与KM2-WT 组比较差异无统计学意义(P>0.05)。
2.4 各组小鼠血清中DAO、D-LA 含量的比较PKM2-WT+UC 组小鼠血清中DAO、D-LA 的含量明显高于PKM2-WT 组(P<0.05);PKM2-WT+UC+布拉氏酵母菌组小鼠血清中DAO、D-LA 的含量明显低于PKM2-WT+UC 组(P<0.05);PKM2-KO+UC+布拉氏酵母菌组小鼠血清中DAO、D-LA的含量明显高于PKM2-WT+UC+布拉氏酵母菌组(P<0.05);PKM2-KO+UC 组小鼠血清中DAO、D-LA 的含量明显高于PKM2-WT+UC 组(P<0.05);PKM2-KO 组小鼠血清中DAO、D-LA 含量与PKM2-WT组比较差异无统计学意义(P>0.05)。
2.5 各组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 表达量的比较PKM2-WT+UC 组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 的表达量明显低于PKM2-WT 组(P<0.05);PKM2-WT+UC+布拉氏酵母菌组小鼠肠黏膜中ZO-1、Occludin、Claudin-1的表达量明显高于PKM2-WT+UC 组(P<0.05);PKM2-KO+UC+布拉氏酵母菌组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 的表达量明显低于PKM2-WT+UC+布拉氏酵母菌组(P<0.05);PKM2-KO+UC 组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 的表达量明显低于PKM2-WT+UC 组(P<0.05);PKM2-KO 组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 的表达量与PKM2-WT 组比较差异无统计学意义(P>0.05)。

图3 各组小鼠肠黏膜的HE 染色(×100)Fig.3 HE staining of intestinal mucosa of each groups(×100)
表1 各组小鼠肠黏膜组织病理评分的比较Tab.1 comparison of histopathological score of intestinal mucosa among each groups ±s

表1 各组小鼠肠黏膜组织病理评分的比较Tab.1 comparison of histopathological score of intestinal mucosa among each groups ±s
注:与PKM2-WT 组比较,*P<0.05;与PKM2-WT+UC 组比较,#P<0.05;与PKM2-WT+UC+布拉氏酵母菌组比较,&P<0.05
组别PKM2-WT 组PKM2-WT+UC 组PKM2-WT+UC+布拉氏酵母菌组PKM2-KO 组PKM2-KO+UC 组PKM2-KO+UC+布拉氏酵母菌组例数10 10 10 10 10 10组织病理评分0 6.12±0.93*2.51±0.62#0.84±0.14 8.64±1.32#5.12±0.98&
表2 各组小鼠血清中二胺氧化酶、D-乳酸含量的比较Tab.2 Comparison of serum diamine oxidase,D-lactate contents among each groups ±s
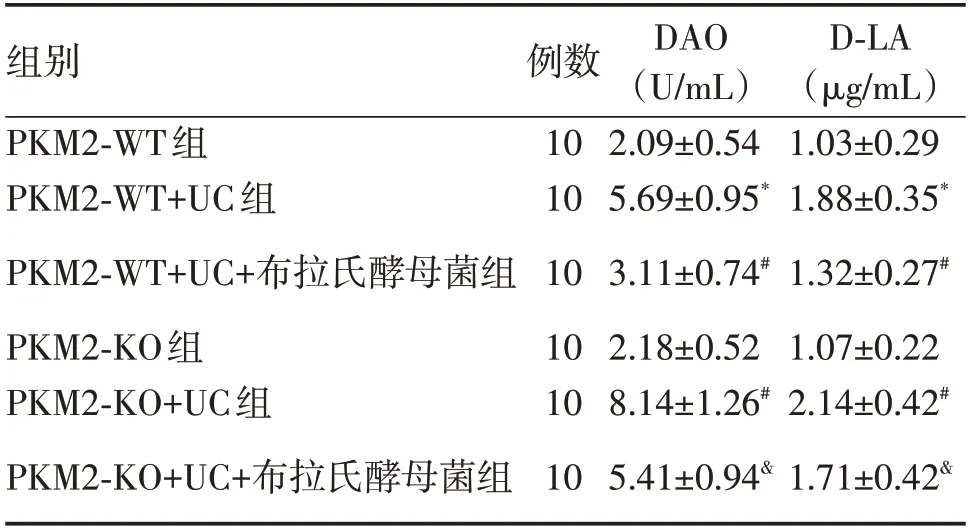
表2 各组小鼠血清中二胺氧化酶、D-乳酸含量的比较Tab.2 Comparison of serum diamine oxidase,D-lactate contents among each groups ±s
注:与PKM2-WT 组比较,*P<0.05;与PKM2-WT+UC 组比较,#P<0.05;与PKM2-WT+UC+布拉氏酵母菌组比较,&P<0.05
组别PKM2-WT组PKM2-WT+UC组PKM2-WT+UC+布拉氏酵母菌组PKM2-KO组PKM2-KO+UC组PKM2-KO+UC+布拉氏酵母菌组例数10 10 10 10 10 10 DAO(U/mL)2.09±0.54 5.69±0.95*3.11±0.74#2.18±0.52 8.14±1.26#5.41±0.94&D-LA(μg/mL)1.03±0.29 1.88±0.35*1.32±0.27#1.07±0.22 2.14±0.42#1.71±0.42&

图4 各组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 的蛋白条带Fig.4 Protein bands of ZO-1,Occludin,Claudin-1 in intestinal mucosa of each groups
表3 各组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 表达量的比较Tab.3 Comparison of ZO-1,Occludin,Claudin-1 expression in intestinal mucosa among each groups ±s

表3 各组小鼠肠黏膜中ZO-1、Occludin、Claudin-1 表达量的比较Tab.3 Comparison of ZO-1,Occludin,Claudin-1 expression in intestinal mucosa among each groups ±s
组别PKM2-WT 组PKM2-WT+UC 组PKM2-WT+UC+布拉氏酵母菌组PKM2-KO 组PKM2-KO+UC 组PKM2-KO+UC+布拉氏酵母菌组例数10 10 10 10 10 10 ZO-1 0.93±0.15 0.52±0.09*0.91±0.18#0.95±0.14 0.33±0.08*0.58±0.09&Occludin 0.83±0.15 0.38±0.09*0.78±0.12*0.81±0.16 0.21±0.06*0.39±0.08&Claudin-1 0.89±0.13 0.40±0.08*0.80±0.14*0.87±0.15 0.25±0.06*0.71±0.13&
2.6 各组小鼠肠黏膜中TNF-α、IL-1β 含量的比较PKM2-WT+UC 组小鼠肠黏膜中TNF-α、IL-1β的含量明显高于PKM2-WT 组(P<0.05);PKM2-WT+UC+布拉氏酵母菌组小鼠肠黏膜中TNF-α、IL-1β 的含量明 显低于PKM2-WT+UC 组(P<0.05);PKM2-KO+UC+布拉氏酵母菌组小鼠肠黏膜中TNF-α、IL-1β 的含量明显高于PKM2-WT+UC+布拉氏酵母菌组(P<0.05);PKM2-KO+UC 组小鼠肠黏膜中TNF-α、IL-1β 的含量明显高于PKM2-WT+UC 组(P<0.05);PKM2-KO 组小鼠肠黏膜中TNF-α、IL-1β 的含量与PKM2-WT 组比较差异无统计学意义(P>0.05)。
表4 各组小鼠肠黏膜中TNF-α、IL-1β 含量的比较Tab.4 Comparison of TNF-α、IL-1β contents in intestinal mucosa among each groups±s

表4 各组小鼠肠黏膜中TNF-α、IL-1β 含量的比较Tab.4 Comparison of TNF-α、IL-1β contents in intestinal mucosa among each groups±s
注:与PKM2-WT 组比较,*P<0.05;与PKM2-WT+UC 组比较,#P<0.05;与PKM2-WT+UC+布拉氏酵母菌组比较,&P<0.05
组别PKM2-WT 组PKM2-WT+UC 组PKM2-WT+UC+布拉氏酵母菌组PKM2-KO 组PKM2-KO+UC 组PKM2-KO+UC+布拉氏酵母菌组例数10 10 10 10 10 10 TNF-α(ng/mg)1.62±0.41 5.24±0.93*2.56±0.65#1.55±0.34 7.96±1.17#6.01±0.95&IL-1β(ng/mg)0.93±0.22 4.12±0.87*2.04±0.55#1.01±0.25 8.29±1.36#5.94±0.94&
3 讨论
UC 的发病与炎症反应及免疫应答的异常、肠道菌群的紊乱、肠黏膜屏障的损害有关[7-8]。近年来,益生菌在UC 治疗中的价值受到了越来越多关注,其中布拉氏酵母菌是一种具有耐酸耐热性能的益生菌[9-11],已经被证实能够在UC 小鼠的治疗中改善肠黏膜病理改变、减轻肠黏膜炎症反应及肠黏膜屏障损害[3-4]。本实验在DSS 诱导小鼠发生UC 后给予布拉氏酵母菌灌胃干预,观察到的结果与阙雪梅等[3]的研究一致,即布拉氏酵母菌干预后UC 小鼠的DAI 评分、肠黏膜组织病理评分均降低,说明布拉氏酵母菌能够在UC 中发挥治疗作用。因此,本实验也将在此基础上进一步研究布拉氏酵母菌发挥治疗作用的分子机制,这也是本实验的创新性所在。
PKM2 是PK 的亚型之一,既能作为催化酶参与糖酵解过程,也能够作为转录辅助因子参与下游基因表达的调控过程并改变细胞的增殖、凋亡、有丝分裂等。在食管癌、前列腺癌、宫颈癌等恶性肿瘤中,PKM2 表达增多,具有促增殖、抗凋亡、促侵袭作用,与肿瘤的病理特征密切相关[12-14];而在UC 患者肠黏膜中,PKM2 的表达明显减少,由其介导的促增殖、抗凋亡作用减弱并引起肠黏膜上皮细胞过度凋亡。本实验对肠黏膜中PKM2 表达的分析发现:UC 小鼠肠黏膜中PKM2 的表达减少,而布拉氏酵母菌干预后肠黏膜中PKM2 的表达增加,说明PKM2 表达减少与UC 的发病有关且布拉氏酵母菌能够增加PKM2 的表达,进而也提示增加PKM2 的表达可能是布拉氏酵母菌发挥UC 治疗作用的分子机制。
为了验证PKM2 在UC 发病及布拉氏酵母菌治疗UC 中的作用,本实验通过LoxP-Cre 系统将肠黏膜中的PKM2 基因进行特异性敲除,仅敲除PKM2基因的小鼠并未出现肠黏膜病理改变;而在敲除PKM2 基因后,使用DSS 诱导UC 过程中DAI 增加、肠黏膜病理损害加重,与Sun X 的动物实验结果吻合,进一步验证了PKM2 基因表达减少与UC 的发病密切相关。在PKM2 基因小鼠中建立UC 模型后,给予布拉氏酵母菌干预同样能够使DAI 评分、肠黏膜组织病理评分降低,但降低的效果与布拉氏酵母菌用于野生型小鼠明显减弱,即PKM2-KO+UC+布拉氏酵母菌组小鼠肠黏膜的DAI 评分、组织病理评分明显高于PKM2-WT+UC+布拉氏酵母菌组。由此说明敲除PKM2 给予能够削弱布拉氏酵母菌改善UC 病情及肠黏膜病理改变的作用,进而提示布拉氏酵母菌通过PKM2发挥治疗UC 的作用。
肠黏膜屏障损害、炎症反应激活是UC 疾病的病理特征,在病理特征进展的过程中,多种相关分子的含量及表达会发生相应变化。DAO 是特异性表达于肠黏膜上皮细胞的代谢酶、D-LA 是肠道内细菌发酵代谢的产物,在肠黏膜屏障损伤时大量释放进入血液循环[15];ZO-1、Occludin、Claudin-1 是肠黏膜上皮表达的紧密连接蛋白,其表达减少会造成肠黏膜屏障功能损害[16-18];TNF-α 及IL-1β 是重要的促炎细胞因子,在肠道菌群发生紊乱、炎症细胞在肠黏膜内大量浸润的过程中不断分泌,进而加重肠黏膜的病理改变[19-22]。上述分子在UC 中的变化已经被多项研究证实,本实验中UC 小鼠的上述指标也发生了相应变化;在布拉氏酵母菌干预后,DAO、D-LA、TNF-α及IL-1β的含量减少,ZO-1、Occludin、Claudin-1 的表达增加,由此验证了布拉氏酵母菌治疗UC 的作用。在UC 小鼠中,敲除PKM2 基因后上述指标的变化加剧,DAO、D-LA、TNF-α 及IL-1β 的含量进一步增加,ZO-1、Occludin、Claudin-1 的表达进一步减少,说明PKM2 在UC 中参与了肠黏膜炎症反应及黏膜屏障的调控。而在敲除PKM2 基因的UC 小鼠中,布拉氏酵母菌调节上述分子的作用发生了逆转,即PKM2-KO+UC+布拉氏酵母菌组小鼠DAO、D-LA、TNF-α及IL-1β 的含量均高于PKM2-WT+UC+布拉氏酵母菌组,而ZO-1、Occludin、Claudin-1 的表达均低于PKM2-WT+UC+布拉氏酵母菌组。由此说明布拉氏酵母菌改善肠黏膜屏障功能、抑制肠黏膜内炎症反应的作用与增加PKM2 基因表达有关。
综上所述,布拉氏酵母菌治疗DSS 诱导UC 小鼠能够改善肠黏膜病理改变、减轻炎症反应及黏膜屏障损伤,同时布拉氏酵母菌能够增加UC 小鼠肠黏膜中PKM2 的表达;敲除PKM2 基因后,布拉氏酵母菌的治疗作用减弱或消失,进而表明布拉氏酵母菌治疗UC 的作用与增加PKM2 的表达有关。本研究发现了布拉氏酵母菌通过PKM2 基因发挥UC 治疗价值,这是本研究的创新性所在,但PKM2 基因在UC 发生发展中的具体作用仍有待进一步研究,今后可在PKM2 基因敲除小鼠中研究PKM2 调节肠黏膜炎症反应及肠黏膜屏障的机制。
