纳米羟基磷灰石通过溶酶体-线粒体通路诱导肾小管上皮细胞的凋亡机制
2020-07-18董文敬张海松徐玉晓崔静陈玉杰王倩葛坤高燕董文英
董文敬 张海松 徐玉晓 崔静 陈玉杰 王倩 葛坤 高燕 董文英
1河北大学附属医院(河北保定071000);2保定市第一中心医院(河北保定071000);3河北大学(河北保定071000);4吉林大学(吉林吉林132000)
羟基磷灰石(HAP)是骨骼和牙齿中最重要的无机矿物成分,但并非所有的HAP 都对人体有益。在泌尿系统,由HAP 诱导形成的Randall 斑块是促进肾结石形成的重要原因[1]。在Randall 斑块中存在从大小由纳米到微米及不同形态的HAP[2]。草酸钙结石是一种最常见的肾结石,其形成机制尚未完全阐明[3]。HAP 参与草酸钙结石的形成,以及是如何促进肾结石的形成的机制研究尚未明确。
草酸钙在肾乳头Randall 斑块上的过度生长是草酸钙结石形成的潜在机制[4]。EVAN 等[5]通过肾脏活检发现,Randall 斑起源于髓袢基底膜,随后扩散到了肾直小管,最后到尿路上皮表面,促进草酸盐晶体的成核、生长和聚集,从而增加了肾结石形成的风险。在含钙结石或尿液中发现了许多磷酸钙盐成分,最常见的磷酸钙盐是HAP[6]。因此,HAP 与肾结石之间存在密切的关系,肾小管上皮细胞的氧化炎症损伤与结石的形成密切相关[7]。YU 等[8]通过将HK-2 细胞与不同浓度的HAP 和/或巨噬细胞共同培养,HAP 增加上调了HK-2 细胞中骨桥蛋白(OPN)的表达水平,并引起异质的成核、粘附和晶体沉积,从而促进了Randall 斑块和肾结石的形成。RAO 等[9]通过研究四种不同类型的HAP(球状、针状、棒状、盘状),结果表明HAP 的细胞毒性:球状>针状>棒状>盘状,HAP 的物理性质对其细胞毒性起着至关重要的作用,同时发现HAP 可能激活细胞氧化应激反应,引发一系列细胞功能障碍、凋亡和坏死。本实验设计不同浓度的HAP 探究其通过氧化应激反应对HK-2 细胞的凋亡的影响及其机制,为泌尿系结石的机制研究作一定探讨。
1 材料与方法
1.1 主要试剂人源近端肾小管上皮细胞(HK-2细胞武汉普诺生命科技有限公司中国)、HAP(水热法合成、分散性好、棒状、60~100 nm×12 nm)、MEM 培养基和胎牛血清(Gibco 公司 美国)、胰蛋白酶(Sigma 公司 美国)、Annexin V-FITC/PI 细胞凋亡和坏死双染料试剂盒、活细胞/死细胞染色试剂盒和DCFH-DA(上海贝博生物有限公司中国)、青霉素和链霉素、线粒体膜电位检测试剂盒(JC-1)、吖啶橙(AO)染料(碧云天生物技术公司中国)、四甲基偶氮唑蓝(hiazoyl blue tetrazolium dromide,MTT)(Amresco 公司美国)、Lyso-Tracker Red 和Mito-Tracker Green、过氧化氢(H2O2)试剂盒(赛默飞世尔科技有限公司 中国)、Caspase-3 活性试剂盒(南京建成生物工程研究所中国)。
1.2 实验方法
1.2.1 HAP 的合成和表征根据文献,利用水热法合成了HAP[10]。将样品分散到无水乙醇中、超声均匀分散,滴于铜网,干燥,用透射电子显微镜(TEM)进行观察。将样品分散到无水乙醇中、超声均匀分散,滴于硅片,干燥,用扫描电子显微镜(SEM)进行观察。取适量的样品,用X-射线衍粉末射仪(XRD)对其结构进行测定。取适量的样品,用固态荧光测量仪对样品的荧光性质进行。
1.2.2 细胞培养将HK-2 细胞接种到含有10%FBS,100 μg/mL 青霉素和100 μg/mL 链霉素的MEM培养基上在37 ℃、5%CO2培养箱中培养,胰蛋白酶消化用于细胞繁殖,细胞同步后,实验模型分组:(1)对照组:仅添加等体积PBS 溶液(0 μg/mL);(2)HAP 处理组:将HK-2 细胞暴露于5、10、20、40、80 μg/mL 的HAP。
含HAP 的PBS 悬液的制备:将一定量的HAP粉末铺板,用紫外线灭菌,过夜,然后分散在PBS溶液中,制备浓度为4 mg/mL 的悬浮液,并超声处理5 min。
1.2.3 HK-2 细胞存活率和活细胞/死细胞染色检测通过用MTT 的方法测定HK-2 细胞存活率[11]。将HK-2 细胞(2×104)接种到96 孔板上,按照上述分组分别孵育24、48、72 h,分别加入10 μL MTT,在37 ℃的条件下孵育4 h,弃去上清并加入100 μL DMSO,摇床震荡10 min,使用酶标仪测定570 nm 的吸光度(OD)值。细胞活性=OD实验组/OD对照组×100%。
将HK-2 细胞(1×105)接种到6 孔板上,实验模型孵育24h,严格按照活死染试剂盒说明书操作,通过荧光显微镜观察,绿色为活细胞,红色为死细胞。
1.2.4 HK-2 细胞凋亡测定Annexin V-FITC/PI 细胞凋亡和坏死双染料检测细胞凋亡[12]。将HK-2细胞(1×105)接种到6 孔板上,实验模型分为两组:(1)对照组:仅添加PBS 溶液(0 μg/mL);(2)HAP处理组:将HK-2 细胞暴露于10、20、40 μg/mL 的HAP,孵育6、24 h,严格按照试剂盒的说明书步骤操作,通过流式细胞仪检测细胞凋亡情况。
1.2.5 HAP 在HK-2 细胞内分布分别用Lyso-Tracker Red 或Mito-Tracker Green 追踪HAP 在HK-2细胞中的细胞内分布[13]。将HK-2 细胞(2×104)接种到培养皿上,用HAP(40 μg/mL)处理HK-2 细胞6 h。用Lyso-Tracker Red 和Mito-Tracker Green分别给溶酶体和线粒体染色,用共聚焦显微镜观察HAP 在细胞中的分布。
1.2.6 ROS 的检测用DCFH-DA 检测到细胞内ROS 水平[14]。孵育6 h,将细胞用200 μL DCFHDA 染色,在37 ℃暗处孵育20 min,PBS 洗涤3 次后,PBS 重悬,通过流式细胞仪检测氧化DCFH-DA的荧光。
严格按H2O2试剂盒说明书步骤操作,使用酶标仪在415 nm 下测量吸光度。实验模型分组:(1)对照组:仅添加等体积PBS 溶液(0 μg/mL);(2)HAP 处理组:将HK-2 细胞暴露于5、10、20、40 μg/mL 的HAP。用5 mmol/L N-乙酰半胱氨酸(NAC)预处理1 h,使用酶标仪在570 nm 下测量吸光度。细胞活性=OD实验组/OD对照组×100%。
1.2.7 溶酶体完整性检测吖啶橙(AO)检测溶酶体完整性,孵育6 h,用PBS 制备的5 μg/mL 吖啶橙染料(AO)溶液染色15 min,通过流式细胞仪检测通透性。
用Lyso-Tracker Red 检测溶酶体通透性的改变。加入Lyso-Tracker Red 和Hochest,分别孵育30 min和15 min。用荧光显微镜观察溶酶体的碱化。
1.2.8 线粒体膜电位(ΔΨm)和Caspase-3 检测将HK-2 细胞(每孔1×105个细胞)接种在6 孔板中,同2.2.4 实验模型分组,孵育6 h,收集细胞并以1 000 rpm/min 离心5 min,吸出上清液,用PBS洗涤,再次离心获得细胞沉淀,加入500 μL JC-1,在黑暗中于37 ℃孵育20 min,PBS 洗涤三次除去未反应的JC-1,并通过流式细胞仪检测分析细胞的线粒体膜电位的变化。
将HK-2 细胞(每孔1×105个细胞)接种在6 孔板中,孵育6 h,严格按照说明书裂解细胞,取少量细胞样品用BCA 蛋白浓度定量试剂盒定量蛋白浓度以保证每组的蛋白浓度在100~200 μg。Caspase-3 活性测定严格按说明书操作。用酶标仪测定波长为405 nm 的吸光度(OD)。Caspase-3 活化程度=OD样品组/OD对照组×100%。
1.3 统计学方法所有结果至少作三个独立平行实验。数据表示为均数±标准差。单因素方差分析用于多重比较,两组间比较用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HAP 表征通过TEM 和SEM 对HAP 的形貌和大小进行测定。HAP 为分散性良好的棒状,长度×高度:(60~100)nm×12 nm(图1a、b)。利用XRD 对HAP 的结构进行测定,通过与标准衍射图(JCPDS No.09-0432 标准衍射图)对比,HAP 与标准衍射图一致,表明合成了纯的HAP(图1c)。利用固态荧光测量仪检测HAP 发蓝光(图1d)。

图1 HAP 表征结果Fig.1 HAP characterization results
2.2 HAP 对的HK-2 细胞存活率影响MTT 法观察不同剂量HAP 处理24、48 和72 h 对HK-2 细胞生存率的影响,见图2a。0、5、10、20、40和80 μg/mL的HAP 处理的HK-2 细胞在24、48 和72 h 对HK-2细胞增殖均有明显的抑制作用,并呈明显的剂量依赖性。在24 h,HAP 在5、10 μg/mL 细胞存活率无明显差异,约降低17%~19%,80 μg/mL 细胞存活率约降低60%。本结果显示,HAP 抑制HK-2 细胞增殖,降低细胞生存率且引起细胞产生细胞毒性且呈浓度-时间依赖性。
活细胞/死细胞染色结果表明HK-2 细胞增殖能力随浓度的增加而降低(图2b)HAP 在20 μg/mL后释放红色荧光的死细胞逐渐增多,释放绿色荧光的活细胞逐渐减少。HAP 在5、10 μg/mL 活/死细胞未观察到明显差异,80 μg/mL 时仅观察到了少量的活细胞。活/死细胞染色结果与MTT 结果基本一致。
2.3 HAP 引起的HK-2 细胞调亡由于80 μg/mL的HAP 明显的抑制HK-2 细胞的增殖并导致坏死脱落。结合细胞活性和活死染结果,选择0、10、20、40 μg/mL 的HAP 分别作用于HK-2 细胞共孵育6、24 h,凋亡结果表明6 h 细胞的存活率没有明显差异(图2c),24 h 凋亡结果表明细胞的凋亡和坏死率随着浓度的增加而升高(图2c、d)。

图2 HK-2 细胞凋亡结果Fig.2 Results HK-2 cell apoptosis
2.4 HAP 在HK-2 细胞中的分布见图3,HAP的蓝色荧光主要与Lyso-Tracker 标记的溶酶体的红色荧光重叠,与Mito-Tracker 标记的绿色荧光仅有部分局限,结果表明HAP 主要分布在溶酶体。
2.5 HAP 诱导HK-2 细胞ROS 的释放DCFHDA 荧光探针检测了HAP 诱导的HK-2 细胞中ROS的变化。荧光强度的定量结果表明,HK-2 细胞中的ROS 水平随浓度增加增加(图4a)。HK-2 细胞中的H2O2水平随浓度增加增加(图4b)。正常组的细胞具有暗荧光,表明细胞内ROS 水平低。HAP治疗组的绿色荧光均显着增强(图4d),表明HAP导致细胞内ROS 水平升高。乙酰半胱氨酸(NAC)是一种抗氧化剂,加入NAC,HAP 诱导的细胞活性较未加入NAC 的细胞生存率升高(图4c),表明细胞的生存率与ROS 释放有关,HAP 在5、10 μg/mL细胞存活率无明显差异。

图3 在暴露于40 μg/mL 的HAP 中6 h 后,HK-2 细胞中HAP 的分布(标尺:10 μm)Fig.3 HAP distribution in HK-2 cells after 6 hours of exposure to HAP at 40 μg/mL(Scale:10 μm)

图4 HK-2 细胞ROS 的释放Fig.4 ROS release from HK-2 cells
2.6 HAP 对HK-2 细胞溶酶体膜完整性的影响见图5a。HAP 可使HK-2 细胞溶酶体通透性增加,溶酶体内的大量的水解酶释放,溶酶体膜受损。Lyso-Tracker Red 是一种碱性染料,溶酶体红在溶酶体内的荧光强弱可间接反应溶酶体的完整性,见图5d。HAP 可使HK-2 细胞溶酶体完整性受损。结果表明HAP 可使HK-2 细胞溶酶体完整性受损,且呈浓度依赖性。
2.7 HAP 对HK-2 细胞线粒体功能的影响见图5b,所示随HAP 浓度的增加ΔΨm 降低。HAP引起的细胞内ROS 水平升高可能导致ΔΨm降低。
2.8 caspase-3 的释放caspase-3 是细胞凋亡的过程中的一种关键酶。见图5c,所示随HAP 浓度的增加caspase-3 增加。由HAP 引起的细胞ΔΨm 降低可能导致caspase-3 激活。
3 讨论
肾结石是一种日益增长的泌尿系统疾病,约占世界人口的5%~13%[15]。目前治疗肾结石的主要方法是外科手术[16],但患者的复发率高,5年复发率约为50%[17]。因此,了解肾结石的发病机制对结石的治疗和预防复发具有重要意义。目前国内外主要集中在草酸钙在肾结石形成机制的探究[18],而关于HAP 作为促进肾结石形成的机制的研究较少。
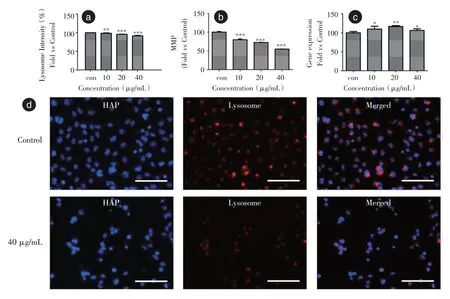
图5 HAP 对HK-2 细胞线粒体功能和细胞溶酶体膜完整性的影响Fig.5 Effect of HAP on mitochondrial function and lysosomal membrane integrity of HK-2 cells
近年来国内外出现了关于HAP 对肾上皮细胞损伤的报道,余骏川等[19]研究了HAP 对HK-2 细胞的损伤作用,发现细胞存活率与HAP 的浓度呈负相关且通过上调细胞内的OPN 表达参与肾结石的形成。COHENA 等[20]将草酸,草酸钙和HAP与犬肾细胞(MDCK)共培养,结果表明它们都引起MDCK 细胞中基质Gla 蛋白(MGP)表达增加,超氧化物歧化酶释放,乳酸脱氢酶释放,并促进细胞凋亡率,从而促进肾结石的形成。研究表明HAP 对肾上皮细胞造成损伤,但并未对其造成损伤的机制进一步研究。有研究表明当300 μg/mL的HAP 会对HK-2 细胞造成不可逆的损伤,造成大量细胞凋亡[21],所以设计的最大浓度不高于200 μg/mL,本研究通过MTT 和活细胞/死细胞染色实验,发现HAP 可以降低HK-2 细胞的存活率,抑制细胞增殖,表明对HK-2 细胞具有一定的损伤作用。
研究表明细胞内的氧化应激反应能引起细胞氧化炎症损伤,过量的ROS 会引起氧化应激,导致正常的肾上皮细胞功能障碍、细胞凋亡甚至死亡[22]。目前主要凋亡途径包括线粒体和溶酶体途径[23],ROS 是ΔΨm 降低的直接原因[24]。当细胞受损时,造成大量ROS 释放可引起线粒体功能障碍,包括ΔΨm 下降、bcl-2 的降低以及bcl-2 相关bax 蛋白的释放,同时线粒体通过释放细胞色素c进一步活化Caspase-9,Caspase-9 又可激活下游的Caspase-3,导致细胞凋亡[25]。本研究通过流式细胞仪检测HAP 可导致ΔΨm 明显降低、Caspase-3 水平增加,与ROS 的上升趋势一致。
溶酶体膜的完整性是细胞凋亡过程中的关键因素[26],组织蛋白酶B 是一种存在于溶酶体内的凋亡介质[27],当溶酶体膜完整性受损可导致组织蛋白酶B 释放,从而导致细胞调亡。本研究通过共聚焦显微镜观察HAP 主要分布在溶酶体内,溶酶体膜的通透性增加,组织蛋白酶B 释放,导致细胞凋亡。
综上,本研究对不同浓度的HAP 通过溶酶体-线粒体途径诱导HK-2 细胞凋亡。其机制:(1)HK-2 细胞内的ROS 释放增加导致线粒体膜电位降低,激活caspase-3 导致HK-2 细胞凋亡;(2)HAP主要定位于HK-2 细胞的溶酶体中导致溶酶体膜的通透性增加,凋亡因子释放(组织蛋白酶B)引起细胞凋亡;(3)值得注意的是HAP 作用于HK-2细胞6 h 时没有引起细胞凋亡,但有大量ROS 产生、线粒体膜电位降低、caspase-3 水平升高等改变。表明凋亡的因素的出现早于细胞的凋亡。本研究表明HAP 能明显的抑制HK-2 细胞增殖,并通过溶酶体-线粒体通径介导细胞的凋亡和坏死,从增加了结石形成的风险。
