掺混倍数对地表水掺混海淡水水质稳定、缓冲能力的影响
2020-07-17曹伟新
曹伟新
(上海市政工程设计研究总院〈集团〉有限公司,上海 200092)
1 研究背景
市政公共输配水管网在长期输送相同水质的地表水时往往形成管垢或腐蚀,这些管垢或腐蚀面与水力水质稳定的输送水之间形成稳定的反应平衡,管垢或腐蚀面保持相对稳定的形貌和理化性质[1-2]。海水淡化水是软水,硬度、碱度、pH均较低,基本不具有缓冲能力,有“溶解”市政公共输配水管道内壁垢层的倾向,造成水质污染[3-5]。因此,海水淡化水进入市政公共输配水管网的水质稳定技术是海水淡化水应用于公共供水的关键技术之一。目前,国内有关海水淡化水水质稳定的技术主要采用:(1)通过加药或矿化滤池来调节淡化水水质[6-9];(2)通过地表水掺混淡化水来提高水质稳定性[6,7,10-11]。地表水掺混淡化水在我国已有工程实例[7,10],掺混倍数主要根据小试试验和部分生产运行经验确定,本研究结合碳酸根体系模型、碳酸钙溶度积模型、不同水质水体混合模型及各水质指标模型,计算研究海水淡化水与地表水掺混的水质稳定性,以期对运营生产活动提供有益的借鉴。
2 碳酸根系统
(1)
(2)
(3)
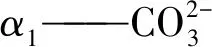

α3——H2CO3相对于溶解性无机碳的摩尔占比;
cH——质子的摩尔浓度,mol/L;
K1——H2CO3的质子电离平衡常数,mol/L;

K1、K2的负对数pK1、pK2是盐度和温度的函数,可按式(4)、式(5)计算[13]。
(4)

(5)
其中:S——盐度,质量千分比;
T——温度,K。
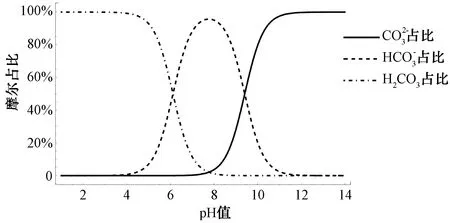
图1 pH对各碳酸根单体摩尔占比的影响Fig.1 Effect of pH Value on Molar Ratio of Each Carbonate Monomer
由上述分析可知,一定pH、盐度条件下,溶解性无机碳摩尔浓度和各碳酸根单体摩尔占比的确定能够测算各碳酸根单体的摩尔浓度,从而确定水体中的碳酸根体系。当水体中的其他物质含量较低时,如地表水给水厂清水池中的净化水、海水淡化水等,溶解性无机碳摩尔浓度往往与常规水质检测指标中的碱度和pH有关。碱度是表示水吸收质子能力的指标,通常用水中可与强酸定量作用的物质总量来标定。天然水体中的碱度主要是由重碳酸根、碳酸根和氢氧化物引起,其中,重碳酸根是水中碱度的主要形式。对于地表水给水厂清水池中的净化水、海水淡化水等,碱度亦主要来自重碳酸根、碳酸根和氢氧化物,根据碱度与碳酸根体系各单体摩尔浓度的关系,溶解性无机碳的摩尔浓度Ct(mmol/L)可按式(6)计算[12]。
(6)
其中:Alk——碱度,mmol当量粒子/L(当量粒子以1/2 CaCO3计);
Kw——水的离子积,mol2/L2,25 ℃时为1.008×10-14mol2/L2;
cOH——OH-的摩尔浓度,mol/L,可由Kw/cH求得。
(7)
(8)
CH2CO3=Ct×α3
(9)
3 水质稳定性指标
水体中的碳酸根体系对水质稳定性有重要影响,主要表现在两个方面,一是CaCO3的溶解和沉淀(腐蚀和结垢),二是水体的缓冲性能。判断水的结垢和腐蚀性有多种指数,常见指数有极限钙盐硬度、朗格利尔指数(Langelier saturation index,LSI)、雷玆纳尔稳定指数(Ryznar stability index,RSI)[14]。
极限钙盐硬度是指一定的水质、水温条件下,水溶液与固体CaCO3达到溶解沉淀平衡时Ca2+的浓度,其值按式(10)计算。
(10)

KspCaCO3——CaCO3的溶度积,mmol2/L2。
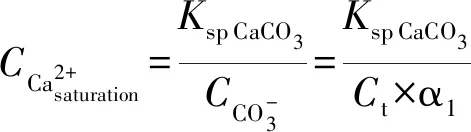
LSI指数指在一定的溶液体系内,可采用相同条件(水温、含盐量、硬度和碱度)下实际pH(pH0)与达到CaCO3饱和溶解度时的pH(pHs)的差值来表示,如式(11)[14]。
LSI=pH0-pHs
(11)

(12)
其中:cHs——质子的摩尔浓度,mol/L,其负对数为pHs;
CCa2+——Ca2+的摩尔浓度,mmol/L。
求解关于cHs的二元方程式(12),即可确定pHs及LSI。当LSI>0时,水中溶解CaCO3量超过饱和量,产生CaCO3沉淀,产生结垢;当LSI<0时,水中溶解CaCO3量低于饱和量,溶解固相CaCO3,产生腐蚀;当LSI=0时,水中溶解CaCO3量等于饱和量,不结垢不腐蚀。RSI是一个半经验性指数,与LSI指数一起判定水质的腐蚀结垢性,准确率更高,如式(13)[14]。
RSI=2×pHs-pH0=pHs-(pH0-pHs)=pHs-LSI
(13)
当RSI<3.7时,水质为严重结垢倾向;当RSI为3.7~6.0时,水质为轻微结垢倾向;当RSI=6.0时,水质基本稳定;当RSI为6.0~7.5时,水质为轻微腐蚀倾向;当RSI大于7.5时,水质为严重腐蚀倾向。
水体的缓冲性能一般可以用缓冲容量μpH和CaCO3饱和度缓冲强度μS表征。缓冲容量μpH如式(14)[15]。对于自然水体中普遍存在的碳酸根体系,Cb为向水体加入碱的量,μpH为加入碱的变化量与所引起的pH变化量的比值,μpH越大表示水体的缓冲容量越大,反之则越小。CaCO3饱和度缓冲强度μS如式(15)[16]。S为水体CaCO3的饱和度,可由式(16)表示。μS为加入碱的变化量与所引起的CaCO3饱和度变化量的比值,μS越小表示水体的CaCO3饱和度缓冲强度越大,反之则越大。
(14)
(15)
(16)
4 海水淡化水与地表水掺混
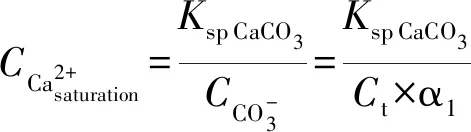
(17)
(18)
(19)
(20)

(21)
其中:S0——掺混水体的盐度,质量千分比;
C0Ca2+——掺混水体Ca2+浓度,mmol/L;
Ct0——掺混水体总溶解性无机碳浓度,mmol/L;
Alk0——掺混水体的碱度,mmol当量粒子/L(当量粒子以1/2 CaCO3计);
S1——海水淡化水的盐度,质量千分比;
C1Ca2+——海水淡化水Ca2+浓度,mmol/L;
Ct1——海水淡化水总溶解性无机碳浓度,mmol/L;
Alk1——海水淡化水的碱度,mmol当量粒子/L(当量粒子以1/2 CaCO3计);
S2——地表水的盐度,质量千分比;
C2Ca2+——地表水Ca2+浓度,mmol/L;
Ct2——地表水总溶解性无机碳浓度,mmol/L;
Alk2——地表水碱度,mmol当量粒子/L(当量粒子以1/2 CaCO3计);
n——地表水掺混淡化水的倍数。
5 结果分析与讨论
5.1 掺混倍数对混合水质的影响
山东某海水淡化厂出厂淡化水、某地表水厂出厂水的硬度、碱度、Ca2+浓度、pH如表1所示。其中,溶解性无机碳根据碱度和H+浓度由式(6)计算所得。不同掺混倍数混合水的溶解性无机碳、碱度、Ca2+浓度和pH由式(17)~式(21)计算所得,如表2所示。

表1 山东某海水淡化厂出厂淡化水、某地表水厂出厂地表水水质Tab.1 Effluent Water Quality of a Seawater Desalination Plant and a Water Treatment Plant in Shandong
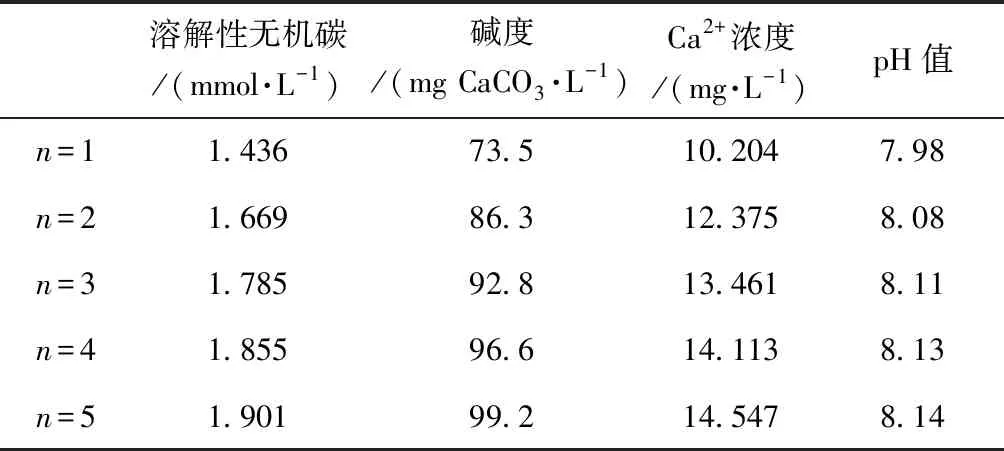
表2 不同掺混倍数混合水的水质Tab.2 Water Quality of Mixed Water with Different Mixing Ratios
5.2 掺混倍数对CaCO3饱和曲线的影响


在水中,氧气是唯一的氧化剂,铁质管道发生阳极腐蚀,Fe2+可能扩散到水中。Fe2+的饱和浓度曲线可由式(22)计算。
(22)
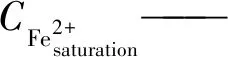
KspFe(OH)2——Fe(OH)2的溶度积,mmol3/L3,25 ℃时为4.8×10-7mol3/L3;
COH-——OH-的浓度,mmol/L。
饱和Fe2+浓度随溶液pH的变化如图2所示。当饱和Fe2+浓度达到0.2 mmol/L时,pH值为8.19。Fe2+更易扩散到水体中。因此,具有CaCO3结垢倾向的水体有利于在铁基管道表面形成结垢层控制腐蚀进度[17-18]。
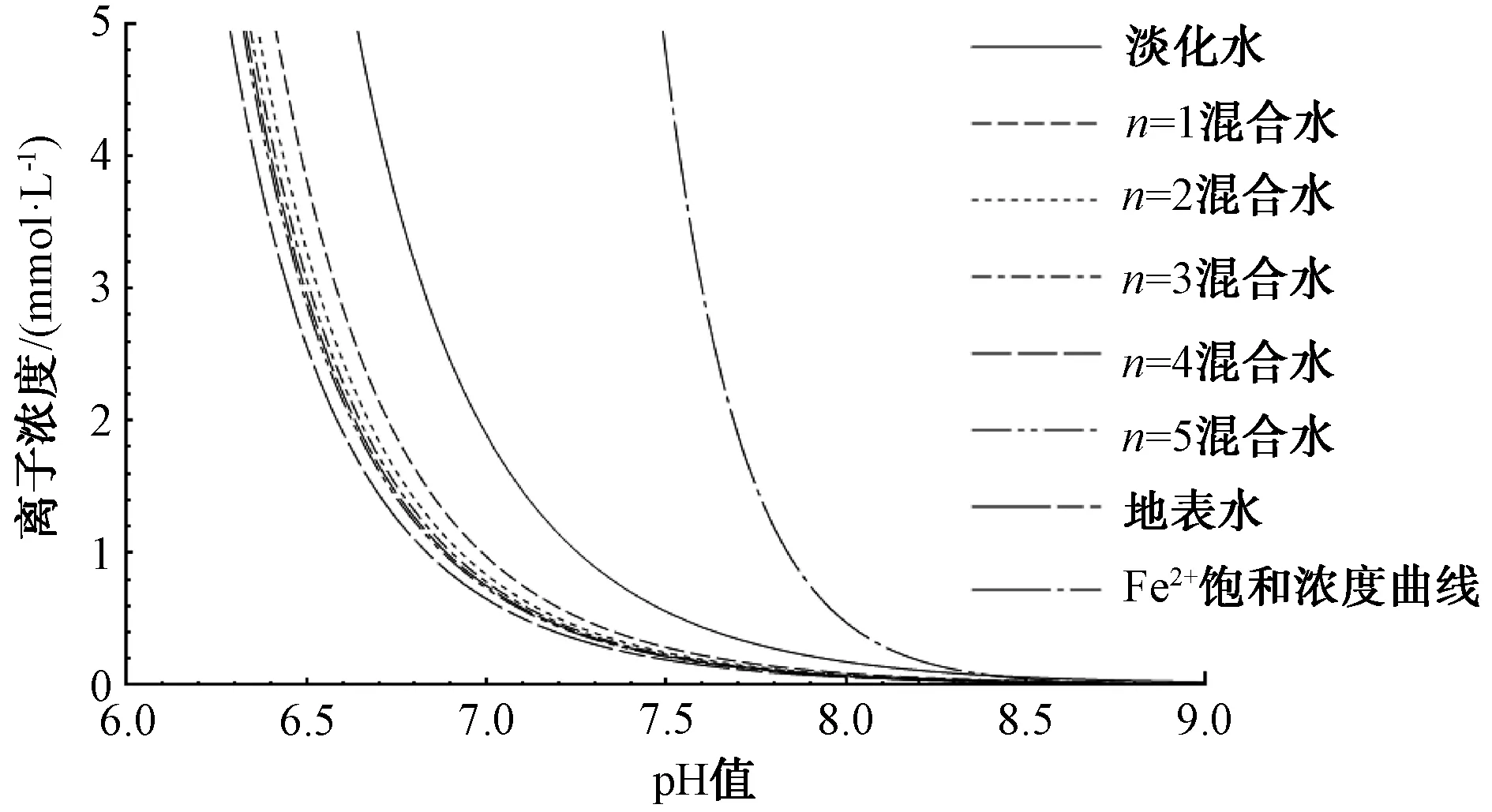
图2 不同掺混倍数条件下饱和离子浓度随水体pH的变化Fig.2 Variation of Saturated Ion Concentration with pH Values under Different Mixing Multiples
5.3 掺混倍数对LSI、RSI指数的影响
水体溶解性无机碳影响水体饱和Ca2+浓度。水体实际Ca2+浓度条件下,水体pH0与饱和浓度曲线上的pHs一般存在一定的差值。因此,理论计算出的饱和Ca2+浓度不能直接表征实际水体的腐蚀或结垢情况。LSI指数[式(11)]用实际水体Ca2+浓度所对应的pH0与达到饱和时所对应的pHs的差值来表征水体的腐蚀或结垢情况,涵盖了实际水体pH0的影响。但是,当水体的pH0趋向于强酸性或强碱性时,LSI指数由于只是“距离”值而不能准确反映腐蚀或结垢情况。由此,RSI指数[式(13)]引入水体实际Ca2+浓度的饱和pHs与LSI的差值来表征水体腐蚀或结垢,“定位”水体的pHs,从而更准确地反映腐蚀或结垢情况。将表2中水体实际Ca2+浓度和pH绘制于图2中,所得图3为不同掺混倍数条件下水体LSI和RSI的变化,纵坐标为Ca2+浓度。由图3可知,淡化水、掺混倍数1倍、2倍、3倍、4倍、5倍混合水及地表水的LSI分别为-1.43、0.04、0.29、0.39、0.44、0.48、0.63。淡化水实际Ca2+浓度和pH位于饱和曲线的左侧,表明水体仍有较大的Ca2+溶解倾向;其他掺混水和地表水实际Ca2+浓度和pH位于饱和曲线的右侧,表明水体已有Ca2+沉淀倾向。淡化水、掺混倍数1倍、2倍、3倍、4倍、5倍混合水及地表水的RSI分别为10.17、7.90、7.51、7.34、7.25、7.19、6.92。参照3节RSI指标判断,淡化水及掺混倍数1倍、2倍的混合水腐蚀严重;掺混倍数3倍、4倍、5倍的混合水及地表水腐蚀轻微。
5.4 掺混倍数对水体缓冲性能的影响
自然水体的CaCO3饱和度缓冲强度是溶解性无机碳、pH及Ca2+浓度的函数[式(15)],表征水体CaCO3饱和度对碱量变化的敏感性。CaCO3饱和度缓冲强度μS随溶解性无机碳、pH、Ca2+浓度变化的等值面如图4所示。 由图4可知,μS随水体pH的增加存在一个极小值,对碱量变化的敏感性最强。μS随水体Ca2+浓度的增加而减小,对碱量变化的敏感性增加。μS随水体溶解性无机碳浓度的增加而变化不明显,这可以归结为水体中溶解性无机碳的浓度较Ca2+浓度高约1个数量级,Ca2+浓度为饱和度的控制因素。根据表2,绘制不同掺混倍数条件下的混合水pH、溶解性无机碳、Ca2+浓度于图4,分析掺混倍数对混合水CaCO3饱和度缓冲强度的影响。淡化水、掺混倍数1倍、2倍、3倍、4倍、5倍混合水及地表水的μS[单位为mmol/(L·pH)]分别为1.076 0、0.066 0、0.049 1、0.044 0、0.041 3、0.039 7、0.033 5,CaCO3饱和度对pH的敏感性随掺混倍数的增加而增加。CaCO3饱和度缓冲强度小,局部(如原电池阴极区发生的腐蚀)出现高碱量时易于形成CaCO3结垢,有利于抑制腐蚀[16]。因此,地表水掺混淡化水可减小CaCO3饱和度缓冲强度,有利于腐蚀控制。
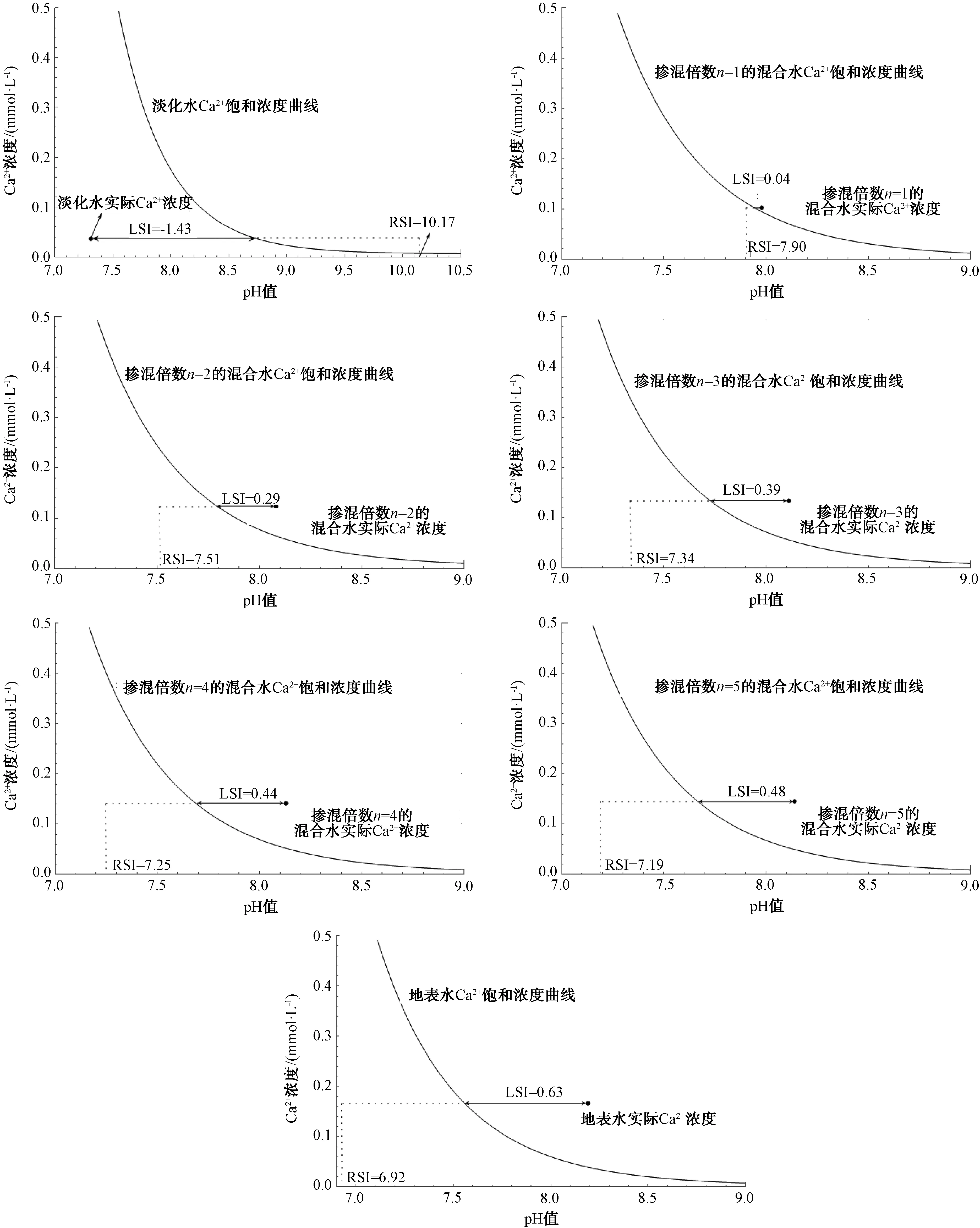
图3 不同掺混倍数条件下水体LSI和RSI的变化Fig.3 Variation of LSI and RSI under Different Mixing Multiples
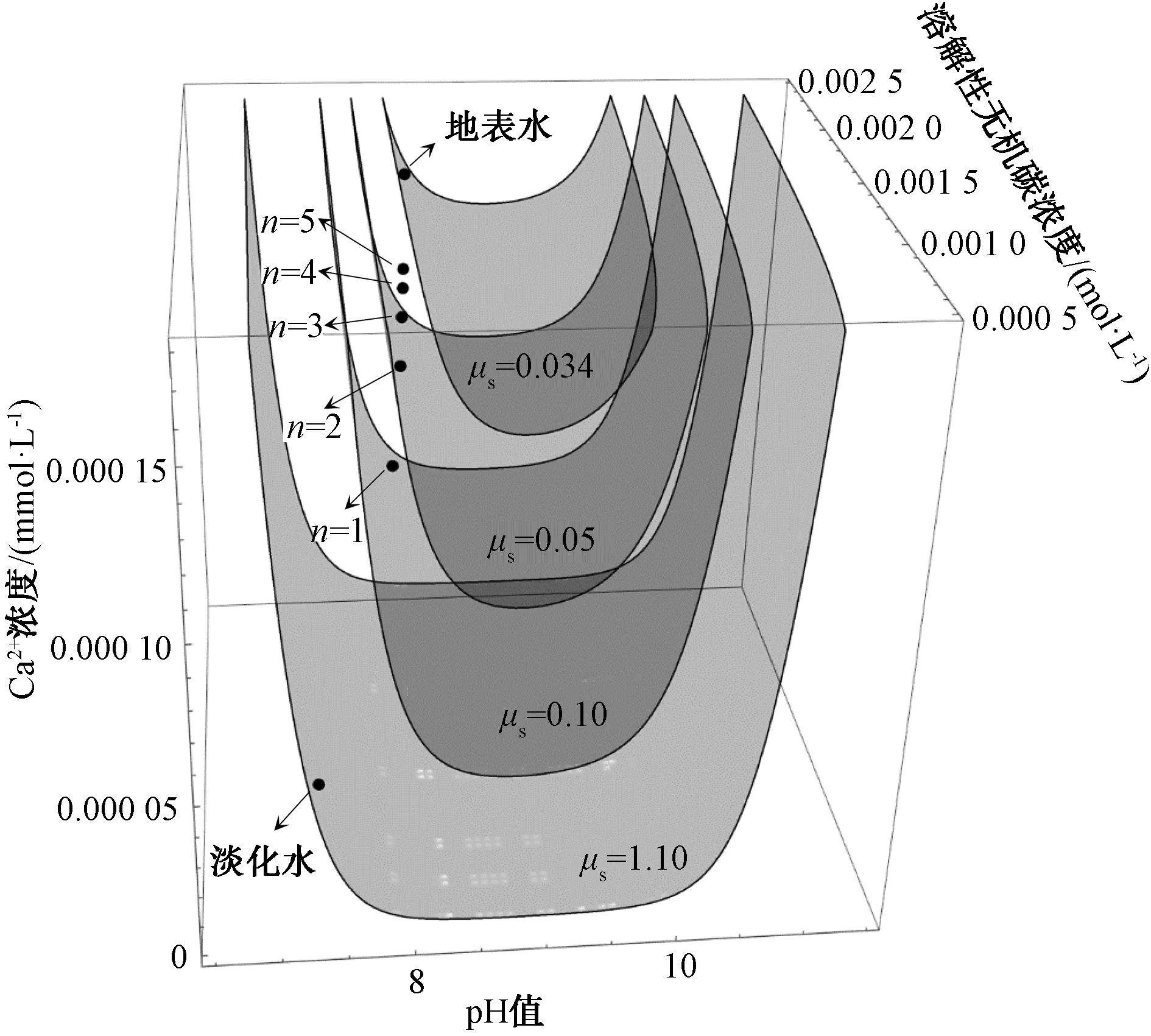
图4 水体CaCO3缓冲强度μS随溶解性无机碳、pH、Ca2+浓度变化的等值面图Fig.4 Contour Map of Cushion Strength μSVariation of CaCO3 with Dissolved Inorganic Carbon, pH Value and Ca2+ Concentration
缓冲容量μpH主要由碳酸酸根体系引起,是溶解性无机碳、pH的函数[式(14)],表征水体均匀稳定pH的能力。缓冲容量μpH随溶解性无机碳、pH变化的等值线如图5所示。由图5可知,缓冲容量μpH随水体pH的增加存在两处极大值和一处极小值。pH值为6.2和9.4时为极大值,分别对应于碳酸根体系的-pK1和-pK2,缓冲能力强;pH值为7.8时为极小值,对应于体系的(-pK1+-pK2)/2,缓冲能力弱。缓冲容量μpH随溶解性无机碳的增加而增大,但在不同水体pH处增加的幅度不同,pH极值处增加缓慢,其中极小值7.8处增加得最为缓慢,非极值处增加较快。值得注意的是,通过调整少许pH值而增加极小值7.8处的μpH可能比加入溶解性无机碳(碳酸盐)效果更好。根据表2,绘制不同掺混倍数条件下的混合水pH、溶解性无机碳浓度于图5,分析掺混倍数对混合水缓冲能力的影响。淡化水、掺混倍数1倍、2倍、3倍、4倍、5倍混合水及地表水的μpH[单位为mmol/(L·pH)],分别为0.110、0.161、0.209、0.232、0.247、0.257、0.310,稳定水体pH的能力随掺混倍数的增加而增加。通过增加水体的缓冲,提高水体均匀稳定pH的能力,可以防止局部(如原电池阴极区发生的腐蚀)出现高的pH,改善结垢或点蚀的均匀度。缓冲容量所稳定的pH也使得输配水管道系统、贮水系统内反应引起的变化趋于稳定。Rodolfo[19]研究认为当水体碱度不变时,缓冲强度增加,碳钢的腐蚀速率降低。Stumm[20]研究也表明,随着缓冲容量在水体中的均相增加,腐蚀速率也在降低。因此,地表水掺混淡化水可增加缓冲容量,有利于水质稳定及腐蚀控制。
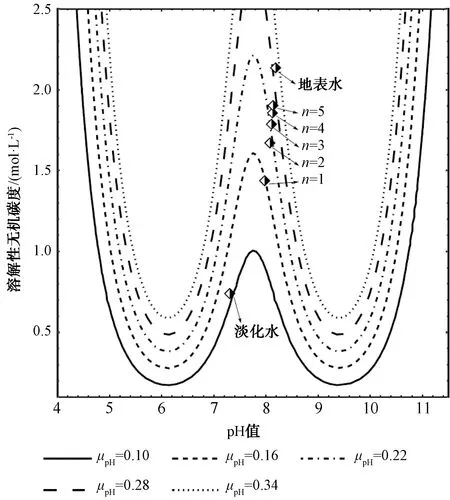
图5 水体缓冲容量μpH随溶解性无机碳、pH变化的等值线图Fig.4 Contour Map of Buffer Capacity μpHVariation with Dissolved Inorganic Carbon and pH Value
6 结论
地表水掺混海水淡化水的水质稳定性研究结论如下。
(1)随着掺混倍数的提高,混合水中溶解性无机碳、碱度、Ca2+浓度均显著提高。

(3)LSI指数表示水体实际pH与CaCO3饱和pHs的“距离”,RSI指数增加了“定位”水体pHs的能力,能更准确地反映腐蚀或结垢情况。根据本研究采用的淡化水和地表水水质,淡化水及掺混倍数1倍、2倍的混合水腐蚀严重;掺混倍数3倍、4倍、5倍的混合水及地表水腐蚀轻微。
(4)缓冲容量μpH是溶解性无机碳、pH的函数,表征水体均匀稳定pH的能力,随掺混倍数的增加而增加,改善结垢或点蚀的均匀度,稳定输水贮水系统内反应所引起的变化,有利于水质稳定及腐蚀控制。
(5)CaCO3饱和度缓冲强度μS是溶解性无机碳、pH及Ca2+浓度的函数,表征水体CaCO3饱和度对碱量变化的敏感性,随掺混倍数的增加而增加,局部(如原电池阴极区发生的腐蚀)出现高碱量时,易于形成CaCO3结垢层,有利于抑制腐蚀。
综上,地表水掺混海水淡化水有利于水质稳定,在实际生产中,掺混倍数的确定应根据当地地表水、淡化水的水质条件经评估确定,当不能达到水质稳定要求时还需补充其他水质稳定措施。
