山露菜中营养成分及黄酮种类研究
2020-07-17董梦尧陈德经鱼园园董渭雪
董梦尧,陈德经,2,*,鱼园园,董渭雪
(1.陕西理工大学生物科学与工程学院,陕西汉中723001;2.陕西理工大学陕西省资源生物重点实验室,陕西汉中723001)
山露(Petasites tatewakianus Kitam),又名掌叶蜂斗菜,为菊科蜂斗菜属多年生的草本植物[1],主要分布于小兴安岭及长白山地区,呈片状生长在小溪两侧的浅水滩、低洼地等处,对水分敏感,耐寒,喜肥沃且呈弱酸性类土壤[2],近几年在国内开始人工大面积栽培。山露菜可食用部位为茎部,富含多种必需氨基酸和矿物质,具有调节人体生理机能,增强肠胃蠕动,极强的抗炎、抗过敏、提高人体免疫等功能,欧洲民间常用其解毒去痰,正骨与治疗毒蛇咬伤[3-4],为天然的绿色食品。
王鸿等[5]对山露菜的多糖与黄酮类物质检测发现,根中多糖与黄酮类物质含量约占50.40%。黄酮类物质有及其显著的药用价值,比如陈皮苷,能够降低血脂和胆固醇,用于治疗预防老年高血压和脑溢血,向天果被誉为“植物之后”,富含黄酮类化合物,在所罗门群岛用于治疗过敏性疾病、内分泌失调等,有显著报道指出所罗门当地高血压、糖尿病发病率远低于世界各地与长期食用向天果密切相关。由此可知,黄酮类物质的药物开发与新食品研究有广阔的市场前景,山露菜的黄酮组分确定与分析将对黄酮类物质的研发提供新的方向。山露菜根茎提取物中也含有倍半萜类化合物可用于治疗偏头痛,哮喘,过敏性鼻炎等。Goto Y等[6-9]研究发现蜂斗菜属中主要化学成分有倍半萜烯、三萜类、黄酮类、生物碱类等化合物。苗艳丽[10]探究发现山露菜中富含豆甾醇、谷甾醇及酚类。豆甾醇为一种天然活性物质,可作为合成芸苔素内酯类植物生长调节剂的起始原料,具有显著的抗炎、抗肿瘤、抗心血管病等多种药理活性。谷甾醇可合成调节水,蛋白质,糖和盐代谢的类固醇激素药物,对某些癌症如乳腺癌,胃癌等的发生和发展具有一定的抑制作用[11]。山露菜中富有的甾醇类物质与黄酮类物质表明山露菜的营养成分极高。
我国属山露菜种植大国,产品多年出口,备受消费者青睐。王鸿等[5]对山露菜的营养成分作了简单的分析,王少男等[12]研究了几种蜂斗菜属植物的黄酮类化合物,但未对山露菜中黄酮种类及含量做进一步研究。本文对山露菜营养成分及黄酮含量进行研究,为评价山露菜营养成分及功效作用奠定基础。
1 材料与方法
1.1 材料与试剂
山露菜:汉中西乡。
DEAE-52纤维素:北京慧德科技有限公司;蒽酮:上海科丰实业有限公司;单糖标品(纯度98%):上海源叶生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP):上海涛宇国际贸易有限公司;37种脂肪酸甲酯混合标准品:Sigma公司;三羟甲基氨基甲烷、芦丁、紫云英苷、木樨草苷、牡荆素:天津比斯特化学科技有限公司。
1.2 仪器与设备
DZF-6050型真空干燥箱:上海一恒科学仪器有限公司;UV-1750型紫外可见分光光度仪:日本岛津仪器公司;Agilent 1100型高效液相色谱仪:美国Agilent公司;KDY-9820凯氏定氮仪:厦门精艺科技有限公司;Optima8000电感耦合等离子体发射光谱仪:美国铂金埃尔默公司。
1.3 试验方法
1.3.1 营养成分分析
1.3.1.1 原料预处理
挑选洗净晾干后的优质山露菜,分为茎、叶两个部位,分别置于干燥箱中45℃烘干,粉碎。
1.3.1.2 膳食纤维含量的测定
1)水溶性膳食纤维含量测定(soluble dietary fiber,SDF)
参考杨芙莲等[13]方法。称取1 g山露菜样品加入50mL浓度为2%的NaOH溶液超声碱解2h,4000r/min离心20 min取上清液,用1 mol/L HCl溶液调pH值至4.50,离心弃沉淀,1 mol/L NaOH溶液调pH值至7,于旋转蒸发仪65℃下浓缩至10 mL,按体积比为1∶4添加95%的乙醇沉淀1 h,过滤干燥称量,得到水溶性膳食纤维含量(SDF)。
2)不溶性膳食纤维含量测定(insoluble dietary fiber,IDF)
参考曹银等[14]方法。称取1 g山露菜样品采用索氏抽提法[15]除去脂肪,于30℃下温水浸泡2 h,4 000 r/min离心20 min取沉淀,加入50 mL浓度为2%的NaOH溶液超声中碱解2 h,真空抽滤所得沉淀经超纯水多次水洗至中性,将沉淀于50℃烘干24 h,称量得不溶性膳食纤维(IDF)。
1.3.1.3 蛋白质含量的测定
粗蛋白含量按照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》中的第一法凯氏定氮法进行测定[16]。
1.3.1.4 脂肪酸含量及组成分析
参照GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》中的第一法索氏抽提法进行测定[15,17]。
色谱条件:色谱柱为SPTM2560(100mm×0.25mm,0.2 μm)色谱柱;载气为 N2;先升温至 140 ℃保持10 min,再以5 min/℃的升温速率升至210℃,保持15 min,再以3℃/min的升温速率升至240℃,保持15 min;进样口温度为240℃,检测器温度为260℃;分流比60∶1,分别进10 μL样品进行检测。
精确称量2.50 mg脂肪酸标准品,用异辛烷定容至10 mL,避光保存于4℃冰箱中以备进行气相色谱仪检测。分别称取山露菜茎、叶5 mg,依次加入0.40 mL异辛烷、2 mol/L氢氧化钾-甲醇溶液0.02 mL,剧烈振荡3 min,加入1 g硫酸氢钠试剂,振荡取上清液过滤膜,避光保存于4℃冰箱冷藏以备进行气相色谱仪检测。
1.3.2 多糖含量及组分测定
1.3.2.1 多糖的提取
参考张媛媛等[18]方法准确称取20 g茎与20 g叶混合,加入500 mL超纯水,超声提取1 h,过滤取上清液。取滤液800 mL在63℃下旋转蒸发浓缩,浓缩量约原体积的1/3后,加入3倍体积的Sevage溶液(氯仿∶正丁醇体积比=3∶1)除去游离蛋白质,剧烈振荡,离心(4 000 r/min,15 min)取上清液,重复3次,直至中间无蛋白层,再调乙醇浓度达75%,静置离心(4 000 r/min,15 min),沉淀置于50℃真空干燥48 h,待完全干燥后称量即得山露菜茎叶粗多糖,粗多糖的提取率计算如下为:
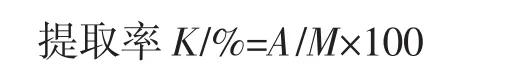
式中:A为干燥后多糖的质量,g;M为原料质量,g。
1.3.2.2 硫酸-蒽酮法绘制葡萄糖标准曲线
精确称量纯葡萄糖10 mg于105℃下干燥至恒重,用超纯水溶解配制 10、30、50、70、90 μg/mL 的葡萄糖标准溶液。再取不同浓度梯度的标准溶液2 mL放入试管中,以蒸馏水为空白组,分别加入浓度2 mg/mL硫酸蒽酮溶液8 mL,迅速冰水浴,再在100℃沸水水浴10 min取出,流水冷却,于紫外分光光度计下625 nm处测定吸光度值[19]。根据吸光度值绘制葡萄糖标准曲线。
将1.3.2.1中提取出来的粗多糖2 mL,加入浓度2 mg/mL硫酸蒽酮溶液8 mL,迅速冰水浴,再在100℃沸水水浴10 min取出,流水冷却,于紫外分光光度计下625 nm处测定吸光度值,代入葡萄糖标准曲线当中,计算葡萄糖的含量。
1.3.2.3 多糖组分分析
1)单糖标准品的衍生化
将9种单糖标准品配成浓度为5 mmol/L的混合标准液,取100μL标品溶液于试管中,依次加入100μL 0.3 mol/L 的氢氧化钠、100 μL 0.5 mol/L PMP-甲醇溶液,混匀后在70℃烘箱中衍生100 min,反应完成后冷却至室温20℃,加入100 μL 0.3 mol/L HCl中和,再加入1 mL氯仿振荡静置,弃去有机溶剂,重复萃取3次,除去未反应完全的PMP试剂,最后将上层水溶液过0.45 μm滤膜,进行高效液相色谱检测[20]。
2)高效液相色谱法(high performance liquid chromatography,HPLC)测定多糖中单糖组分
确定色谱检测条件:通过不断改变流动相的比例流动相比例、缓冲液浓度进行数次测试确定最合适的检测条件确定色谱检测条件为:流动相0.05 mol/L磷酸盐缓冲液(pH 6.9)与乙腈(体积比81∶19)。色谱柱为Diamonsil C18(250 mm×4.6 mm,5 μm);进样体积为10 μL;检测波长为 250 nm;流速为 1 mL/min。
单糖组分检测:将山露菜茎叶多糖提取物配制成浓度为2 mg/mL的多糖溶液,分别取1 mL置于试管中,加入1 mL 4 mol/L的三氟乙酸溶液,充入N2 1 min后封管,110℃下反应2 h取出冷却至室温20℃,蒸干再加入1 mL甲醇,再次蒸干,重复3次去除残留的三氟乙酸,用500 μL超纯水复溶,过0.45 μm滤膜。取100 μL过滤膜的多糖溶液按照上述1.3.2.3(1)多糖衍生化步骤进行山露菜茎叶的衍生,并进行液相色谱检测。
1.3.3 矿物质的种类分析及含量测定
准确吸取5.00 mL铁、铜、锌、钠、钙、镁、钾单元素标准溶液(1 000 μg/mL),置于 50 mL容量瓶中,用 2%硝酸溶液稀释至刻度摇匀,配置成混标溶液,4℃保存备用。再将该混合标准溶液使用逐级稀释配置成不同浓度的标准溶液,待测。
分别准确称量0.35 g山露菜茎、叶至硝解罐中,设两个平行样,加入6 mL硝酸,静置30 min,再加入2 mL过氧化氢,静置2 min,将消解罐盖上内塞,依次放入消解盘中,消解罐位置应对称分布,消解完成后待自然冷却,将试样消化液转移到25 mL聚氯乙烯容量瓶中,用超纯水多次洗涤并定容至刻度线,混匀待测,以不加式样为试剂空白,对山露茎、叶中矿物质种类元素进行电耦感合等离子体原子发射光谱法(inductively coupled plasma atomic emission spectrometry,ICP) 分析测定[21]。
1.3.4 黄酮种类及含量分析
1.3.4.1 黄酮提取
用70%乙醇按料液比1∶15(g/mL),分别提取山露菜叶、茎原料,于60℃下水浴4 h,超声提取15 min,重复操作3次后合并滤液,旋转蒸发仪浓缩至10 mL,于50℃下烘干[17],得到山露菜叶和茎的总黄酮。
1.3.4.2 黄酮含量的测定
准确称取芦丁5 mg,70%乙醇溶液溶解并定量至25 mL,配成浓度为0.20 mg/mL的芦丁标准溶液。分别取芦丁标准溶液 0.00、1.00、2.00、3.00、4.00、5.00、6.00mL,置于25 mL棕色容量瓶中。加入10 mL浓度为70%的乙醇、1.00 mL浓度为5%的亚硝酸钠溶液,充分摇匀静置6 min;加入1.00 mL浓度为10%的硝酸铝溶液,充分摇匀,静置6 min;加入10 mL浓度为4%的氢氧化钠溶液。,以上几个梯度的标品分别加入超纯水定容至刻度,摇匀,放置15 min。以不加芦丁对照品溶液为空白,于510 nm处测定吸光度[22-23]。根据各浓度下吸光度值绘制标准曲线。
将山露菜叶的醇提物与茎的醇提物分别称取5mg,置于25 mL棕色容量瓶中,参照上述标品配制方法制备样品溶液,于510 nm处测定吸光度值,将吸光度值代入标准曲线中计算含量。
1.3.4.3 黄酮种类的测定
1)色谱检测条件确定
通过改变流动相体积比,以及甲酸含量进行多次试验,确定了最合适的检测条件:流动相为甲醇-水体系(含1%甲酸),流动相体积比49∶51;进样体积:20 μL;检测波长 275 nm;流速 1 mL/min。
2)液相法测定黄酮标品、山露菜中黄酮种类测定
分别称取30 mg的芦丁、牡荆素、矢车菊素3-0葡萄糖苷、紫云英苷、金丝桃苷、木樨草苷标品用甲醇定容至10 mL,混匀后超声20 min,取上层溶液过0.22 μm有机滤膜,4℃冰箱内避光保存。
分别称取山露菜叶的醇提样品、茎的醇提样品30 mg,80%甲醇溶液定容至10 mL,混匀超声处理10 min,取上清液过0.22 μm有机滤膜,作液相分析。
1.4 数据处理
采用SPSS 18、Origin 85软件进行数据统计分析,所有指标均平行测定3次,数据采用平均值表示。
2 结果与分析
2.1 山露菜的主要营养成分
2.1.1 山露菜中脂肪、蛋白质、膳食纤维含量
山露菜中脂肪、蛋白质以及膳食纤维含量如表1所示。
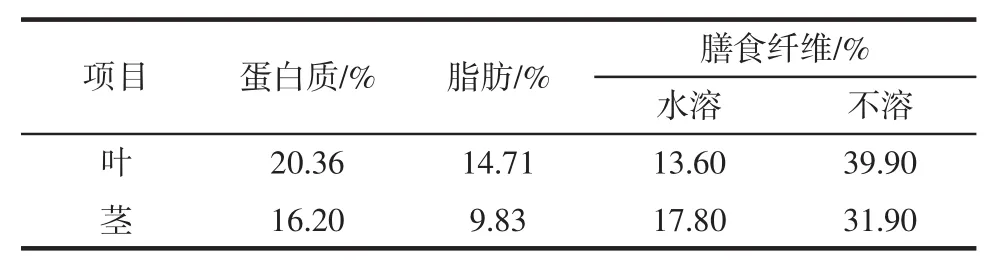
表1 山露菜主要营养成分及含量Table 1 Three nutrients and content of Petasites tatewakianus Kitam
由表1知山露菜膳食纤维的含量较高,叶中为53.5%(水溶与不溶相加),茎中膳食纤维含量为芹菜的3倍,达49.70%。不溶性膳食纤维约为水溶性膳食纤维的2倍,叶、茎中分别占39.90%和31.90%;叶中的脂肪和蛋白质含量也均高于茎。山露菜叶中的营养物质明显高于茎。
2.1.2 山露菜脂肪中脂肪酸种类
通过气相色谱仪对脂肪酸标准品、山露菜中茎及叶的脂肪酸含量进行分析得到结果如表2所示。
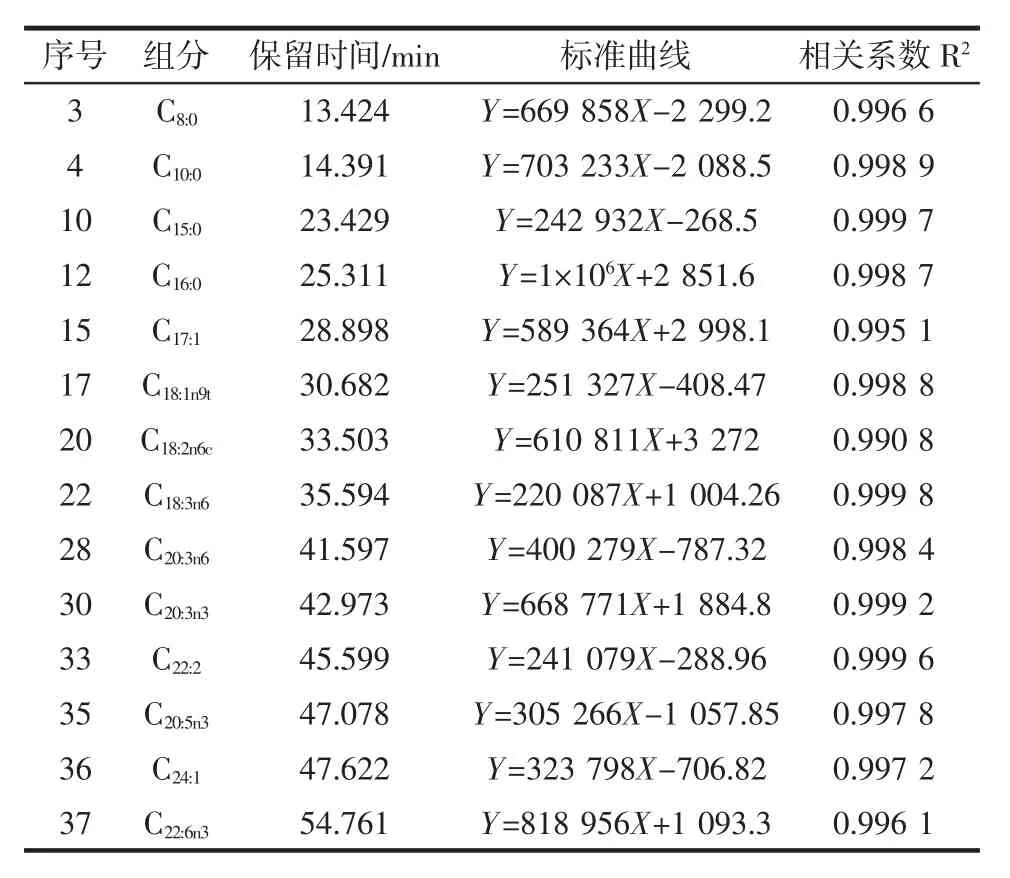
表2 脂肪酸标准曲线线性方程及相关系数Table 2 Linear equation of fatty acid standard curve and correlation coefficient
参照表2中标准曲线,分别计算山露菜中茎和叶的脂肪酸含量,绘制结果如表3所示。
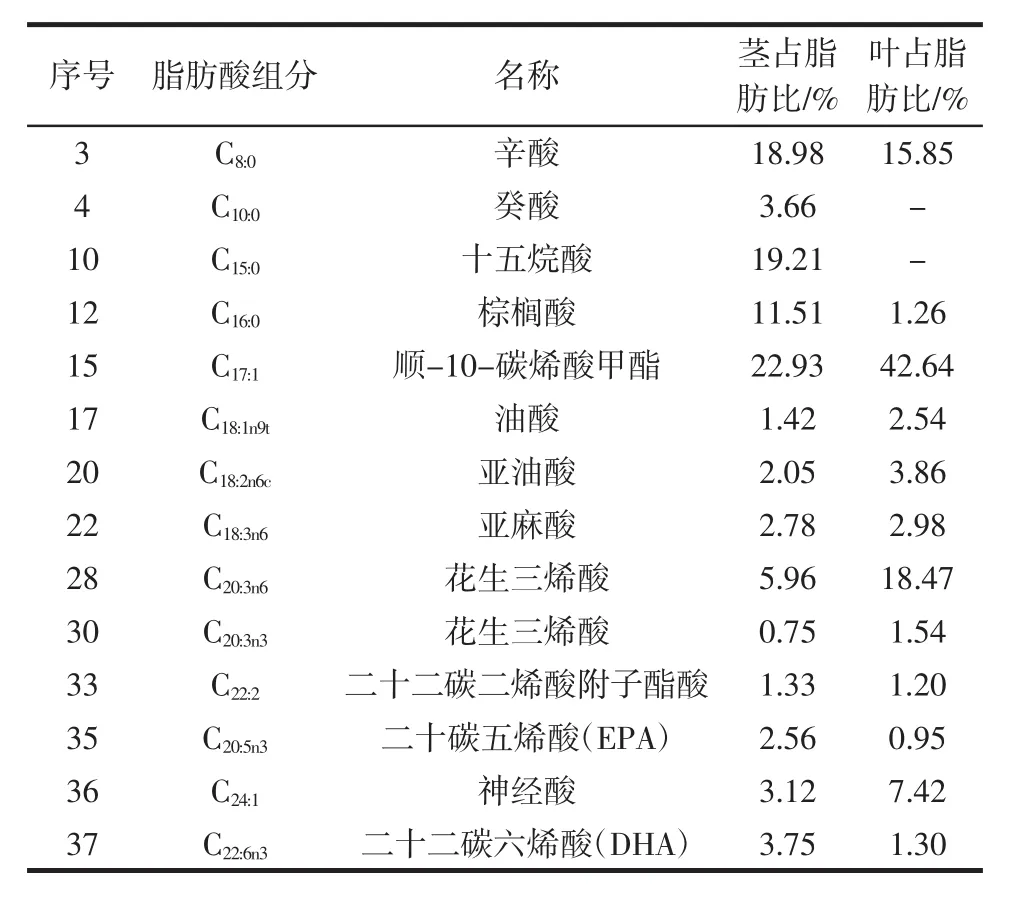
表3 山露菜脂肪酸组分含量Table 3 Petasites tatewakianus Kitam fatty acid content
根据表3可知,山露菜茎中主要含有14种脂肪酸,山露菜叶中含有12种脂肪酸,并且含有相同的12种脂肪酸如辛酸、棕榈酸等。山露菜茎中顺-10-碳烯酸甲酯、十五烷酸和辛酸及棕榈酸含量较高;叶中的顺-10-碳烯酸甲酯、花生三烯酸与辛酸含量较高,不同的部位主要脂肪酸成分与各自的成分比例存在显著差异。综合来说山露菜中C17含量最高,其次为辛酸和花生三烯酸。
2.2 山露菜多糖含量及组分
2.2.1 山露菜中多糖含量
采用超声法辅助提取山露菜茎叶中为多糖提取率为6.60%。根据不同浓度下葡萄糖吸光度值的检测结果,以吸光度值(y)为纵坐标,葡萄糖浓度(x,μg/mL)为横坐标,绘制出标准曲线图,得到标准曲线方程为:y=0.008x+0.077 6,R2=0.999 1,山露菜茎叶中含多糖1.60%。
2.2.2 多糖组分分析
2.2.2.1 标准曲线及线性范围
将9种单糖混合制成不同浓度的标准品,分别进行衍生化后并在相同的色谱条件下检测。色谱图如图1所示。
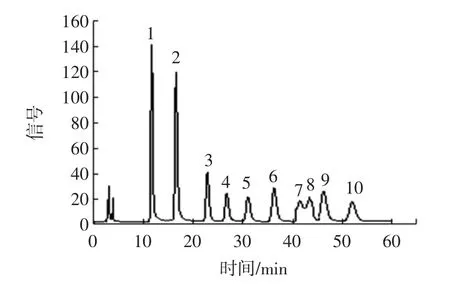
图1 9种混合单糖对照品HPLC色谱图Fig.1 HPLC of 9 mixed monosaccharide reference materials
将9种单糖混合并配制成不同浓度的标准溶液,衍生化后在相同色谱条件下检测,记录色谱图。以峰面积(Y)为纵坐标,单糖浓度(X)为横坐标绘制标准曲线,可得单糖标准曲线方程,如表4。

表4 单糖标准曲线线性方程及相关系数Table 4 Linear equation and correlation coefficient of monosaccharide standard curve
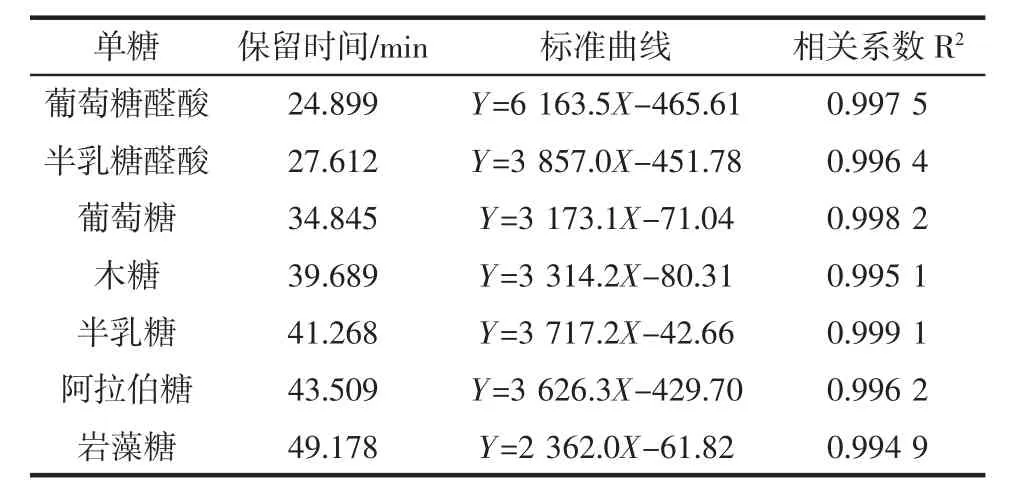
续表4 单糖标准曲线线性方程及相关系数Continue table 4 Linear equation and correlation coefficient of monosaccharide standard curve
结果表明9种单糖具有良好的线性关系,其R2在0.993 5~0.999 2。
2.2.2.2 山露菜单糖组分分析
将山露菜的叶茎多糖经柱前衍生制备的样品进行色谱分析,测定含量如表5。
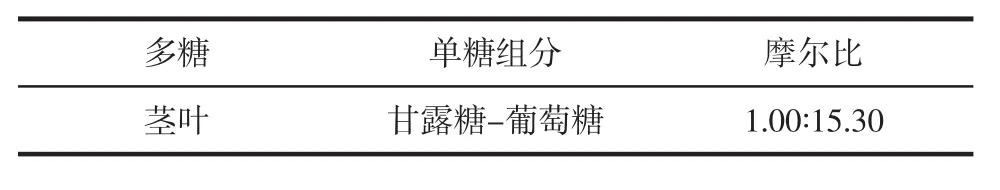
表5 山露菜多糖中单糖组分及摩尔比Table 5 Petasites tatewakianus Kitam component and molar ratio of polysaccharides
由表5可知山露菜茎叶多糖中主要为甘露糖和葡萄糖2种单糖,依据单糖的峰面积及标准曲线计算可知单糖摩尔比为1.00∶15.30。茎叶中均含有甘露糖与葡萄糖;山露菜茎叶中两种单糖含量比例大小为葡萄糖>甘露糖,且葡萄糖含量远高于甘露糖。
2.3 微量元素种类及含量
山露菜茎和叶中的7种常见微量元素种类及含量测定,结果如下表6。
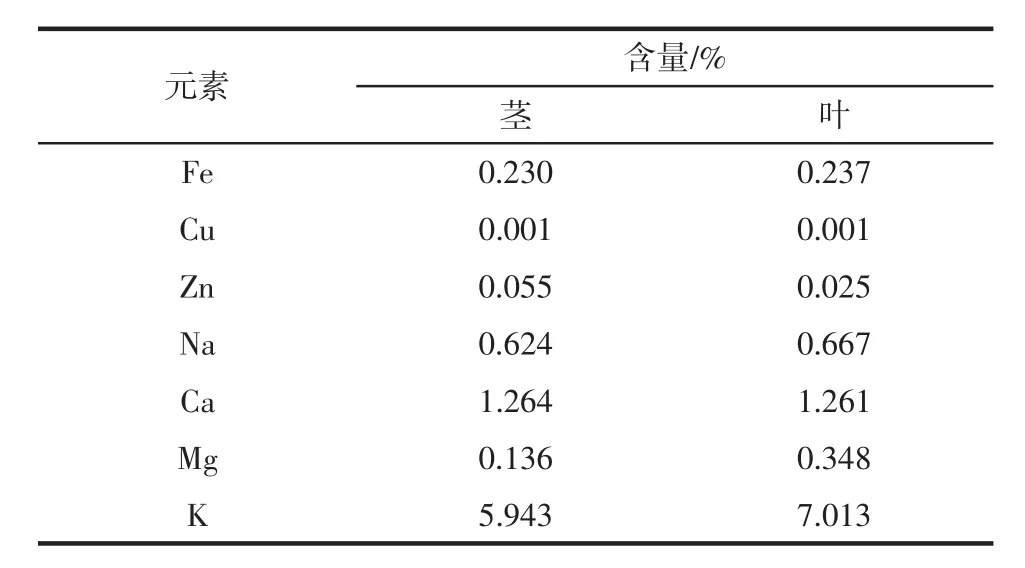
表6 山露菜7种微量元素测定结果Table 6 Determination of 7 trace elements in Petasites tatewakianus Kitam
由表6可知,山露菜中K元素含量丰富,Ca元素含量次之,能够极好的补充人体所需矿物质,Zn、Cu含量较少。
2.4 山露菜中黄酮含量、黄酮化合物种类
2.4.1 黄酮含量
将提取的山露菜样品中的黄酮类化合物,通过紫外分光光度法测定提取物中总黄酮的含量,制备标准曲线如图2所示。
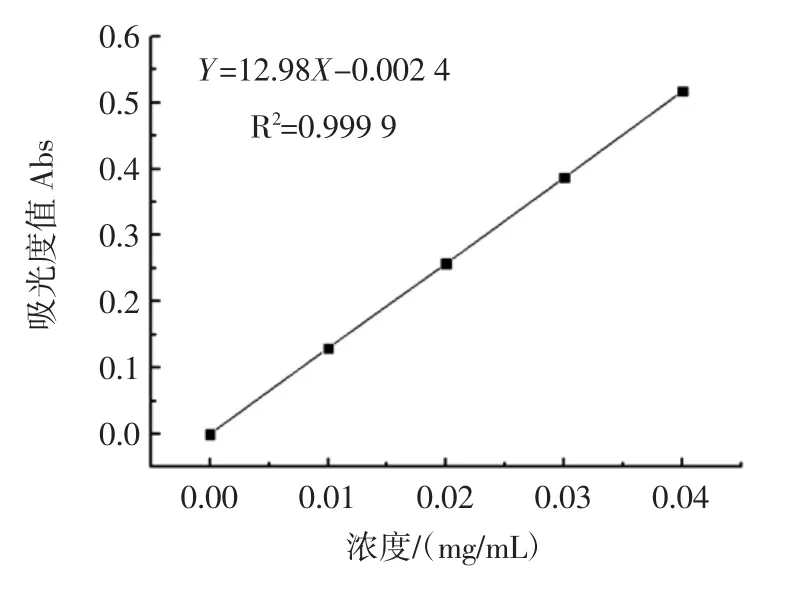
图2 芦丁标准曲线Fig.2 Rutin standard curve
Y轴-吸光度,X轴-芦丁标准溶液的浓度(mg/mL),芦丁标准曲线方程为:Y=12.986X-0.002 4,R2=0.999 9。根据标准曲线测定黄酮含量如表7所示。
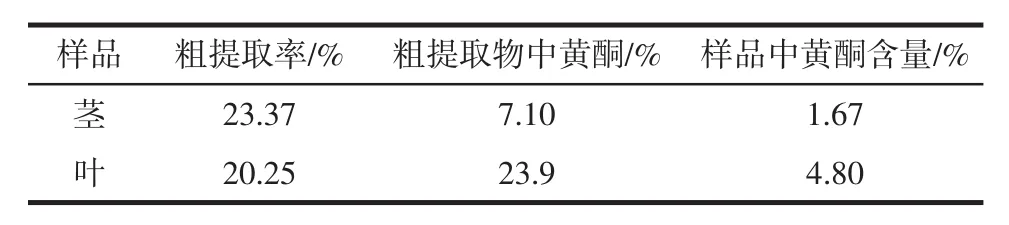
表7 黄酮提取率及含量Table 7 Flavonoid extraction rate and content
由表2.7可知,由70%乙醇提取山露茎、叶的黄酮纯度较高,总粗提取率能达43.62%(茎、叶相加)。综合比较山露菜叶中的黄酮含量远高于茎中黄酮含量,且是茎中黄酮含量的3倍。
2.4.2 黄酮组分检测及分析
2.4.2.1 标准品标准曲线方程及保留时间
将5种黄酮标品配制成不同浓度梯度的标品溶液,在相同色谱条件下进行检测,记录色谱图,并进行标准曲线绘制,结果如表8所示。
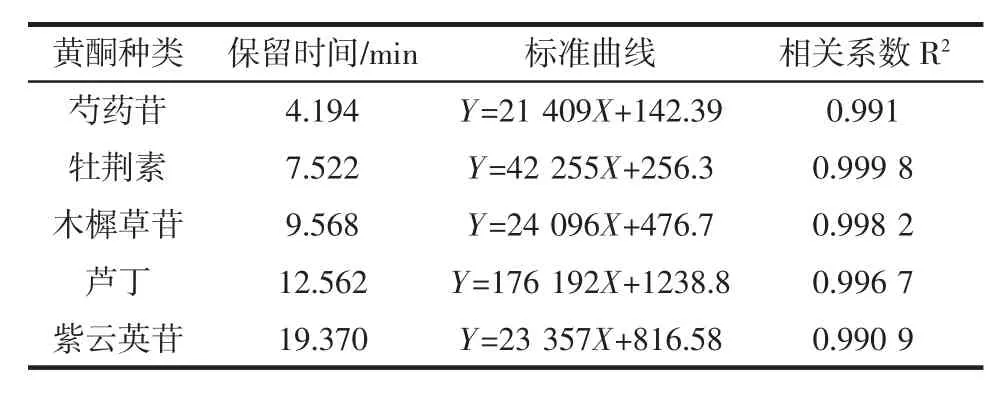
表8 黄酮标准曲线线性方程及相关系数Table 8 Linear equation and correlation coefficient of flavonoid standard curve
2.4.2.2 山露菜黄酮组分分析
用高效液相色谱仪的对照品图与山露菜样品溶液进行对比,山露菜茎中主要含有3种黄酮,分别为芍药苷、牡荆素和木樨草苷;山露菜叶中主要含有5种黄酮,分别为芍药苷、牡荆素、木樨草苷、芦丁以及紫云英苷。参照峰面积及标准曲线进行计算,结果如表9所示。
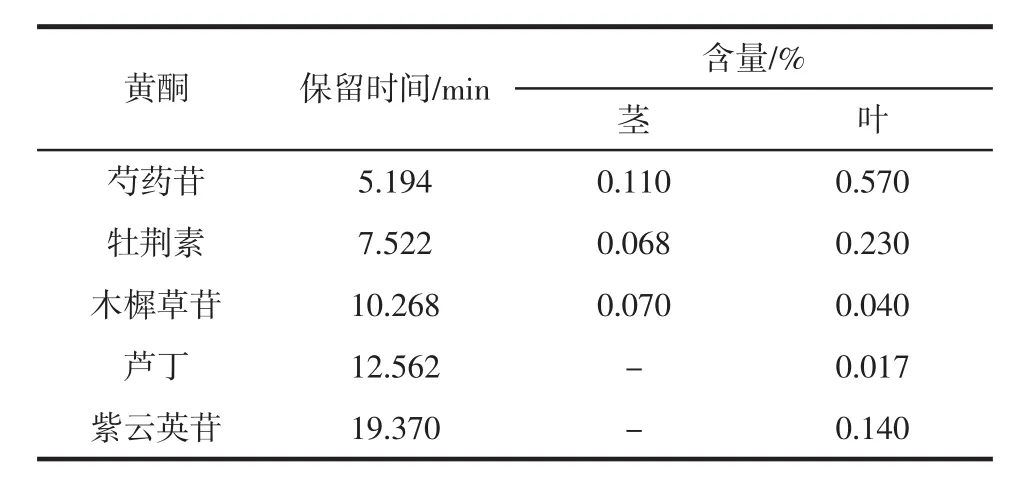
表9 山露菜黄酮组分及含量Table 9 Flavonoids and content of Petasites tatewakianus Kitam
由表9可知,山露菜茎和叶中都含有芍药苷、牡荆素和木樨草苷3种物质,山露菜叶中也含有芦丁、紫云英苷;山露菜茎、叶中5种黄酮按含量依次为芍药苷>牡荆素>木樨草苷>紫云英苷>芦丁。
3 结论
山露菜含有多糖、蛋白质、膳食纤维、油脂以及微量元素多种营养成分。叶中膳食纤维占53.50%,茎中占49.70%,能增加人体饱腹感,促进肠道蠕动,润肠通便,改善肠道菌群。山露菜叶中的黄酮含量高于茎中黄酮含量及种类,山露菜中黄酮具有一定的生理活性。山露菜的这些营养及功能成分特征也是日本人喜欢吃山露菜及大量进口山露菜的原因。
