加入芍药苷的乳鼠心脏成纤维细胞增殖、凋亡、纤维化及TGF-β1mRNA和Smad3 mRNA表达观察
2020-07-17帅壮唐锴刘茂艾娇冯杰陈剑
帅壮,唐锴,刘茂,艾娇,冯杰,陈剑
1川北医学院临床医学系,四川南充 637000;2 川北医学院附属医院;3中山大学附属第五医院
心肌纤维化和心脏重构与多种心血管疾病的发病密切相关,而心脏成纤维细胞(CFbs)在其中发挥重要作用生理状态下,CFbs可以通过控制细胞外基质的合成和降解来修复受损心肌[1]。病理状态下机械或化学刺激可促进CFbs的迁移、增殖和分化,从而分泌过多的胶原纤维,促进心脏纤维化或心肌瘢痕的形成和进展[1,2]。因此,如何减轻或逆转心肌纤维化,已成为慢性心力衰竭(CHF)研究领域的热点和难点。免疫炎症激活是CHF和心肌纤维化的重要因素[3,4]。因此,近年来各国学者积极探索抗炎和免疫调节治疗的疗效和安全性,其有望为CHF的治疗带来新的希望。芍药苷(PF)是一个单萜类糖苷化合物,是传统中药芍药的主要活性成分。PF具有多种生物活性,如免疫抑制、抗炎和减少癌细胞扩散等。此外,PF可以改善肝、肾纤维化[5,6],并可抑制TGF-β1诱导的肺动脉血管平滑肌细胞增殖[7]。我们前期研究[8]发现,PF同样具有抗心肌细胞纤维化的作用,在本实验中,我们进一步探索PF对CFbs增殖、凋亡的影响,并探讨其可能作用机制。现报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 原代Wistar乳鼠CFbs购自CHI科技公司(江阴,No20140520HXM)。芍药苷(纯度>98%)购于金穗生物科技公司(上海),血管紧张素Ⅱ(AngⅡ)(纯度>98%)购于美仑生物科技公司(大连),MTT试剂盒、Annexin V-FITC细胞凋亡试剂盒、羟脯胺酸检测试剂盒购于建成生物有限公司(南京),TRIzol购于Invitrogen公司(美国),qPCR试剂盒购于GeneCopoeia公司(美国),qPCR检测仪采用EPPENDORF(德国),流式细胞仪采用BECKMAN COULTER(美国)。
1.2 CFbs细胞分组及CF干预方法 将原代CFbs细胞加入含10%胎牛血清的DMEM/F-12(1∶1)培养液,置于5% CO2、37 ℃的培养箱中培养。每48 h更换培养液。当CFbs布满瓶底时进行传代。选择第2~3代CFbs分为4组,h阴性对照组(CON)仅加入普通培养液培养,AngⅡ组(ANG)组在培养液中加入 10-7mol/L的Ang Ⅱ,低剂量PF组(PF-L)在 培养液中加入10-7mol/L的 Ang Ⅱ和10 μmol/L的PF高剂量PF组(PF-H)在培养液中加入 10-7mol/L的Ang Ⅱ和100 μmol/L的PF。各组细胞均于5% CO2、37 ℃中培养48 h,备用。
1.3 各组细胞增殖情况观察 采用MTT法。取各组对数生长期细胞,将5×MTT用稀释液稀释成1×MTT溶液;每孔加入50 μL 1×MTT溶液,37 ℃、饱和湿度、5% CO2细胞培养箱中培养4 h;弃上清液,每孔加入150 μL的 DMSO,平板摇床摇匀;用酶标仪在630 nm处检测每孔光密度(OD)值;每孔的校正OD值等于各测试孔的OD值减去空白孔OD值,各重复孔的OD值取平均数。测算各组细胞存活率。细胞存活率(%)=(加药组细胞OD值/对照组细胞OD值)×100%。重复3次,取平均值。
1.4 各组细胞羟脯胺酸(HYP)检测 培养72 h时,取对数生长期各组细胞,严格按羟脯氨酸试剂盒说明检测各组细胞HYP含量。实验重复3次,取平均值。
1.5 各组细胞凋亡情况观察 采用流式细胞仪。取对数生长期各组细胞,PBS洗涤细胞,每组收集1~5×105个细胞;每管加入结合液 500 μL,轻轻混匀;加入Annexinn V-FITC 5 μL,轻轻混匀;加入碘化吡啶5 μL染色混匀,20 ℃~25 ℃避光孵育10 min;上流式细胞仪检测,Annexinn V-FITC为绿色荧光,碘化吡啶为红色荧光;用CXP 2.0软件获取及分析数据。测算各组细胞凋亡率。细胞凋亡率(%)=凋亡细胞数(早期凋亡+晚期凋亡)/细胞总数×100%。重复 3 次,取平均值。
1.6 各组细胞TGF-β1、Smad3 mRNA检测 采用qPCR法。取各组细胞,加入1 mL TRIzol,吹打混匀,室温放置5 min;加入200 μL氯仿,振荡混匀30 s,室温静置15 min;4 ℃下12 000 g离心15 min,吸取上层水相至无RNase 离心管;加入等体积异丙醇,轻柔地充分混匀,室温静置10 min;4 ℃下,12 000 g离心10 min,弃上清,收集RNA沉淀;加入75%乙醇,振荡悬浮沉淀,4 ℃下,8 000 g离心5 min,弃上清风干;加入60 μL DEPC水溶解沉淀,萃取CFbs细胞总RNA;利用All-in-One试剂盒逆转录cDNA,内参选用β-actin。引物序列如下: TGF-β1(F) 5′-TGCTTCAGCTCCACAGAGAA-3′, TGF-β1(R) 5′-TGGTTGTAGAGGGCAAG GAC-3′, Smad3(F) 5′-GGCAGGATGTTTCCAGCTA-3′,Smad3(R) 5′-GCAGTCC ACAGACCATGTCA-3′, β-actin(F) 5′-AGGGAAATCGTGCGTGACAT-3′, β-actin (R) 5′-GAACCGCTCATTGCCGATAG-3′。以2-ΔΔCT值代表目的基因相对表达量,重复3次取平均值。

2 结果
2.1 各组细胞OD值比较 ANG组、CON组、PF-H组、PF-L组细胞OD值分别为0.348±0.065、 0.076±0.009、0.084±0.009、0.193±0.025 ,与CON组比较,ANG组细胞OD值升高;与ANG组比较,PF-L组及PF-H组OD值降低(P均<0.05)。镜下可见,CON组CFbs细胞贴壁良好,排列整齐有序。与CON组相比,ANG组CFbs贴壁紧密,显著增殖,排列不规则。与CON组相比,PF-L组和PF-H组CFbs细胞数量显著减少,可见少许死亡细胞漂浮。见图1。
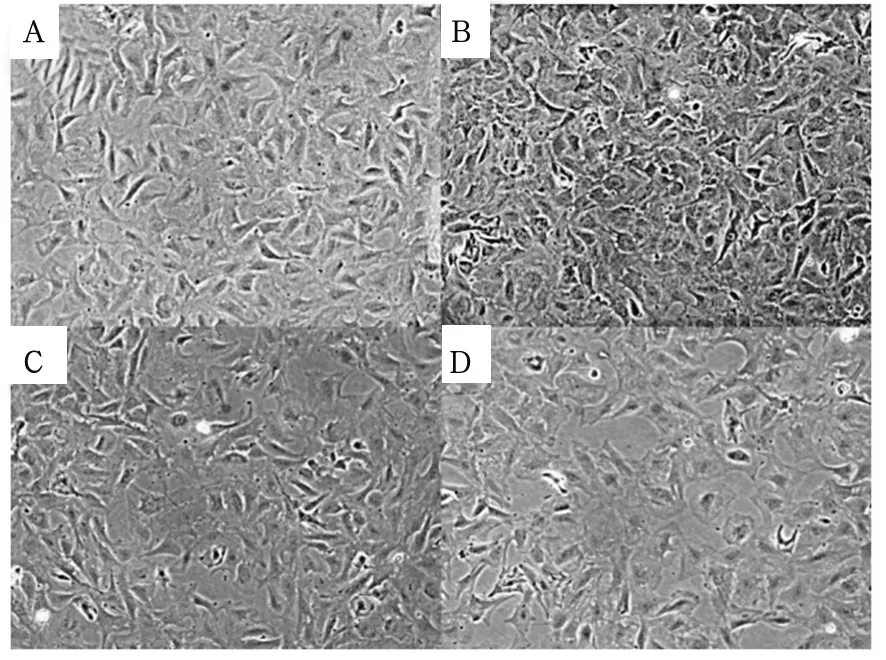
注:A为CON组;B为ANG组;C为PF-L组;D为PF-H组
2.2 各组细胞HYP含量比较 ANG组、CON组、PF-H组、PF-L组细胞HYP含量分别为(1.432±0.536)、(0.399±0.287)、(0.600±0.201)、(1.132±0.499)μg/mL,与CON组比较,ANG组细胞HYP含量升高(P<0.05),与ANG组比较,PF-H组细胞HYP含量降低(P<0.05)。
2.3 各组细胞凋亡率比较 ANG组、CON组、PF-H组、PF-L组细胞凋亡率分别为1.136±0.525、1.088±0.547、2.521±0.251、3.437±0.612,与ANG组比较,PF-L组、PF-H组细胞凋亡率升高(P均<0.05)。
2.4 各组细胞TGF-β1、Smad3 mRNA相对表达量比较 ANG组、PF-H组、PF-L组TGF-β1mRNA相对表达量分别为1.364±0.123、0.166±0.049、0.536±0.098,与CON组比较,ANG组TGF-β1mRNA相对表达量升高(P<0.05),与ANG组比较,PF-H组TGF-β1mRNA相对表量降低(P<0.05)。ANG组、CON组、PF-H组、PF-L组Smad3 mRNA相对表达量分别为1.528±0.138、0.156±0.03、0.489±0.054,与CON组比较,ANG组Smad3 mRNA相对表达量升高(P<0.05),与ANG组比较,PF-H组Smad3 mRNA相对表量降低(P<0.05)。
3 讨论
心肌纤维化主要表现为成纤维细胞的过度增殖和细胞外基质过度沉积,可导致心肌组织缺血缺氧,降低心室壁顺应性以及收缩功能,促使心功能减退[1,3,9]。心肌纤维化涉及肾素—血管紧张素—醛固酮系统、免疫系统、炎症因子、生长因子TGF-β等多种因素的参与[3,9]。AngⅡ可以促进成纤维细胞增殖、胶原沉积,从而引起心肌纤维化[10]。本研究采用AngⅡ来诱导心肌增殖。HYP是胶原组织的主要成分之一,是胶原中特有的氨基酸成分,约占胶原氨基酸总量的13%,其表达水平可间接反映心肌胶原的含量,在本研究中,我们通过对各组HYP含量进行检测,评估PF对CFbs胶原分泌的影响,结果发现AngⅡ诱导的CFbs的HYP含量显著高于正常组,PF-H组HYP含量较低,表明PF可抑制CFbs的胶原分泌。
研究[8]发现,PF可改善心肌重塑,但发挥这一作用的具体机制尚不清楚。在本研究中,通过在AngⅡ培养的CFbs模型中加入不同浓度的PF,结果发现,与正常组及ANG组相比,PF组细胞数量明显减少,且这一作用与PF成剂量依赖性。表明PF具有抑制CFbs的增殖、促进其凋亡的作用。李健哲等[11]研究发现,PF具有抗纤维化的作用,且PF浓度越高,实验组成纤维细胞增殖活性及胶原含量越低。由于我们并未单独设立PF组,因此我们并不清楚PF是否对成纤维细胞的增殖和凋亡起着直接调控作用。但李健哲等[11]研究发现,单独使用PF处理的成纤维细胞,其细胞数及胶原含量无明显变化,由此我们可以推断,PF是通过调节某种体液因子间接调控心肌纤维化,由于AngⅡ是一种重要的促纤维化因子,因此我们认为PF的抗纤维化作用可能是由于其阻断了AngⅡ的促纤维化作用。
既往研究[10,12,13]发现,AngⅡ通过调控生长因子TGF-β表达,参与了心肌纤维化的过程。TGF-β的激活促使心脏成纤维细胞向肌成纤维细胞转化,加速细胞外基质的合成与分泌,并抑制胶原的降解从而导致心肌纤维化进行性加重,在心脏重构和纤维化中扮演着重要的作用[9,14,15]。在哺乳动物中,TGF-β存在三种形式:TGF-β1、TGF-β2、TGF-β3,以TGF-β1为主[15]。Smads是TGF-β1信号通路中下游主要效应分子,包括受体激活型Smads(R-Smads)如Smadl、Smad2、Smad3、Smad5、Smad8,共同通路型Smads(Co-Smads)如Smad4,抑制型Smads(Ⅰ-Smads)如Smad6、Smad7。R-Smads主要参与纤维化的过程,Co-Smads是TGF-β必要的信号中转分子,在信号转导中起承接作用,Smad4不会直接与受体发生相互作用,但是能直接与DNA结合来调控有关基因的表达,而Smad7作为负性调控因子,可竞争性的与TGF-β1受体结合形成受体复合物,阻断TGF-β1的细胞内效应,从而抑制纤维化的发生[15]。TGF-β通过与Ⅰ和Ⅱ型TGF-β受体结合,激活下游Smad2/3信号通路,促进心脏成纤维细胞向肌成纤维细胞转化,加速细胞外基质的合成与分泌,并抑制胶原的降解从而导致心肌纤维化进行性加重[9],此外,TGF-β也参与了其他促纤维化细胞因子的合成和分泌[9],共同促进了心脏纤维化的发生。本研究中,AngⅡ可上调TGF-β1、Smad3 mRNA表达。加入PF可抑制CFbs增殖、凋亡,抑制HYP表达,其可能机制为PF抑制细胞TGF-β1及Smad3 mRNA表达。相反,PF则阻断了AngⅡ的这一作用,抑制了TGF-β1/Smad3信号通路的表达,且PF浓度越高,对TGF-β1/Smad3信号通路的抑制越明显。因此,我们认为,PF可能是通过抑制AngⅡ促进TGF-β1/Smad3信号通路的表达发挥了抑制CFbs的增殖的作用。
综上所述,PF可通过抑制CFbs的增殖、促进CFbs凋亡、抑制CFbs胶原的分泌,达到抗纤维化的目的,这一作用与抑制AngⅡ对TGF-β1/Smad3信号通路的激活密切相关,但是否通过其他分子影响了TGF-β1/Smad3信号通路的表达或影响了其他Smad分子尚不清楚,有待于进一步研究。
