污酸浸出锌窑渣过程中铜的浸出行为及动力学研究
2020-07-16曾涛邓志敢张帆樊刚魏昶李兴彬李旻廷刘慧杨
曾涛,邓志敢,张帆,樊刚,魏昶,李兴彬,李旻廷,刘慧杨
(1.昆明理工大学冶金与能源工程学院,云南昆明,650093;2.东莞理工学院生态环境工程技术研发中心,广东东莞,523808)
锌窑渣是湿法炼锌工艺中的锌浸出渣经威尔兹法处理得到的产物[1],在高温条件下,锌浸渣中的铜富集在窑渣中。2018 年我国锌冶炼行业年产窑渣约150 万t,其中含有约5 万t 铜,若对锌窑渣处理不当,则会造成我国有价金属资源大量浪费,同时加重土地和环境污染。目前,国内外学者针对窑渣的回收利用开展了许多研究,但大多侧重于窑渣中铜、铁等有价金属的回收工艺的研究。ZHANG等[2-3]采用微生物体系浸出窑渣,能回收部分有价金属资源,但微生物的浸出环境难以控制。JIANG 等[4]采用硫酸盐焙烧-水浸组合的方法处理窑渣,对锌、铜、锰等金属具有较好的回收效果;WANG 等[5-6]利用盐酸浸出窑渣中的铁、铜、锌等有价金属。目前,国内外研究者对窑渣中铜的浸出动力学研究较少,对有关铜浸出动力学的研究大部分集中于黄铜矿、斑铜矿等矿物[7-8]。王新宇等[9-10]研究了黄铜矿在H2SO4-NaCl体系中的浸出动力学,发现浸出反应符合界面化学反应模型,其表观活化能为21.32 kJ/mol,并发现Mg2+的存在抑制了黄铜矿的浸出。AYDOGAN 等[11]研究了H2SO4和KMnO4对黄铜矿浸出的影响,发现在H2SO4-KMnO4体系下黄铜矿的浸出反应符合穿过多孔产物层的动力学模型,计算得到反应活化能为24 kJ/mol。徐佳键等[12]研究了斑铜矿在酸性溶液中的浸出动力学,发现反应符合固体膜层的界面传质和扩散的混合控制模型,其表观活化能为33.97 kJ/mol。ADEBAYO等[13-14]在H2O2-H2SO4体系中研究黄铜矿的浸出作用时发现浸出数据符合界面反应模型,此时,界面反应速率决定了黄铜矿的反应速率。锌冶炼行业产出的污酸酸度高,含有大量的砷及其他重金属离子,目前主要采用石灰沉淀法对其进行处理。该法以石灰为反应试剂,处理成本低,工艺简单,但也存在渣量大、易造成二次污染等问题[15]。FUJITA 等[16]在常压通氧条件下使含砷溶液中的砷以臭葱石(FeAsO4·2H2O)的形式脱除,具有环保高效、固砷化物稳定性好等优点,但其需要加入FeSO4·7H2O 作为铁源。窑渣中富含大量的铁元素,将窑渣与污酸进行联合处置,用污酸溶解窑渣中的复杂铁铜化合物,在消耗污酸的同时创造一个富含亚铁离子的溶液环境,再利用常压合成臭葱石的方法进行沉砷处理,实现窑渣的资源化利用和污酸的清洁化处理。本文作者针对污酸浸出锌窑渣中过程中铜的可控提取,研究铜的浸出行为及动力学,探讨液固比、反应温度、窑渣粒径、搅拌转速、氧分压等因素对铜浸出率的影响规律,以实现窑渣中铜的高效浸出以及污酸与窑渣的联合处理。
1 实验
1.1 实验原料
实验所用的锌窑渣来自云南某炼锌厂,其成分如表1 所示。由表1 可知:Fe,Cu,Zn 和 Ag 是窑渣中的主要有价元素,同时,窑渣中还含有大量的硅和焦炭,会对浸出后的液固分离过程造成影响[17]。

表1 锌窑渣的主要化学成分(质量分数)Table 1 Main chemical composition of zinc waelz slag %
对锌窑渣进行XRD 及SEM 分析,结果如图1所示。由图1可知:窑渣成分复杂,物相及嵌布复杂,窑渣中含铁的主要物相为FeS,Fe2O3和Fe3O4等。从图1可知窑渣中铜的主要物相为铜蓝(CuS)、黄铜矿(CuFeS2)及赤铜矿(Cu2O),在回转窑挥发过程中,锌浸渣中的氧化铜在还原气氛下与渣中的硫化物相结合生成黄铜矿及铜蓝,因此,在浸出过程中需要加入氧化剂以溶解复杂的铜硫物相,促进铜的浸出[18]。对窑渣进行SEM-EDS 扫描,结果如图2所示。从图2可见:C,Fe,Ca和Si等都存在极强的特征衍射峰,其中碳主要以单质块存在,大量的复杂铁、铜、硫化合物附着在碳块上,还有部分物相与SiO2存在相互包裹现象。锌窑渣中Cu的化学物相组成(质量分数)如表2所示。

图1 锌窑渣的XRD和SEM图Fig.1 XRD pattern and SEM image of zinc waelz slag

图2 锌窑渣的SEM像及EDS谱Fig.2 SEM image and EDS spectrum of zinc waelz slag
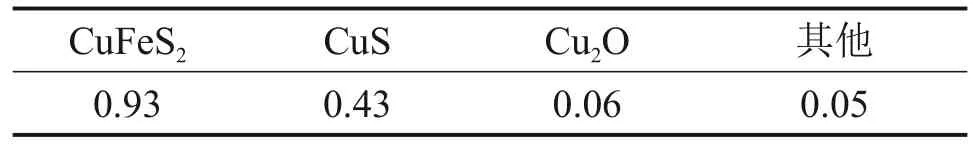
表2 锌窑渣中Cu的化学物相组成(质量分数)Table 2 Cu phase composition in zinc waelz slag %
实验所用的污酸来自于云南某炼锌厂,污酸成分如表3 所示。由表3 可知其硫酸质量浓度达172.48 g/L,同时As的质量浓度较高,因此,可以利用污酸溶解窑渣中大量的复杂铁铜硫化物,在消耗污酸的同时创造一个含有大量Fe2+和As 的溶液环境,再利用常压合成臭葱石法进行沉砷处理,实现窑渣中有价资源的回收与污酸中砷、酸的高效脱除。同时,污酸中还含有一定质量浓度的Cl,黄振谦[19]发现在高酸条件下,Cl在Cu-Fe-S-Cl-H2O体系中以Cl-形式存在,不会在体系中与金属离子生成络合物影响反应进行。何仕超[20]发现在Cl-质量浓度较低时,对窑渣中铁铜硫化物的溶解浸出影响较小。
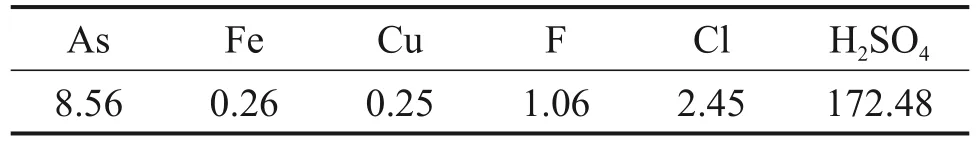
表3 污酸的主要化学成分(质量浓度)Table 3 Main chemical components of waste acid g/L
1.2 实验仪器与方法
1)实验主要仪器:HH-S28s 型恒温水浴锅(金坛市大地自动化仪器厂);2L-GSH 型高压釜及温控仪(山东威海化工机械有限公司);2XZ-2型旋片式真空泵(浙江台州求精真空泵有限公司);真空干燥箱(上海一恒科学仪器有限公司)等。
2)实验方法。
①对于常压实验,称取100 g窑渣,将定量污酸加入三口烧瓶中,固定于恒温水浴锅中,连接供氧装置,设定好实验参数,开始实验。在实验过程中,定时进行取样,实验结束后,使用真空泵对矿浆进行液固分离,并收集滤渣(干燥箱烘干)和滤液待检。
②对于加压实验,将窑渣和污酸加入高压釜中,连接供氧装置并检查气密性。设定实验参数,控制氧气压力为实验温度下水溶液的蒸汽压与设定实验氧压参数之和,当温度达到预定值后开始通氧。在实验过程中进行取样,待实验完毕后,停止供氧并快速降温,用真空泵进行液固分离,并收集滤液及滤渣待检。渣样中的元素委托昆明冶金研究院进行检测,液样中的元素采用原子吸收分光光度计进行检测。采用下式计算浸出过程的浸出率:
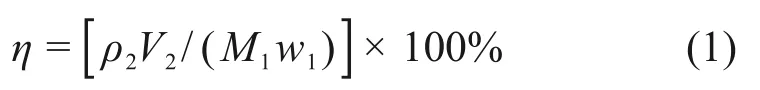
式中:η为浸出率,%;M1为窑渣质量,g;w1为窑渣中的元素质量分数,%;ρ2为浸出液中离子浓度,g/L;V2为浸出液体积,L;
1.3 实验原理
由图1 和表3 可知窑渣中铜的主要物相为CuFeS2,Cu2O及CuS,赖绍师[21]绘制的E-pH图(其中,E为溶液的氧化还原电位)表明,在Fe-Cu-SH2O 系中,当溶液电位较低时,Cu2+不能稳定存在,低价硫也很难被氧化,因此,反应体系的电位需要适当提高,以氧化体系中的低价硫,进而溶解溶液中的铜硫化物,提升Cu 的浸出率。本文以氧气作为氧化剂,根据JIN等[22]推出的公式计算溶液的氧化还原电位E:
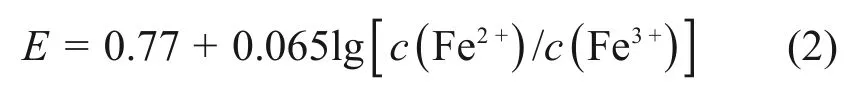
式中:c(Fe2+)和c(Fe3+)分别为溶液中Fe2+和Fe3+浓度。
污酸浸出窑渣过程中发生的主要化学反应为:

图3 298 K时Fe-Cu-S-H2O系的Eh-pH优势区图Fig.3 Eh-pH dominant area map of Fe-Cu-S-H2O system at 298 K

2 结果与讨论
2.1 不同条件对污酸浸出窑渣中Cu浸出的影响
2.1.1 液固比对窑渣中Cu浸出的影响
取窑渣100 g,反应温度为70 ℃,窑渣粒径为75~106 μm,搅拌转速为300 r/min,在常压条件下反应3 h。液固比对窑渣中Cu浸出行为的影响如图4所示。
由图4 可知:随着液固比逐渐增大,窑渣中Cu 的浸出率逐渐升高;当液固比由8 mL/g 升至14 mL/g 时,经过60 min 浸出,窑渣中Cu 的浸出率由79.86%上升至90.53%。Cu的浸出曲线可以明显地分为2 个阶段:第1 阶段即反应前期(<60 min),Cu 的浸出率随反应时间的延长迅速升高;第2阶段即浸出后期(浸出时间>60 min),由于大部分Cu在反应前期已经被浸出,反应时间对Cu的浸出影响较小。随着液固比增大,污酸在溶液主体中与窑渣反应界面上的浓度差增大,其由溶液主体扩散到窑渣反应界面的速度加快,Cu 的浸出速率增大。
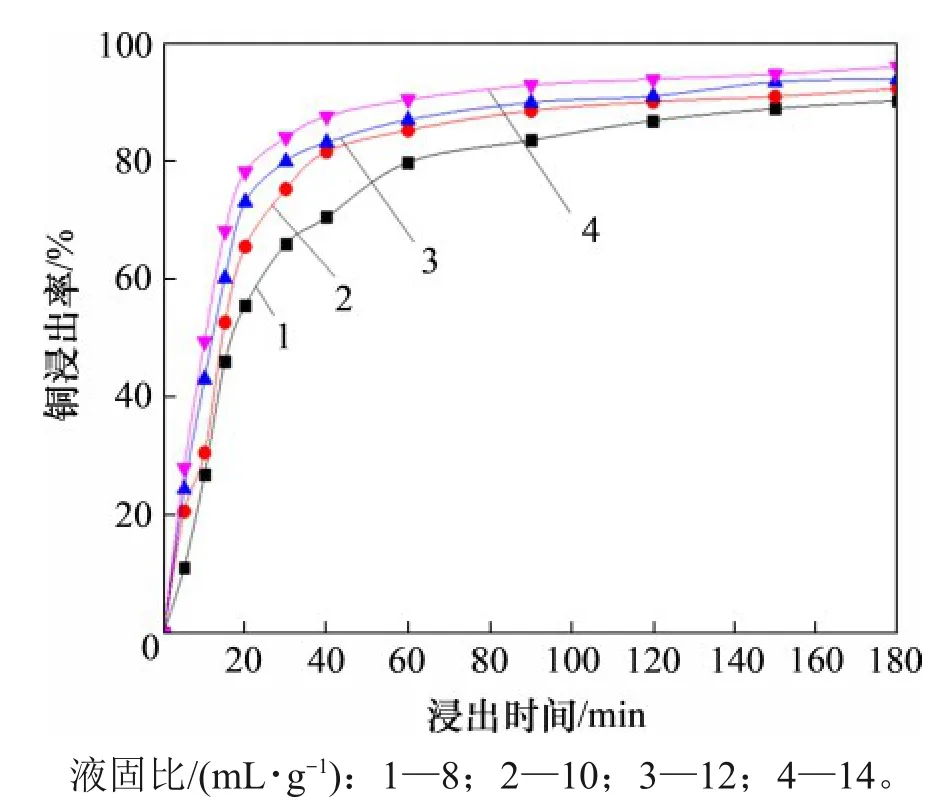
图4 液固比对Cu浸出率的影响Fig.4 Effect of liquid-solid ratio on Cu leaching rate
2.1.2 反应温度对窑渣中Cu浸出的影响
取窑渣100 g,粒径为75~106 μm,液固比为10 mL/g,搅拌转速为300 r/min,在常压条件下反应3 h,温度对窑渣中Cu 浸出行为的影响如图5所示。
由图5 可知:随着温度升高,Cu 的浸出速率逐渐增大;当温度由60 ℃提高到90 ℃时,经过60 min 浸出,Cu 的浸出率由65.06% 增加到82.92%。温度是分子热运动的控制参数,温度越高,物质分子热运动越剧烈。在浸出过程中,随着温度升高,体系中各物质分子热运动将加剧,活性分子比例增大,单位时间内参加化学反应的分子数量增多,浸出反应速率加快。
2.1.3 窑渣粒度对窑渣中Cu浸出的影响
取窑渣100 g,液固比为10 mL/g,温度为70 ℃,搅拌转速为300 r/min,在常压条件下反应3 h,窑渣粒径对窑渣中Cu 浸出行为的影响如图6所示。
由图6 可知:随着窑渣粒度减小,窑渣中Cu的浸出率逐渐升高;当窑渣颗粒直径从120~150 μm减小到 53~75 μm 时,经过 60 min 浸出,Cu 的浸出率从60.63%上升至85.33%。浸出过程属于液固相反应的范畴,在浸出过程中,污酸在固体颗粒反应界面与矿物发生溶解反应。对于固体颗粒,其反应界面面积随颗粒直径减小而增加,反应界面面积越大,单位时间内与窑渣发生反应的污酸越多,浸出反应的速率便越快。

图6 窑渣粒径对Cu浸出率的影响Fig.6 Effect of particle size on Cu leaching rate
2.1.4 搅拌转速对窑渣中Cu浸出的影响
取窑渣100 g,粒径为75~106 μm,液固比为10 mL/g,温度为70 ℃,在常压条件下反应3 h,搅拌转速对窑渣中Cu浸出行为的影响如图7所示。
由图7 可知:随着搅拌转速加快,窑渣中Cu的浸出率不断升高;当转速达到400 r/min以上时,继续加快转速,Cu 的浸出率变化并不明显。这是因为随着转速加快,体系中离子的外扩散速度不断加快,窑渣颗粒周围的外扩散边界层厚度不断降低,窑渣的溶解速率不断升高,Cu 的浸出速率也逐渐升高;当转速达到400 r/min 以上时,窑渣颗粒周围的外扩散边界层达到极小值,颗粒外部的传质阻力达到最小,体系中离子的外扩散过程不再是反应速率的控制环节。
2.1.5 氧分压对窑渣中Cu浸出的影响
取窑渣100 g,粒径为75~106 μm,液固比为10 mL/g,温度为70 ℃,反应时间为3 h,氧分压对窑渣中Cu浸出行为的影响如图8所示。
由图8 可知:当氧分压从0.2 MPa 上升至0.5 MPa 时,经过60 min 浸出,Cu 的浸出率由60.25%升至85.71%。在窑渣的加压浸出过程中,氧气是主要的氧化剂,在酸性溶液体系下,氧分压增加有利于氧气溶解度增加[23]。随着溶液中氧气溶解增多,体系中参与反应的氧分子增多,更有利于反应(3)~(7)的进行,进而促进窑渣中Cu 的浸出。
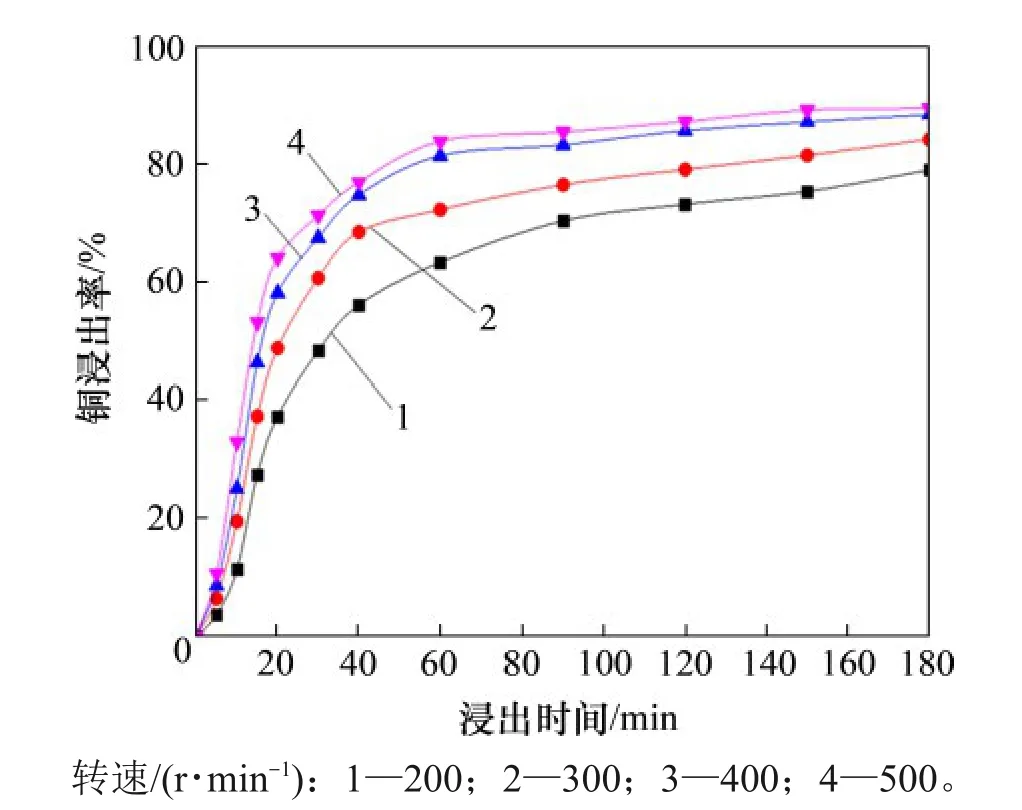
图7 搅拌转速对Cu浸出率的影响Fig.7 Effect of stirring speeds on Cu leaching rate
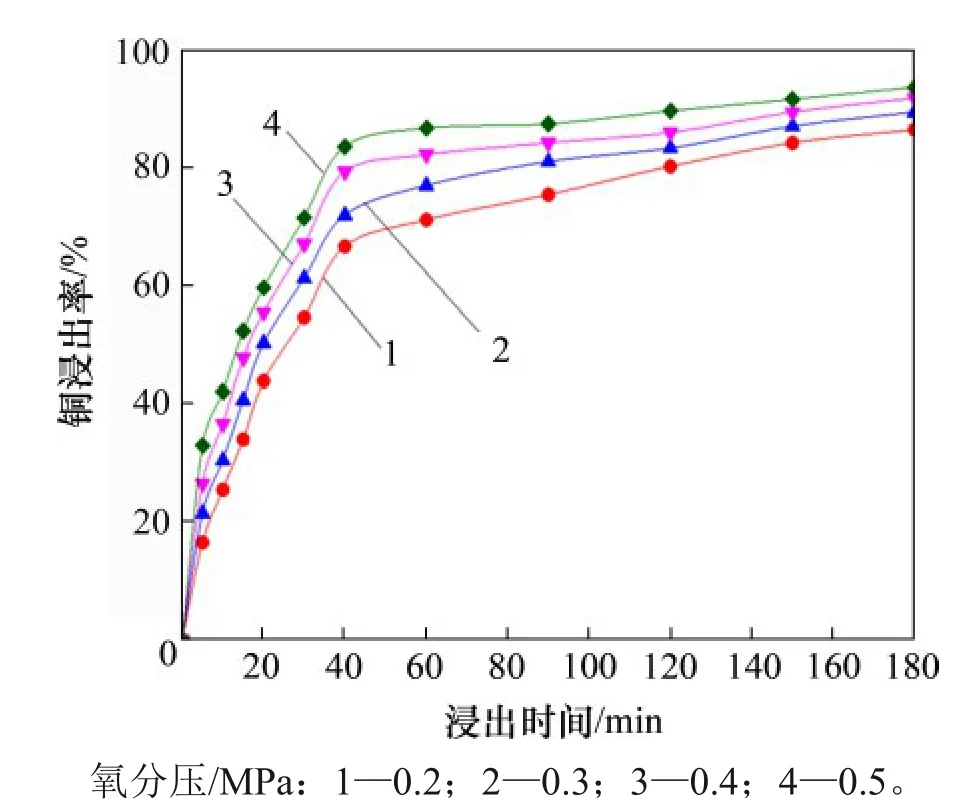
图8 氧分压对Cu浸出率的影响Fig.8 Effect of oxygen pressure on Cu leaching rate
2.1.6 综合实验
通过前面实验选定污酸浸出窑渣中铜的综合条件:液固比为10 mL/g,温度为90 ℃,窑渣粒径为 53~75 μm,转速为 400 r/min,氧分压为0.5 MPa。在此条件下进行实验,铜、铁、锌的浸出率分别达95.05%,85.69%和82.95%。
浸出液的主要成分如表4所示。由表4可知溶液中Fe2+质量浓度达18.60 g/L,As 质量浓度达8.76 g/L,浸出液的pH 为0.6。可以利用水热合成臭葱石法进行沉砷处理,使溶液中的砷以臭葱石的形式脱除。
浸出渣的成分如表5所示。由表5可知:浸出渣中Cu 质量分数下降至0.1%,Ag 质量分数达427.9 g/t,故可作为提银原料。对浸出渣进行XRD分析,结果如图9所示,从图9可知浸出渣中的主要物相为焦炭、SiO2和CaSO4·2H2O。对浸出渣进行SEM-EDS 表征,结果如图10 所示。由图10 可知:浸出渣表面较光滑,并未发现明显的固体产物层。根据EDS能谱可以看出:浸出渣中C,Si和Ca 等元素出现较强的衍射峰,对比窑渣的EDS 谱发现原有的大量Fe,Zn和Cu等元素的衍射峰消失或减弱,这表明污酸体系对窑渣中Fe,Zn和Cu等有价金属的浸出效果良好。

表4 浸出液的主要化学成分(质量浓度)Table 4 Main chemical composition of leaching solution g/L

表5 浸出渣的主要化学成分(质量分数)Table 5 Main chemical composition of leaching residue%
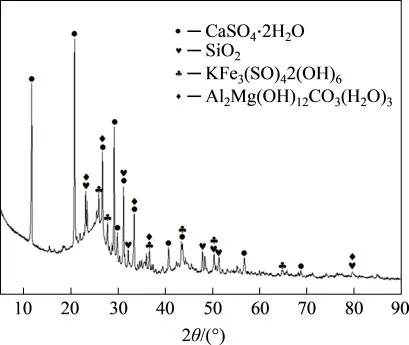
图9 综合实验浸出渣的XRD图Fig.9 XRD pattern of leaching residue under comprehensive conditions

图10 综合条件实验浸出渣的SEM-EDS图Fig.10 SEM-EDS diagrams of leaching residue under comprehensive conditions
根据HJ 557—2009“固体废物浸出毒性浸出方法——水平振荡法”,委托昆明冶金研究院对浸出渣进行浸出毒性检测,毒性浸出得到的上清液中主要危害成分质量浓度如表6所示。从表6可知浸出渣中的主要危害成分的质量浓度均低于GB 5085.3—2007“危险废物浸出毒性鉴别标准”规定值。
2.2 浸出动力学分析
2.2.1 反应活化能
在污酸浸出锌窑渣过程中,氧气首先很快溶于溶液中,再与固体发生反应,因此,有氧气参与的浸出反应实质上属于液-固相反应[24]。液固多相反应中生成物可溶于水,固体颗粒外形尺寸随反应的进行逐渐减少直至为0,该反应可以用未反应收缩核模型描述[25]。由浸出渣的SEM 图可以看出浸出渣表面并未有明显固体产物层生成,因此,可以认为该反应属于收缩核模型(SCM)。根据冶金动力学中收缩核模型的相关理论,反应过程由反应物与生成物在液相中的外扩散、反应物与生成物在固相中的内扩散和反应物之间的界面化学反应组成,浸出过程总反应速率取决于反应最慢的环节。收缩核模型的速率方程如下[26-28]:
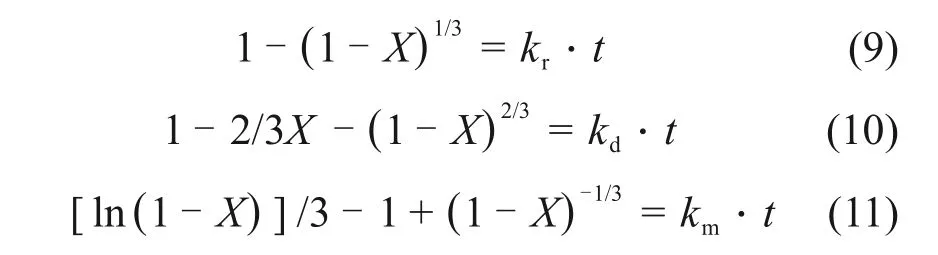
式中:X为铜的浸出质量分数,%;t为浸出时间,min;kr,kd和km分别为由化学反应、固体产物层内扩散以及由两者混合控制的表观速率常数。
为了确定浸出过程的动力学参数和控制步骤,根据图5,将不同温度下所得的铜浸出率X对时间t分别按照式(9),(10)和(11)进行线性拟合,结果表明式(11)的线性相关系数较高,式(9)和(10)的相关系数均小于0.92,这表明混合扩散控制可能适合于窑渣中铜的浸出。
将图5中的实验结果按ln(1-X)/3-1+(1-X)-1/3对时间t作图,结果如图11所示。由图11可知:ln(1-X)/3-1+(1-X)-1/3对时间t呈良好的线性关系,各温度下得到的相关系数R2均大于0.95,这也表明窑渣在污酸中的浸出特性可以由上述动力学方程进行描述。对图11 进行线性回归,所得直线的斜率即为反应速率常数k。对Arrhenius公式[29]
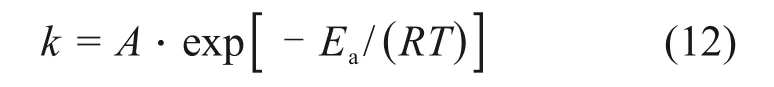
两边取自然对数可得

式中:A为频率因子;Ea为表观活化能,kJ/mol;R为气体平衡常数,R=8.314 J/(mol·K);T为热力学温度,K。以lnk对1/T作图得浸出过程中铜的Arrhenius曲线,如图12所示。由图12可求出反应的表观活化能Ea=32.82 kJ/mol。
2.2.2 液固比反应级数的确定
将图3中的数据按ln(1-X)/3-1+(1-X)-1/3对时间t作图,结果如图13所示。由图13可知不同液固比下窑渣中铜的浸出过程亦可用固体膜层内扩散和界面化学反应混合收缩模型来描述,对图13 中的数据进行线性回归,所得直线的斜率即为反应的速率常数kL/S。设液固比为e,用lnke对lne作图,结果如图14所示。从图14中直线斜率得到液固比的反应级数为1.011,这表明提高反应的液固比有利于提高铜的浸出速率。
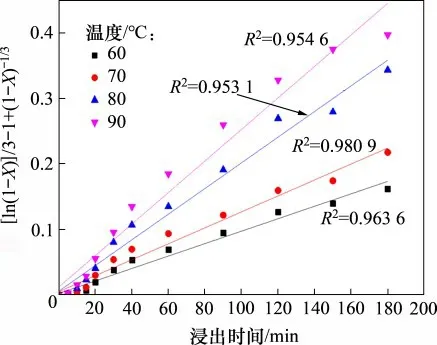
图11 不同温度下ln(1-X)/3-1+(1-X)-1/3与时间的关系Fig.11 Relationship between ln(1-X)/3-1+(1-X)-1/3 and time at different temperatures
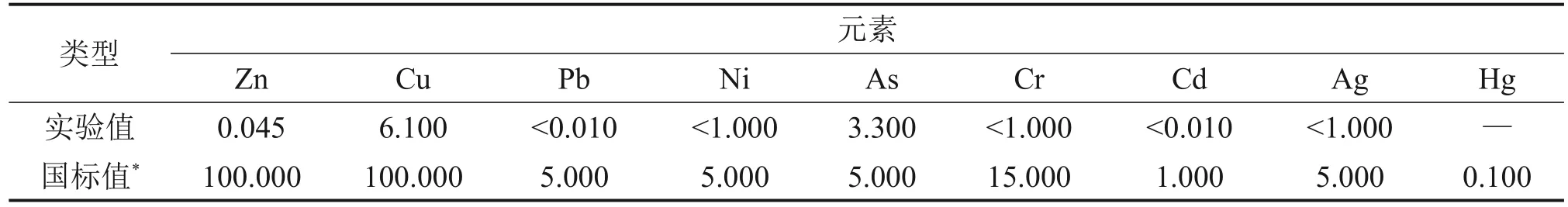
表6 毒性浸出后液主要成分(质量浓度)Table 6 Main chemical composition of TCLP leaching solution mg/L

图12 lnk与1/T的关系Fig.12 Relationship between lnk and 1 000/T
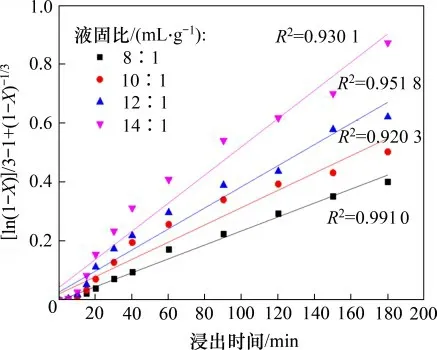
图13 不同液固比e下ln(1-X)/3-1+(1-X)-1/3与时间的关系Fig.13 Relationship between ln(1-X)/3-1+(1-X)-1/3 and time at different liquid-solid ratios
2.2.3 窑渣粒径反应级数的确定
将图6 中的数据按 ln(1-X)/3-1+(1-X)-1/3对t作图,结果如图15所示。由图15可知ln(1-X)/3-1+(1-X)-1/3与时间t呈线性关系。取窑渣的平均粒径d0对图15中的曲线进行线性回归,求得直线的斜率即为反应的速率常数kd,以lnkd对lnd0作图,结果如图16所示。由图16 可知窑渣粒径对浸出反应的反应级数为-1.505,这表明粒径越小,更能促进浸出反应的进行。
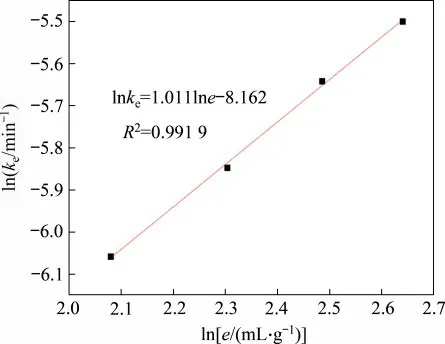
图14 不同液固比e下lne与lnke的关系Fig.14 Relationship between lne and lnke at different liquid-solid ratios

图15 不同窑渣粒径下ln(1-X)/3-1+(1-X)-1/3对时间的关系Fig.15 Relationship between ln(1-X)/3-1+(1-X)-1/3 and time at different kiln slag particle sizes
2.2.4 氧分压反应级数的确定
将图8 中的数据按 ln(1-X)/3-1+(1-X)-1/3对t作图,其结果如图17 所示。由图17 可知ln(1-X)/3-1+(1-X)-1/3与时间t呈线性关系。对图17 中的数据进行线性回归,得直线斜率kp,以lnkp对lnp作图(p为氧分压,MPa),结果如图18所示。从图18中直线斜率可知氧分压的反应级数为0.749,这表明提升体系的氧分压能有效地提高浸出反应的反应速率。

图16 不同窑渣粒径下lnkd与lnd0的关系Fig.16 Relationship between lnkd and lnd0 at different kiln slag particle sizes

图17 不同氧分压下ln(1-X)/3-1+(1-X)-1/3与时间的关系Fig.17 Relationship between ln(1-X)/3-1+(1-X)-1/3 and time at different oxygen pressures

图18 不同氧分压下lnp与lnkp的关系Fig.18 Relationship between lnp and lnkp at different oxygen pressure ratios
2.3 动力学方程的建立
在本研究中温度、液固比、窑渣粒度和氧分压都对浸出反应有较大的影响,因此,新的缩小核模型的变体表观反应速率常数可以写为[30]
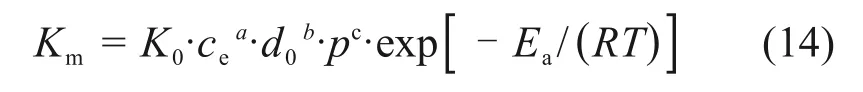
式中:K0为阿伦尼乌斯常数;a,b和c分别为液固比、窑渣粒径、氧分压的反应级数。式(13)可以表示为如下形式:
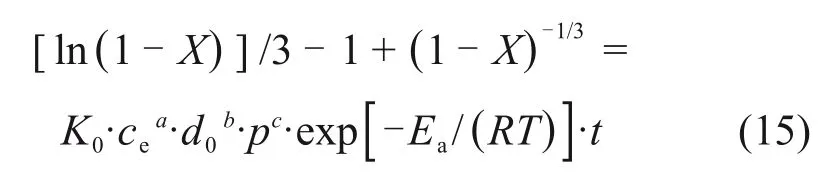
由图11 可得反应的表观活化能为32.82 kJ/mol,由截距求得阿伦尼乌斯常数K0=130.2,反应级数a,b和c分别由图13、图15和图17 求得,为1.011,-1.505 和0.749,代入式(15)可得反应的动力学方程为
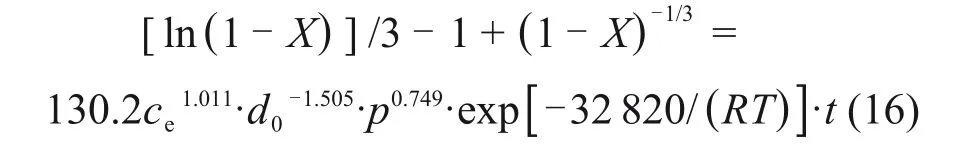
3 结论
1) 在液固比为10 mL/g,温度为90 ℃,窑渣粒径为53~75 μm,搅拌转速为400 r/min,氧分压为0.5 MPa,反应时间为3 h 条件下进行污酸浸出窑渣中铜的实验,铜的浸出率达到95.05%,浸出渣中的铜质量分数由1.47%下降至0.10%,铁和锌的浸出率分别达85.69%和82.95%。窑渣中的铜、铁、锌均能被污酸高效浸出。
2)窑渣中的CuFeS2和CuS 等铜物相都被污酸溶解,浸出渣中的主要物相为CaSO4·2H2O,SiO2和焦炭,银质量分数达427.9 g/t,可作为提银原料。浸出液中的As 富集,质量浓度达8.76 g/L,Fe2+质量浓度达18.6 g/L,后续可利用常压合成臭葱石法进行处理。
3)污酸浸出窑渣过程中铜的浸出符合固体产物层内扩散和界面化学反应混合控制模型,动力学方程ln(1-X)/3-1+(1-X)-1/3=130.2ce1.011·d0-1.505·p0.749·exp[-32 820/(RT)]·t,表观活化能为-32.82 kJ/mol。氧分压、液固比和粒径对窑渣中铜的浸出有较大影响,提升体系的氧分压、扩大液固比及减小窑渣粒径能有效提高铜的浸出速率。
