巴戟天内生真菌Cytospora rhizophorae中ProL蛋白的表达纯化及性质分析
2020-07-16孔亚丽李赛妮朱牧孜钟国华章卫民
孔亚丽,叶 伟,李赛妮,朱牧孜,钟国华,章卫民
(1 华南农业大学 农学院/ 农业农村部华南作物有害生物综合防治重点实验室/天然农药与化学生物学教育部重点实验室,广东 广州 510642; 2 广东省科学院 广东省微生物研究所/华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室,广东 广州 510070)
二苯甲酮类化合物广泛应用于工业、农业和医药等领域,如:在工业方面可作为紫外线吸收剂、UV涂料、染料等的中间体[1-2];二苯甲酮类杀菌剂氟吗啉、丁吡吗啉、苯菌酮等已广泛应用于农业[3-4];在医药方面可作为酮基布洛芬、安定、苯海拉明、双环己哌啶等药物的中间体或原料[5];此外,二苯甲酮类化合物还可应用于香水、食用香精中,能使空气更加清新,食物变得香甜可口。天然的二苯甲酮类化合物一般存在于鸢尾科、藤黄科、樟科、桑科、蔷薇科、瑞香科、桃金娘科等植物中并具有一些特殊结构和功能,它是生物体内合成酮的中间体[6],并且不少天然的二苯甲酮类化合物具有抗菌、细胞毒和神经保护等生物活性, 因此具有开发成为抗菌剂的潜力。例如,从藤黄Garcinia cowa叶中分离获得的聚异戊二烯二苯甲酮化合物Chamuangone对化脓性链球菌有较强的抗菌活性(MIC值为7.8 μg/mL)[7];从Clusia burlemarxii树干中分离获得的聚异戊二烯基二苯甲酮衍生物 Burlemarxione A和Sampsonine N对人胶质母细胞瘤GL15具有很强的体外细胞毒活性[8];从知母A n e m a r r h e n a asphodeloides须根中分离获得的二苯甲酮新化合物 Methyl 2-[2, 4-dihydroxy-3-(4-hydroxybenzoyl)-6-methoxypheyl]acetate对H2O2诱导的SH-SY5Y神经细胞损伤具有保护作用[9]。另外,从内生真菌中也分离获得了具有生物活性的二苯甲酮类化合物,如从红树林内生真菌Penicillium citrinumHL-5126中分离获得的氯代二苯甲酮化合物Penibenzophenones A具有抗金黄色葡萄球菌的活性(MIC值为20 μg/mL)[10];从1株软珊瑚来源的真菌Pestalotiopsissp.中分离得到的氯代二苯甲酮类化合物Pestalachloride F具有抗藤壶Balanus amphitrite幼虫附着活性,其EC50值为0.55 μg/mL,且毒性功效比值(LC50/EC50)大于15,具有开发成为安全高效海洋防污剂的潜能[11]。
已有研究从巴戟天Morinda officinalis内生真菌Cytospora rhizophoraeA761的发酵粗提物中分离得到二苯甲酮类新骨架分子Cytorhizins A~D,其具有细胞毒活性,是自然界中非常罕见的一类高度氧化的新骨架天然产物[12]。广东省微生物研究所药用真菌组前期对该菌株的基因组和转录组进行了测序,根据测序结果预测了二苯甲酮类化合物的生物合成相关基因簇及其关键生物合成基因proL。本研究旨在克隆proL基因,并对ProL蛋白进行表达和纯化,以获得高纯度的ProL蛋白,运用生物信息学方法推测该蛋白的结构和功能,为解析ProL在合成Cytorhizins类新骨架活性化合物途径中的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 菌株:巴戟天内生真菌C.rhizophoraeA761(基因登录号:KU529867.1)于2015年从广东省高要市采集的巴戟天中分离得到。
试剂:DNA提取试剂盒(美基生物科技有限公司,广州),DNA胶纯化回收试剂盒和快速质粒小提试剂盒(天根生化试剂公司,北京),限制性内切酶NdeI、HindⅢ(Thermo,北京),2×HiffeTaqmaster mix(Yeasen,上海),截留相对分子质量为50 000的透析袋(光谱医学,美国),pET28a质粒(淼灵生物科技有限公司,武汉),Trans5α和BL21(DE3)感受态细胞(全式金生物技术有限公司,北京),One-step ClonTing Kit(Yeasen,上海)。复性液母液 (1 L):50 mmol/L Tris-HCl,0.4 mol/LL-Arg,0.4 mmol/L GSSG,2 mmol/L GSH,体积分数为 10% 的甘油,10 mmol/L CaCl2。
1.1.2 仪器 梯度 PCR 仪 (天根生化试剂公司,北京),凝胶成像仪(Oxoid,英格兰),电热恒温培养箱(Oxoid,英国),细胞超声破碎仪 (Sonics,美国),台式微量离心机(Yeason,上海),台式高速冷冻离心机SIGMA3-30KS(Sartorius,德国),酶标仪 (Thermo,美国),5 mL HisTrap HP(GE 公司,美国),5 mL HiPrep Desalting(GE公司,美国),蛋白纯化仪(通用电气医疗集团,瑞典),核酸检测仪(基因有限公司,香港)。
1.2 方法
1.2.1 目的基因扩增及原核表达载体的构建 根据前期菌株A761的转录组测序结果获得的目的基因proL的序列,在计算机软件SnapGene2.3.2的辅助下,设计含有同源臂的特异性引物,引物序列为proL-F:5′-ACTTTAAGAAGGAGATATACATGGCT ACACCAGGACTAATTCCAC-3′,proL-R:5′-GTGGTGGTGGTGGTGGTGCTCAAACAGCCGTC TTGGATTATCAC -3′,引物由广州天一辉远公司合成。以基因组为模板,利用PCR扩增目的基因proL,反应体系 50 μL:proL-F 0.5 μL,proL-R 0.5 μL,基因组 1 μL,2×Taqmaster mix 25 μL,ddH2O 23 μL。PCR 程序:94 ℃ 预变性 5 min;94 ℃ 变性 30 s,55 ℃退火 30 s,72 ℃ 延伸 30 s,35 个循环;最后 72 ℃ 延伸10 min。用限制性内切酶NdeI、HindⅢ双酶切质粒 pET28a,37 ℃ 孵育 3 h。双酶切反应体系 30 μL:pET28a 7 μL,NdeI 1.5 μL,HindⅢ 1.5 μL,FD buffer 3 μL,ddH2O 17 μL。用同源重组酶将 PCR 产物连接至双酶切的pET28a载体,构建ProL蛋白原核表达载体。转化至Trans5α感受态细胞,用含硫酸卡那霉素的LB平板筛选,菌液PCR筛选阳性克隆,PCR产物用10 g/L DNA琼脂糖凝胶电泳鉴定、纯化回收、测定其浓度和纯度。将阳性克隆子扩大培养,提取质粒进行测序鉴定。测序由广州天一辉远公司完成。
根据测序结果,克隆的DNA片段中含有内含子,需要进一步去除内含子以获取完整的编码序列。于是利用同源重组的方法去除内含子,在 pET28a-proL 上设计 2对引物 proL2-F :5′-TTTGAGTGAGCTGATACCGCTCGCC-3′,proL2-R:5′- TGCGGCCAATCTGATCCGTACAGTATCCT CTCCGG-3′; proL3-F:5′- TACGGATCAGATTGGCC GCATACCCAGCT-3′,proL3-R:5′-GCGGTATCA GCTCACTCAAAGGCGG-3′。利用重叠延伸PCR技术[13]将2对引物扩增的片段整合在一起,进而将内含子去除,获取不含内含子的表达载体pET28aproL,并进行扩增proL片段验证和测序结果比对。
1.2.2 ProL 蛋白原核表达 将测序结果与NCBI中proL原始序列完全一致的pET28aproL质粒转入大肠埃希菌BL21(DE3)感受态细胞中,挑取抗性LB平板筛选的阳性克隆接种于含50 μg/mL硫酸卡那霉素的LB液体培养基,37 ℃、180 r/min过夜培养,按体积分数为1%的接种量接种于含 50 μg/mL 硫酸卡那霉素的 200 mL LB 液体培养基中,37 ℃、180 r/min 培养 2~3 h 至D600nm为0.4~0.6,IPTG 诱导至终浓度为 0.5 mmol/L,37 ℃和25 ℃条件下培养菌体至D600nm为1.2左右,4 ℃、8 500 r/min 收集菌体进行超声破碎,分别取未诱导的全菌、诱导后的上清、诱导后的沉淀样品用SDS-PAGE电泳鉴定[14]。
1.2.3 ProL 蛋白的复性纯化 采用“1.2.2”中IPTG诱导蛋白表达的方法,同样条件下大量诱导。沉淀用包涵体提取液(8 mol/L尿素+复性液母液)溶解,然后依次用含 4、2、1、0 mol/L 尿素的复性液及20 mmol/L PBS缓冲液在截留相对分子质量为50 000的透析袋中4 ℃条件下透析复性12 h,将透析后的上清用0.22 μm滤膜过滤,使用5 mL HisTrap HP 柱纯化得到目的蛋白:采用 Buffer A(20 mmol/L PBS、0.5 mol/L NaCl、20 mmol/L 咪唑)平衡层析柱,再用体积分数为10%、30%和60% 的 Buffer B(20 mmol/L PBS、0.5 mol/L NaCl、0.5 mol/L咪唑)梯度洗脱目的蛋白。收集洗脱峰,SDS-PAGE电泳分析目的蛋白。使用超微量核酸检测仪测定蛋白浓度,用 5 mL HiPrep Desalting 脱盐柱和缓冲液 Buffer Store(20 mmol/L PBS、0.5 mol/L NaCl、体积分数为20%的甘油)将纯化的ProL蛋白中的咪唑洗脱,收集咪唑的洗脱峰,SDS-PAGE电泳分析脱盐的目的蛋白,使用BandScan 5.0分析蛋白纯度。将目的蛋白切胶,送广州辉骏生物科技有限公司进行质谱鉴定,再将ProL氨基酸序列上传至Uniprot的数据库中,最后将质谱测序结果在数据库中进行高级检索和氨基酸比对。
1.2.4 ProL 蛋白生物信息学分析 在 NCBI数据库中对ProL蛋白的氨基酸序列进行Blastp比对,使用软件MEGA6.06,采用邻接法(Neighborjoining,NJ)对相似度高的已知的8个菌株的氨基酸序列和ProL氨基酸序列构建蛋白进化树。使用Protein软件预测蛋白质的基本特性。利用ExPASy Proteomics Server在线软件 Protparam(http://www.cn.expasy.org/tools/protparm. html)对 ProL 蛋白进行理化性质预测分析,运用PredictProtein(http://www.predictprotein)预测proL基因编码的蛋白质二级结构,最后以[4d8l.1.A]蛋白的3D结构为模板,分别在Swiss-Model(http://swissmodel.expasy.org/)和Discovery Studio 2.5软件上进行蛋白的三维结构预测和分析。
2 结果与分析
2.1 目的基因片段的获取及表达载体的构建
提取内生真菌C.rhizophoraeA761 的基因组,用proL-F和proL-R引物扩增目的基因,扩增得到1条与目的基因大小一致的核酸片段(GenBank登录号:MN180086)(图1A)。限制性内切酶NdeI和HindⅢ双酶切载体pET28a。利用同源重组将纯化的PCR产物连接至纯化的双酶切pET28a载体中,构建原核表达载体pET28a-proL。菌液PCR结果初步验证proL基因成功插入至pET28a质粒(图1B)。测序结果显示,克隆的DNA片段中包含了75 bp的内含子,需要进一步去除内含子以获取完整的编码序列。
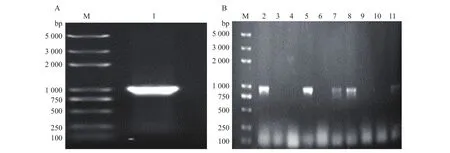
图1 目的基因proL的PCR验证Fig. 1 Verification of target gene proL by PCR
利用同源重组的方法成功去除内含子。10 g/L琼脂糖凝胶电泳结果显示,用引物proL2-F和proL2-R扩增得到片段1,用引物proL3-F和proL3-R扩增得到片段2(图2A)。将片段1和2融合在一起后,扩增得到大小约1 000 bp的片段(图2B)。经测序比对,确定为909 bp的proL目的基因条带,成功构建表达载体pET28a-proL。
2.2 ProL蛋白相似性及同源性分析
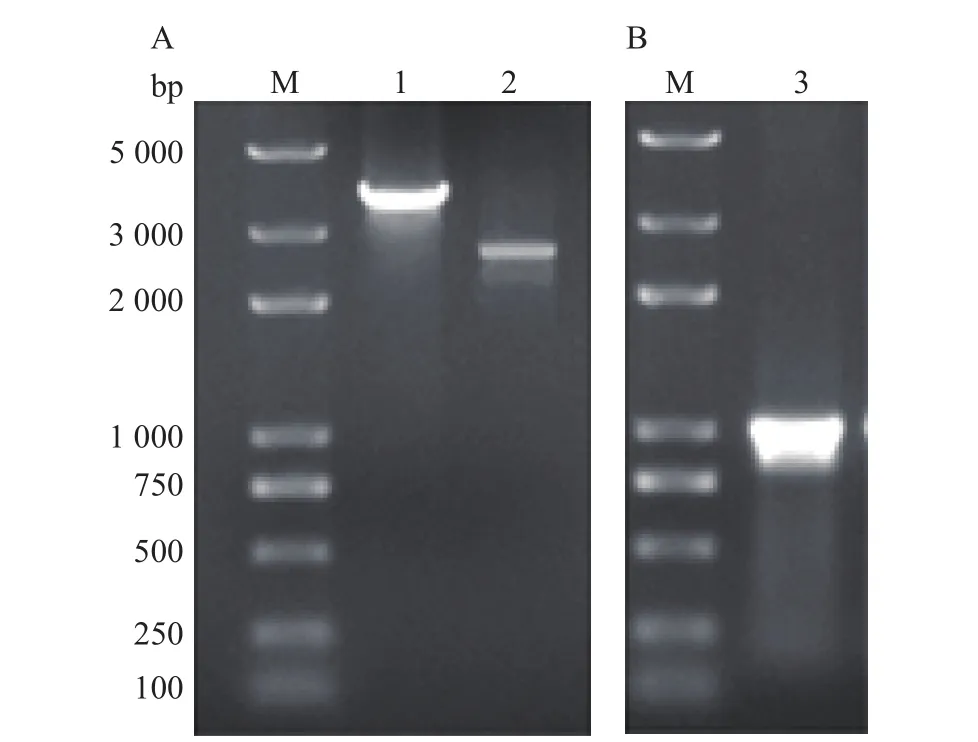
图2 无内含子的pET28a-proL重组质粒构建Fig. 2 Construction of pET28a-proL recombinant plasmids with intron excision
在NCBI数据库中对ProL蛋白的氨基酸序列进行Blastp比对,结果显示与C. rhizophoraeA761 KU529867.1的ProL相似度高的蛋白主要是未知蛋白和水解酶,水解酶中包括酰胺水解酶2,2−吡喃酮−4,6−二羧酸内酯酶等。根据氨基酸比对结果,其中相似度最高的是Aspergillus ibericusXP025570169.1的酰胺水解酶2,其相似性为59.40%;与A. sclerotionigerXP 025461827.1 和A.sclerotiicarbonariusPY101400.1 的酰胺水解酶 2、Rasamsonia emersoniiXP 013330163.1 的 2−吡喃酮−4,6−二羧酸内酯酶、A. vadensisXP 025558746.1和A. costaricaensisXP 025542599.1 的酰胺水解酶2、A. awamoriGCB25411.1 的 4−磺基内酯水解酶以及A. piperisXP025511999.1的酰胺水解酶2也具有较高的相似性,相似性分别为59.06%、59.40%、57.86%、57.72%、57.72%、57.72%和57.02%。使用MEGA6.06将ProL氨基酸序列和相似性高的8条已知菌株的氨基酸序列进行比对,发现其保守氨基酸序列为207~216位(图3),推测该范围可能是菌株A761的ProL氨基酸序列中酰胺水解酶的保守序列。根据选取的8条相似度高的氨基酸序列比对结果和亲缘关系,这些水解酶聚为3支:Aspergillusspp. 酰胺水解酶 2、R. emersonii的 2−吡喃酮−4,6−二羧酸内酯酶类和C. rhizophorae的ProL蛋白。ProL蛋白与进化树中的另外2类蛋白分支较远,提示该蛋白较为新颖(图4)。
2.3 重组蛋白表达及复性
将构建成功的重组质粒转化至大肠埃希菌BL21(DE3),IPTG诱导表达,结果表明经IPTG诱导后泳道3和5检测到与目的蛋白(相对分子质量为33 800)大小一致的条带,而未诱导的全菌样品和诱导的上清泳道中没有目的条带(图5A),说明ProL蛋白均在包涵体中表达,在25 ℃、0.5 mmol/L IPTG诱导条件下,ProL蛋白表达量较高。经过尿素梯度复性,5 mL HisTrap HP 纯化、5 mL HiPrep Desalting脱盐,得到ProL蛋白,使用BandScan 5.0分析蛋白纯度,其纯度最高为95.1%,复性后的ProL蛋白纯度最高为98.9%(图5B、5C),说明该方法纯化ProL蛋白效果较好。

图3 水解酶序列相似性分析Fig. 3 The similarity analysis of hydrolases sequence
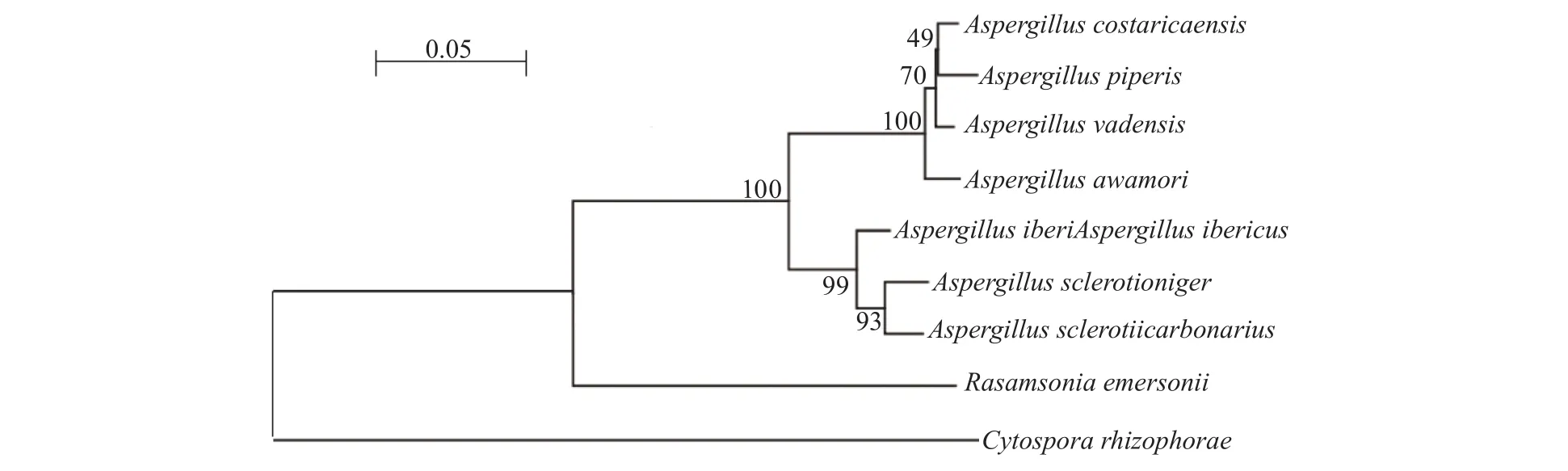
图4 基于水解酶序列的真菌系统进化树Fig. 4 Phylogenetic tree of fungi based on their hydrolase sequences
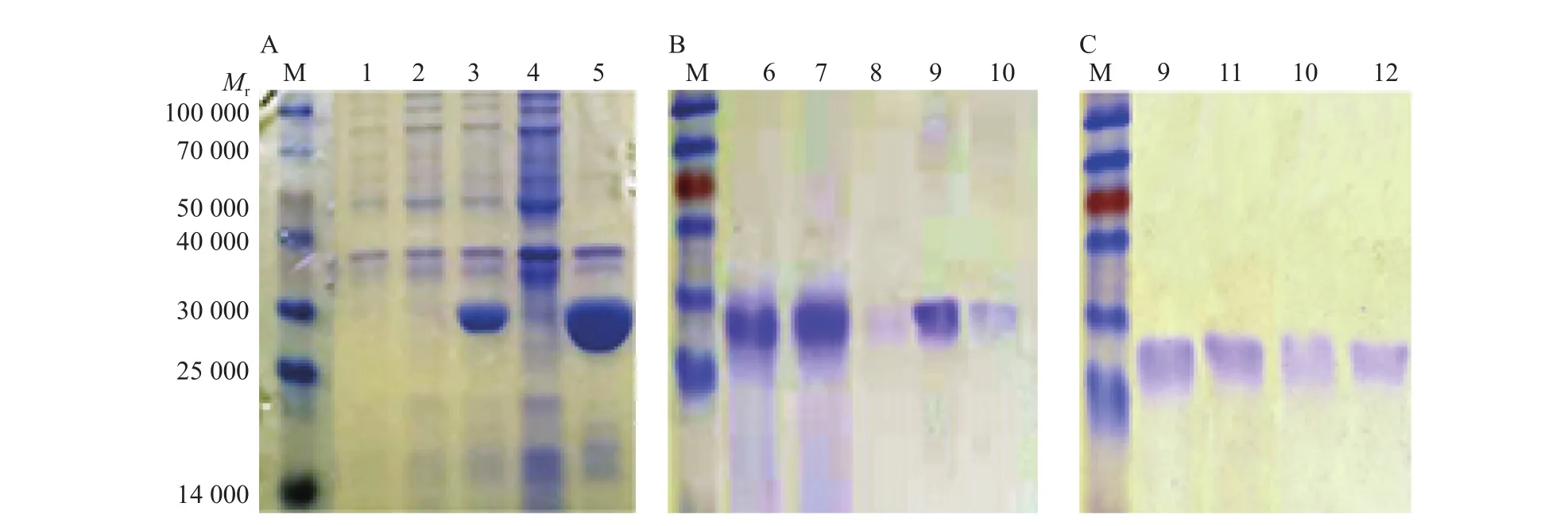
图5 ProL蛋白的表达纯化Fig. 5 Expression and purification of ProL protein
2.4 质谱鉴定结果与分析
对纯化后的ProL蛋白进行质谱分析,在Uniprot数据库中的序列比对结果表明ProL氨基酸序列(图6)与转录组测序分析结果一致,再次验证了纯化复性的目的蛋白是ProL蛋白。
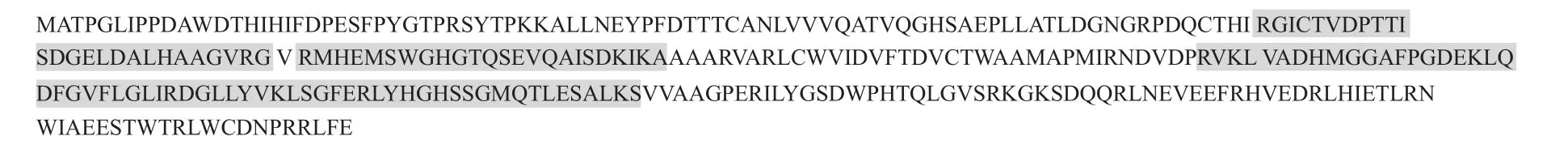
图6 ProL蛋白质谱测序结果Fig. 6 Mass spectrometry sequencing results of ProL protein
2.5 proL基因编码蛋白特性分析
利用软件Protparam对ProL蛋白进行理化性质预测分析,预测其分子式为C1495H2320N424O444S13,相对分子质量为 33 754.22,原子数为 4 696,氨基酸数目为303,负电残基(Asp+Glu)为40,正电残基(Arg+Lys)为30,等电点为5.69,为酸性蛋白。在哺乳动物中其半衰期为30 h,在酵母、大肠埃希菌中分别大于20 和10 h。该蛋白是稳定的蛋白,其不稳定系数是35.72。对ProL蛋白的氨基酸亲疏水性进行分析,其脂肪系数为82.08,平均疏水指数(GRAVY)为−0.297,因此,预测该蛋白是亲水性蛋白。利用PredictProtein在线平台预测了proL基因编码的蛋白质二级结构,其中α−螺旋结构占总氨基酸的34.7%,其他结构占总氨基酸的65.4%。使用Swiss-Model软件预测ProL蛋白的三维结构,预测其保守氨基酸序列为207~216位,成熟的ProL蛋白含有8个α−螺旋,8 个β−折叠 (图 7)。用 Discovery studio 2.5 对该蛋白进行底物结合口袋分析,结果表明其活性氨基酸位点主要为 Glu210、Arg211 和 His 216,其中Arg211 和 His 216 带正电荷,提供质子,Glu210带负电荷,接收质子,形成底物结合口袋。
根据ProL蛋白理化性质分析及其功能预测,其功能是在生成高度氧化的二苯甲酮类化合物途径中起水解作用,由此推测二苯甲酮类化合物的生物合成途径(图8)为:7个乙酰辅酶A在聚酮合酶的催化下通过聚合、克莱森等反应生成Endocrocinanthrone前体,而后在单加氧酶催化下氧化脱羧生成Emodin前体,接着氧化生成1,2,3,8-tetrahydroxy-6-methylanthracene-9,10-dione,再氧化生成1,8,9,10-tetrahydroxy-3-methyldibenzo[b,e]oxepine-6,11-dione,最后在ProL的催化下水解生成 Cytorhizins A~D 的前体 Cytosporaphenone A[15]。
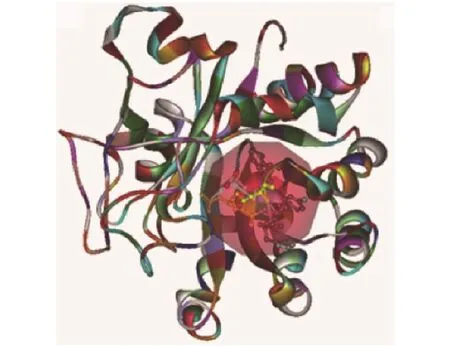
图7 ProL蛋白三维结构预测Fig. 7 Predicted 3D structure of ProL protein
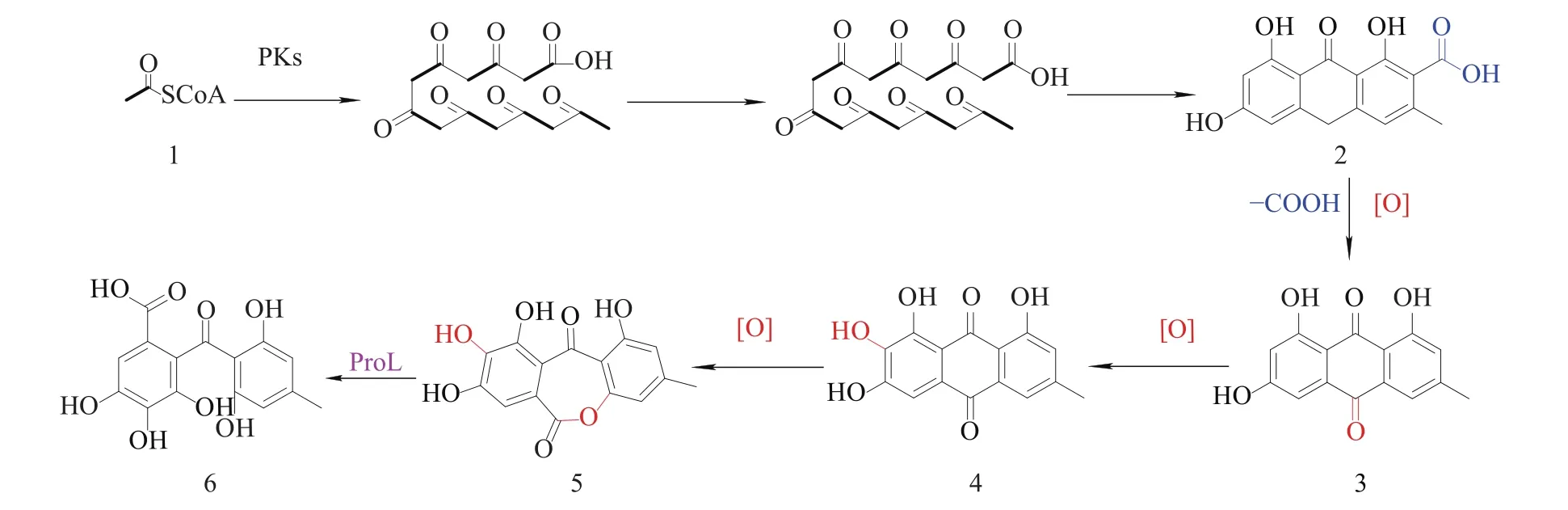
图8 Cytospora rhizophorae A761中二苯甲酮类化合物生物合成途径预测Fig. 8 Prediction of the biosynthesis pathway of benzophenones in Cytospora rhizophorae A761
3 讨论与结论
proL基因编码的2−吡喃酮−4,6−二羧酸内酯酶,属于酰胺水解酶超家族。ProL对底物的作用主要是酰胺键或酯键的水解、核酸的脱氨、异构化和脱羧反应[16-17]。Maruyama等[18]从假单胞菌Pseudomonas ochraceaeNGJ1中克隆得到proL基因的DNA片段,并在大肠埃希菌中进行过表达,经鉴定该proL基因是原儿茶酸4,5−裂解途径中关键操纵子之一;Hobbs等[19]对少动鞘脂氨醇单胞菌Sphingomonas paucimobilis中的proL基因进行了异源表达,并且ProL在木质素的降解途径中催化2−吡喃酮4,6−二羧酸酯可逆水解为4−草酰胺基甲酸酯和4−羧基−2−羟基粘康酸酯。本文对从植物内生真菌C. rhizophoraeA761中新颖的二苯甲酮类化合物生物合成基因proL进行表达和理化性质分析,对proL基因进行克隆表达,扩增得到909 bp的proL基因片段,并成功构建了表达载体pET28aproL,将其导入大肠埃希菌中进行异源表达,利用尿素梯度复性对ProL蛋白进行复性并纯化,其纯度高达98.9%。在NCBI数据库中通过序列比对和系统进化树分析,推测ProL为一种新颖的酰胺水解酶,其功能是在生成高度氧化的二苯甲酮类化合物途径中起水解作用。本文结果将为后续ProL蛋白生物学功能的研究、内生真菌C. rhizophoraeA761中高度氧化的二苯甲酮类化合物生物合成机制的解析以及新型二苯甲酮类活性先导化合物的挖掘提供参考,并为将ProL蛋白应用于医药和植物源农药的研发奠定初步基础。
