托法替尼对大鼠实验性自身免疫性脑脊髓炎的抑制作用及其机制*
2020-07-15李玲李作孝
李玲,李作孝
(西南医科大学附属医院神经内科,泸州 646000)
多发性硬化(multiple sclerosis,MS)是中枢神经系统(central nervous system,CNS)自身免疫性疾病,该病以炎症细胞浸润、白质炎性脱髓鞘、轴突变性、胶质细胞增生为病理特点[1]。其发病机制复杂,至今尚未明确。研究表明,MS发生发展与细胞内多条信号通路异常有关,而Janus激酶-信号转导子和转录激活子(Janus kinase-signal transducer and activator of transcrip-tion,JAK-STAT)信号通路异常对 MS发病有着重要作用[2]。托法替尼(tofacitinib)是一种新型JAK抑制剂,可通过阻断JAK-STAT信号通路进而抑制异常免疫反应。目前托法替尼已被批准为治疗类风湿关节炎的临床用药[3],除此之外,该药对其他多种免疫性疾病,如炎症性肠病(inflammatory bowel disease,IBD)、银屑病、肾移植排斥反应等均显示明显治疗作用[4-5],但托法替尼用于治疗MS的报道笔者较少见到。笔者在本实验采用托法替尼干预实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠模型,观察托法替尼对EAE是否具有脑保护作用,并探讨相关作用机制,以期为托法替尼治疗MS奠定实验基础。
1 材料与方法
1.1实验动物 清洁级健康豚鼠,体质量0.25~0.3 kg;Wistar雌性大鼠,体质量0.2~0.25 kg。均购于西南医科大学实验动物中心,实验动物使用许可证号:SYXK(川)2013-181。饲养温度约24 ℃,饲养相对湿度约50%。
1.2试药 托法替尼(美国辉瑞公司,批号:H20170121);完全福氏佐剂(complete Freud's adjuvant,CFA,美国Sigma公司,批号:Lot#SLBW5971);百日咳毒素(pertussis toxin,PTX,上海雅吉生物科技有限公司,批号:20180109);鼠抗髓鞘碱性蛋白(myelin basic protein,MBP)抗体(1:200,上海安研生物试剂销售公司,批号:20180120);兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(1:160,上海安研生物试剂销售公司,批号:20180211); 链霉菌抗生物素蛋白-过氧化物酶连接法(streptavidin-perosidase,SP)免疫组化试剂盒(武汉博士德生物技术公司,批号:20180204);多聚甲醛。
1.3方法
1.3.1免疫抗原的制备 苯巴比妥 100 mg·kg-1致豚鼠死亡,无菌条件下迅速分离脊髓,除去脊膜,称重后移入玻璃匀浆器,与等量0 ℃、0.9%氯化钠溶液混合后研磨成50%全脊髓匀浆(whole spinal cord homogenate,WSCH)。CFA与WSCH等体积混合,玻璃注射器抽打至油包水乳状,以滴在水面5 min不散为合格抗原。
1.3.2模型的制备与动物分组 取Wistar雌性大鼠50只,采用完全随机法分为正常对照组、模型对照组及托法替尼小、中、大剂量组,每组10只。模型对照组及托法替尼小、中、大剂量组大鼠双侧后肢足掌皮下注入MBP与CFA,0.2 mL·(100 g)-1,建立模型;正常对照组注入等量无菌0.9%氯化钠溶液与CFA[6]。建模后当天及第2天,将PTX注入各组大鼠腹腔,每只0.2 mL,加强免疫反应。
1.3.3模型的干预 托法替尼小、中、大剂量组自造模前3 d开始连续10 d分别灌胃托法替尼1,2,4 mg·kg-1·d-1,正常对照组和模型对照组灌胃等容量0.9%氯化钠溶液。
1.3.4模型的评价 由同一人自建模后每天上午评判大鼠临床表现及神经功能障碍评分(neurological dysfunction score,NDS)。评分标准:无临床症状为0分;尾部瘫痪拖地,轻度后肢无力为1分;中度单侧后肢或双侧后肢无力为2分;重度双侧后肢无力为3分;四肢全瘫、大小便失禁为4分;抽搐、濒死或死亡为5分[7]。
1.3.5实验终止 在发病高峰期(症状评分连续3 d无加重、四肢全瘫或死亡)处死大鼠,未发病大鼠饲养8周后处死。
1.3.6神经病理组织的制备 无菌条件下,组织剪剖开大鼠头顶部皮肤,暴露枕骨大孔及顶骨,沿枕骨大孔用镊子去除颅盖骨,暴露脑组织,磷酸盐缓冲液(PBS)反复冲洗除去血迹后轻柔取出。将脑组织在4%多聚甲醛液中固定48 h,分别予70%,80%,95%梯度乙醇及无水乙醇脱水,送我院病理教研室做脑组织苏木精-伊红(hematoxylin-eosin staining,HE)染色及脑组织免疫组化染色检查。
1.3.7脑组织病理学观察 脑组织经脱水、透明、浸蜡及石蜡包埋后,取厚度10 μm连续矢状位行石蜡切片,每间隔100 μm取片l张。经烘干、脱蜡后行脑组织HE染色、观察CNS炎症细胞浸润程度。
1.3.8脑组织髓鞘脱失、星型胶质细胞活化情况检测 脑组织石蜡切片经常规脱蜡、水化、修复、0.3%过氧化氢(H2O2)溶液去除过氧化物酶活性、山羊血清封闭组织蛋白后,逐次滴加1:200鼠抗MBP单克隆抗体及1:160兔抗GFAP多克隆抗体恒温孵育60 min,加入二抗孵育及链霉素卵白素孵育,常规二氨基联苯氨(diamine bezidin,DAB)显色、复染、脱水、透明、封片。采用ImagePr-Plus5.1图像分析系统测定MBP免疫组化阳性面积,GFAP免疫组化染色切片随机选取5个高倍视野(×400),对阳性表达的胞计细数,求其平均值。采用cM0s多功能真彩色病理图象分析系统对免疫组化染色进行定量分析,测定MBP免疫组化阳性表达、GFAP阳性细胞的平均吸光度值积分(IA)。

2 结果
2.1大鼠发病情况 模型对照组与托法替尼各剂量组潜伏期、进展期及NDS均差异有统计学意义(均P<0.01),托法替尼各剂量组间比较,除大、中剂量组NDS差异无统计学意义,其余均差异有统计学意义(P<0.01,P<0.05),见表1。
表1 4组大鼠发病情况比较


组别潜伏期进展期dNDS/分模型对照组10.20±1.9910.50±1.843.80±1.03托法替尼 小剂量组16.70±1.50①8.00±2.00①2.30±1.34① 中剂量组20.20±2.44①②5.60±1.51①②1.20±1.40①③ 大剂量组22.90±1.79①②④3.00±1.16①②④0.60±0.84①②F78.4837.6214.31P<0.01<0.01<0.01
①与模型对照组比较,P<0.01;②与托法替尼小剂量组比较,P<0.01;③与托法替尼小剂量组比较,P<0.05;④与托法替尼中剂量组比较,P<0.01。
①Compared with model control group,P<0.01;②compared with low-dose tofacitinib group,P<0.01;③compared with low-dose tofacitinib group,P<0.05;④compared with medium-dose tofacitinib group,P<0.01.
2.2大鼠脑组织病理学变化 模型对照组及托法替尼各剂量组病理评分均差异有统计学意义(P<0.01或P<0.05),见表2,图1。
表2 4组大鼠脑组织HE染色病理评分


组别HE染色病理评分/分模型对照组3.30±0.68托法替尼 小剂量组 2.50±0.85① 中剂量组1.50±0.97②③ 大剂量组0.70±0.68②③④F20.07P<0.01
①与模型对照组比较,P<0.05;②与模型对照组比较,P<0.01;③与托法替尼小剂量组比较,P<0.01;④与托法替尼中剂量组比较,P<0.05。
①Compared with model control group,P<0.05;②compared with model control group,P<0.01;③compared with low-dose tofacitinib group,P<0.01;④compared with medium-dose tofacitinib group,P<0.05.
2.3大鼠脑组织脱髓鞘及星型胶质细胞活化情况 模型对照组与托法替尼各剂量组脑组织MBP阳性表达平均A值、GFAP阳性细胞平均A值均差异有统计学意义 (均P<0.01),见表3~4。
3 讨论
笔者在本实验选用雌性 Wistar大鼠建立EAE模型,EAE大鼠在免疫后逐渐出现精神萎靡、活动减少、食量和体质量下降,在发病高峰期出现尾部拖地,前后肢瘫痪,抽搐甚至死亡。其脑组织HE染色结果显示大量炎症细胞浸润并在血管周围形成典型的“袖套样”炎症细胞结构。所以从EAE大鼠的临床表现及脑组织的病理学改变,可以确定本实验EAE动物模型诱导成功。
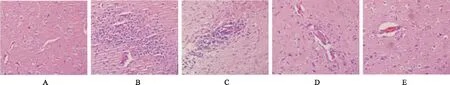
A.正常对照组;B.模型对照组;C.托法替尼小剂量组;D.托法替尼中剂量组;E.托法替尼大剂量组。
A.normal control group;B.model control group;C.low-dose tofacitinib group;D.median-dose tofacitinib group;E.high-dose tofacitinib group.
Fig.1HEstainingonthebrainsinfivegroupsofrats(×400)
表3 5组大鼠脑组织MBP阳性表达平均A值


组别MBP阳性表达平均A值/(×10-2)正常对照组13.33±0.33模型对照组4.34±0.32①托法替尼 小剂量组5.01±0.34①② 中剂量组8.44±0.20①②③ 大剂量组11.60±0.30①②③④F1712.56P<0.01
①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与托法替尼小剂量组比较,P<0.01;④与托法替尼中剂量组比较,P<0.01。
①Compared with normal control group,P<0.01;②compared with model control group,P<0.01;③compared with low-dose tofacitinib group,P<0.01;④compared with medium-dose tofacitinib group,P<0.01.
表4 4组大鼠脑组织GFAP阳性细胞平均A值


组别GFAP阳性细胞平均A值/(×10-2)模型对照组16.66±0.23托法替尼 小剂量组13.12±0.28① 中剂量组11.24±0.29①② 大剂量组9.18±0.30①②③F1339.83P<0.01
①与模型对照组比较,P<0.01;②与托法替尼小剂量组比较,P<0.01;③与托法替尼中剂量组比较,P<0.01。
①Compared with model control group,P<0.01;②compared with low-dose tofacitinib group,P<0.01;③compared with medium-dose tofacitinib group,P<0.01.


星型胶质细胞在脑内分布非常广泛,并参与BBB的构成[17]。当在脑组织受到自身抗体刺激后,星型胶质细胞成为最先受损的脑细胞,可先于反应性小胶质细胞和巨噬细胞表达免疫炎症细胞递质(如肿瘤坏死因子、干扰素、白细胞介素等),启动免疫级联反应,释放细胞因子,趋化炎症细胞边集并穿过内皮细胞,诱发中枢神经系统炎症反应[18]。星型胶质细胞的活化是EAE重要的发病机制之一。GFAP是星型胶质细胞分化的重要标记物,其过度表达标志着组织损伤后星型胶质细胞的增生[19]。研究发现,GFAP基因敲除小鼠EAE症状较野生型症状明显加重[20]。本研究显示,模型对照组大鼠脑组织星型胶质细胞活化明显;而托法替尼各剂量组脑组织GFAP阳性细胞平均A值较EAE组显著减少。提示托法替尼可有效抑制脑组织内星型胶质细胞活化。
总之,托法替尼对EAE大鼠具有脑保护作用,并呈剂量依赖关系。减轻脑组织炎性细胞浸润程度、减轻脑白质脱髓病变、抑制脑组织内星型胶质细胞活化可能是其作用机制之一。
