全细胞催化剂pelB-Xln-DT构建及其在水解三七皂苷R1中的应用
2020-07-14李琦童欣怡蒋玉洁裴建军赵林果
李琦,童欣怡,蒋玉洁,裴建军,赵林果*
(1. 南京林业大学江苏省林业资源高效加工利用协同创新中心,南京 210037;2. 南京林业大学化学工程学院,南京 210037)
生物酶作为一种绿色的生物催化剂,具有反应条件温和、专一性强、短时高效等优点,被广泛应用于工业催化转化及生物合成中。为提高生物酶的表达水平和降低酶的使用成本,利用基因重组技术构建基因工程菌是一种有效途径。大肠杆菌作为一种成熟的表达宿主,常被用作重组生物酶蛋白的首选表达系统。酶蛋白在大肠杆菌中有胞内、周质空间及胞外基质定位3种定位方式[1-2]。其中,胞内定位的重组蛋白极易形成包涵体,且无法进行蛋白质转录后修饰,大大降低了酶蛋白的可溶性表达[3]。为了实现重组酶蛋白的可溶性表达,常见的方式有引导酶蛋白在大肠杆菌周质空间定位,其原理是通过将目的基因与Mel、OmpA、pelB、PheA等信号肽融合后经转录翻译,从而能够引导重组酶蛋白至周质空间表达[4-5]。全细胞催化则是利用完整的生物有机体作为催化剂进行化学转化,其本质是利用细胞内的酶进行催化(介于发酵和体外酶催化法之间),不但具有发酵周期短、代谢产物简单、转化率高、酶的稳定性和适应性强等特点,且制备过程更加简单,生产成本更低,易于重复利用[6]。目前,已有多项全细胞催化技术被应用在工业合成过程中[7-8]。
人参皂苷是一种具有多种生理功能的天然活性物质,具有抗炎、抗肿瘤、抗疲劳、免疫调节等作用。不同的皂苷由于骨架和糖基的差异性而具有不同的生理活性。因此,酶法定向转化糖基化的皂苷成为了人们筛选获得具有更好药理活性化合物的有效手段。Pei等[9]利用来源于Thermotogathermarum的β-葡萄糖苷酶转化人参皂苷Re生成抗心血管疾病更强的人参皂苷Rg2。Li等[10]利用来源于DictyoglomusthermophilumDSM 3960的β-葡萄糖苷酶和β-木糖苷酶水解黄芪甲苷生成抗衰老活性更强的环黄芪醇。作为人参主要活性成分的Rg1,具有抗疲劳、提高免疫力等多种药理作用[11],可以从人参皂苷提取物中直接分离,但由于提取物中皂苷的种类众多,制备的难度增加。而三七总皂苷中的主要成分种类少,主要为二醇型皂苷Rb1、Rd和三醇型皂苷R1、Rg1,通过酶法转化三七皂苷R1生成人参皂苷Rg1可以大大提高Rg1的得率,且易于分离。
笔者成功构建了分泌融合表达型基因工程菌pelB-Xln-DT,并以此为全细胞催化剂进行三七皂苷R1的转化,探讨转化温度、转化时间、三七皂苷R1添加量、重复次数等因素对三七皂苷R1转化效率的影响,旨在为全细胞转化三七皂苷R1生产人参皂苷Rg1提供参考。
1 材料与方法
1.1 菌种、质粒及培养基
菌种及质粒:大肠杆菌Top10F’、BL21(DE3),重组质粒pET28a-xln-DT均由南京林业大学化学工程学院微生物技术研究室提供。pET20b表达载体购于美国Invitrogen公司。
溶菌肉汤(LB)培养基:每100 mL蒸馏水中加入蛋白胨1 g、酵母提取物0.5 g、NaCl 1 g,主要用于大肠杆菌菌种的活化及重组基因工程菌株的诱导表达。
1.2 酶和化学试剂
限制性内切酶EcoRV、XhoI、Ex taq聚合酶、T4 DNA连接酶、DL 5000 DNA Marker等购自日本TaKaRa生物公司;蛋白质分子量标准购自美国Promega公司;胰蛋白胨、酵母提取物购自英国Oxoid公司;对硝基苯基-β-L-木糖苷(pNPX)购自美国Sigma公司;凝胶回收试剂盒、质粒小提试剂盒、氨苄青霉素(Amp)、核酸染料等购自南京天为公司;其他常规试剂均为国产分析纯。引物合成及测序由上海生工生物工程股份有限公司完成。
1.3 主要仪器
日本TOMY SX-500全自动高温高压蒸汽灭菌锅,美国Life公司ABI verti PCR仪,德国Eppendorf公司5415R台式高速冷冻离心机,美国Bio-rad公司凝胶成像系统,美国Molecular Devices公司全波长酶标仪SpectraMax190。
1.4 重组质粒pET-20b-pelB-Xln-DT的构建
以嗜热菌D.thermophilumDSM 3960的GH39家族的β-木糖苷酶基因序列为模板,设计带有酶切位点的引物如下:F1(CCCGATATCATGAACCATATAAAGATTGAAA)和R1(CCGCTCGAGTTAATATCCACCTGGTATTTTGCT)。下划线部分分别为EcoRV、XhoI酶切位点。
将上下游引物用TE buffer缓冲溶液稀释成10 μmol/L工作液,对目的基因xln-DT进行PCR扩增。将扩增后的目的基因与表达载体pET-20b双酶切后连接,构建大肠杆菌重组质粒pET-20b-pelB-Xln-DT。将表达载体转化至大肠杆菌E.coliTop 10F’感受态细胞中,挑取单菌落接入到含有Amp抗性的LB培养基中过夜培养,筛选出阳性重组菌。
1.5 重组β-木糖苷酶Xln-DT的酶活测定、聚丙烯酰胺凝胶电泳及酶学性质分析
将筛选得到的阳性重组菌接种于LB培养基中诱导表达后,取1 mL培养物破胞后即为全细胞粗酶液,离心后上清即为上清粗酶液。将收集的全细胞粗酶液和上清粗酶液进行酶活测定和聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。以pNPX为底物,根据文献[12]的步骤进行酶活测定。SDS-PAGE试验方法参照《分子生物学实验指南》进行。
酶学性质分析:在pH 6.0的缓冲条件下,分别测定上清粗酶液在60,65,70,75,80,85和90 ℃下的酶活,以测定的最高酶活为100%计算相对酶活,最高酶活对应的温度即为酶的最适温度;将粗酶液在85 ℃下保温0,30,60,90和120 min,以未育温的粗酶液酶活为100%计算剩余酶活力,从而考察酶的温度稳定性;在最适温度下,分别测定粗酶液在pH 4.0,4.5,5.0,5.5,6.0,6.5和7.0下的酶活,以测定的最高酶活为100%计算相对酶活,最高酶活对应的pH即为酶的最适pH;在不含底物的条件下,将粗酶液置于不同pH(4.0~7.0)的缓冲液中,于4 ℃下过夜保存,在最适温度及最适pH下测定其残余酶活力,以未经pH缓冲液处理的粗酶酶活为相对100%,考察酶的pH稳定性。
1.6 全细胞催化剂pelB-Xln-DT的制备
将筛选得到的阳性重组菌接种于LB培养基中,转速180 r/min下,37 ℃过夜培养14 h,发酵液在8 000 r/min下离心10 min,菌体用蒸馏水洗涤2~3次后获得的湿菌体即为全细胞催化剂。
1.7 全细胞催化三七皂苷R1生成人参皂苷Rg1的条件优化
500 μL重悬全细胞催化剂(酶活1.0 U/mL)加入100 μL底物三七皂苷R1(终质量浓度为1 g/L),于37 ℃下(转速180 r/min)反应一定时间,结束后加入500 μL甲醇终止反应,离心后上清过0.22 μm滤膜后进行高效液相色谱(HPLC)测定产物和底物的含量。以生理盐水重悬菌体作为对照。
在上述试验方法的基础上,分别考察温度(20,28,32,37,42,45 ℃)、时间(1,2,3,4,5,12 h)、底物质量浓度(1,2,3,5,10 g/L)及重复次数(1,2,3,4,5,6,7,8,9,10)对全细胞催化生成人参皂苷Rg1得率的影响,每次试验设定一个变量。
1.8 三七皂苷R1和人参皂苷Rg1的HPLC分析
三七皂苷R1和人参皂苷Rg1采用HPLC进行检测。色谱柱为C18反向色谱柱(4.6×250 mm,填料颗粒直径5 μm);流动相为超纯水(A)和乙腈(B):梯度洗脱20%B 0~3 min,20%~60% B 3~28 min,28~29 min内VA∶VB从40∶60升至80∶20;流速0.4 mL/min,进样量5 μL,检测波长203 nm。标准曲线以底物质量浓度为横坐标,峰面积为纵坐标作图。R1的标准曲线方程为y=2 805.5x-35.267,R2=0.998 6,Rg1的标准曲线方程为y=2 902.2x+153.36,R2=0.996 6。R1的摩尔转化率见公式(1)。

(1)
式中:Ci为初始底物R1的质量浓度,g/L;Mi为R1的摩尔分子量,g/mol;Ct为产物Rg1在时间t时的质量浓度,g/L;Mt为Rg1的摩尔分子量,g/mol。
2 结果与分析
2.1 重组表达质粒pET-20b-pelB-Xln-DT的构建
根据已知的来源于嗜热菌D.thermophilumDSM 3960的xln-DT基因序列设计带有双酶切位点(EcoRV、XhoI)的特征性引物,PCR扩增出xln-DT基因片段,全长1 509 bp。该基因片段与载体pET-20b双酶切后连接构建重组质粒pET-20b-pelB-Xln-DT的流程见图1。由图1可知,构建的质粒引入了pelB信号肽,该信号肽可以引导蛋白分泌至大肠杆菌周质空间,从而提高外源蛋白的分泌表达效率。
表面缺陷指金属餐具表面的光洁度,光洁度主要反映在图像的灰度特征上[8],因此只需提取图像的灰度特征参数。
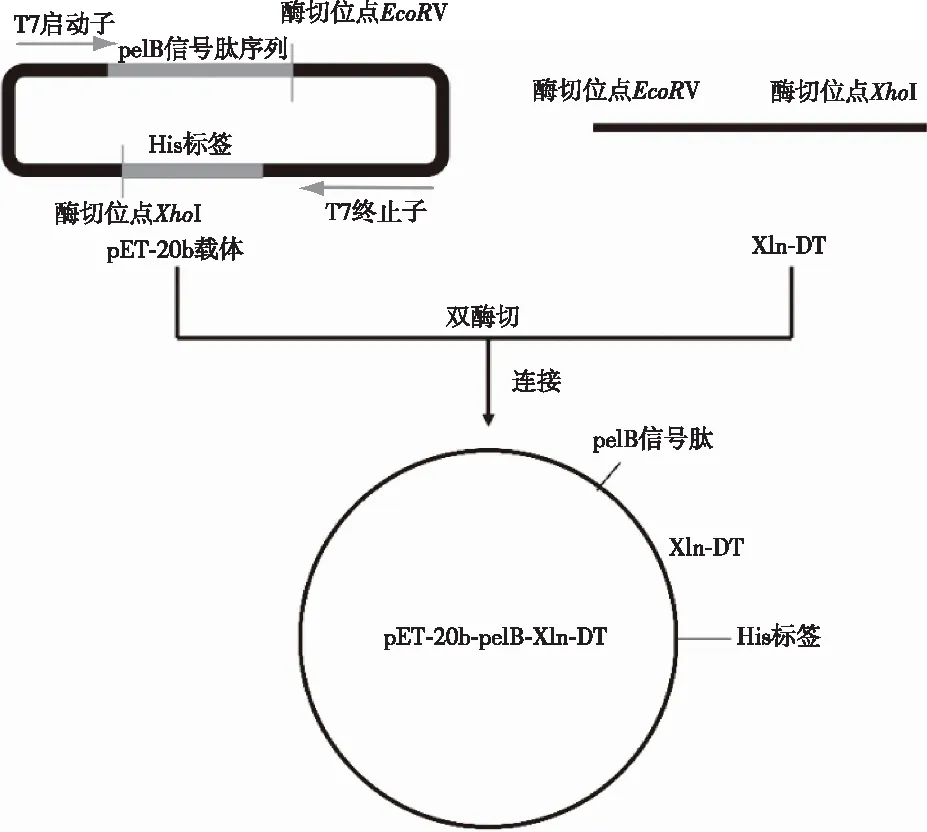
图1 重组质粒pET-20b-pelB-Xln-DT的构建流程图Fig. 1 Construction flow chart of recombinant plasmid pet-20b-pelb-Xln-DT
2.2 重组β-木糖苷酶pelB-Xln-DT的SDS-PAGE分析
经异苯基-β-D-硫代半乳糖苷(IPTG)诱导的重组菌BL21/pet28a-Xln-DT和BL21/pET-20b-pelB-Xln-DT各50 mL,调整培养物OD600至1.0,收集菌体离心后破碎获得粗酶液。再离心的上清粗酶液酶活分别为2.3和2.1 U/mL。SDS-PAGE电泳检测结果见图2。由图2可知,pet28a-Xln-DT和pET-20b-pelB-Xln-DT的分子量在55~70 kDa范围内,与预期的蛋白相对分子量大小一致(58.7 kDa),且引入pelB信号肽之后能够明显提高该β-木糖苷酶Xln-DT的可溶性分泌表达。
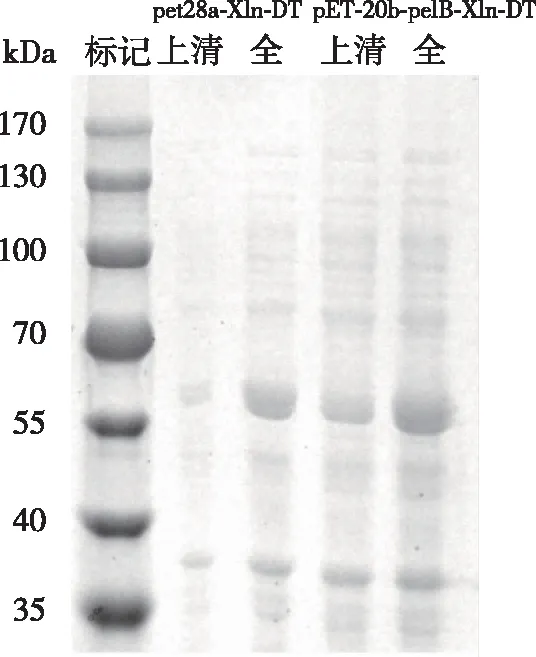
图2 重组β-木糖苷酶pelB-Xln-DT的SDS-PAGE电泳图Fig. 2 SDS-PAGE of the recombinant β-xylosidase pelB-Xln-DT
2.3 重组β-木糖苷酶pelB-Xln-DT的酶学性质研究
2.3.1 重组β-木糖苷酶pelB-Xln-DT的最适温度及温度稳定性
对重组β-木糖苷酶pelB-Xln-DT上清粗酶液进行最适温度和温度稳定性分析,结果见图3。由图3可知,原酶Xln-DT的最适温度为75 ℃,而引入了信号肽后的重组酶pelB-Xln-DT的最适温度为85 ℃,提高了10 ℃。对比了两种酶在85 ℃下的温度稳定性,原酶Xln-DT保温1 h能保持原酶80%以上的酶活,而重组酶pelB-Xln-DT保温1 h酶活基本不丧失,随着时间的继续增加,pelB-Xln-DT的剩余酶活力不断下降,2 h时降至82.3%,而原酶Xln-DT的残余酶活力为70.5%,说明信号肽的引入不但提高了β-木糖苷酶Xln-DT的可溶性表达量,还增强了其温度稳定性。
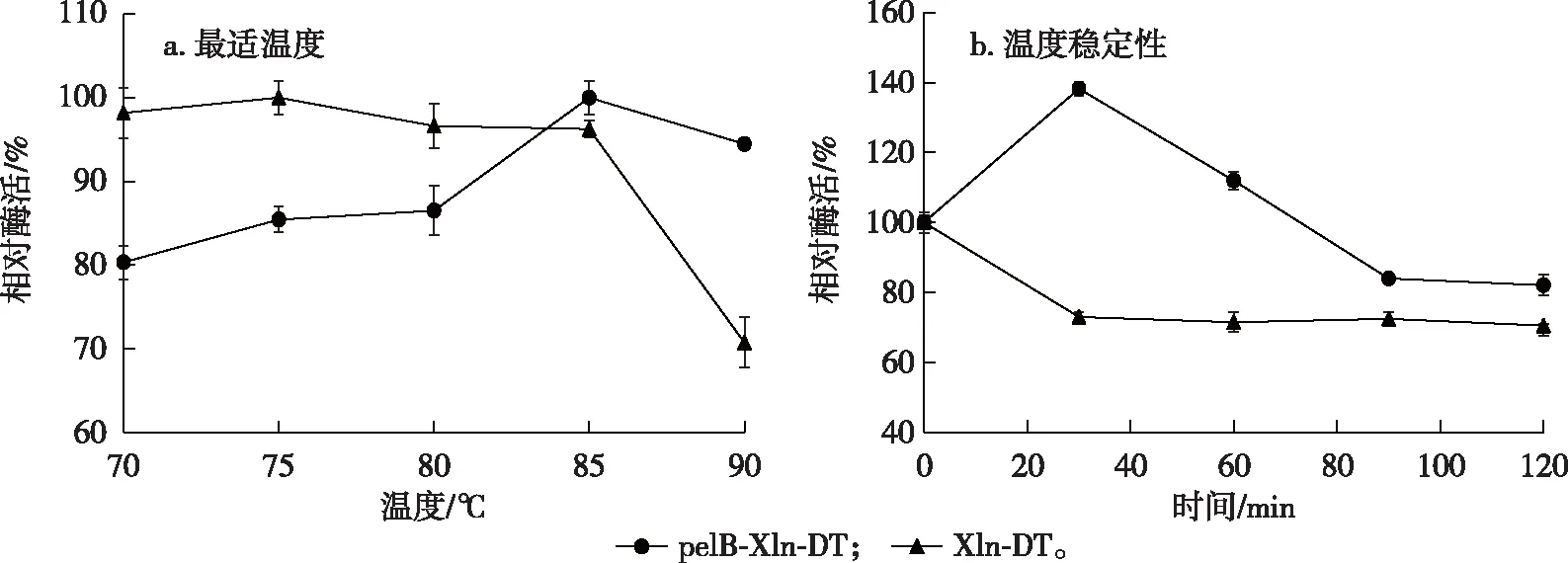
图3 重组β-木糖苷酶pelB-Xln-DT的最适温度及温度稳定性Fig. 3 Optimum temperature and stability of recombinant β-xylosidase pelB-Xln-DT
2.3.2 重组β-木糖苷酶pelB-Xln-DT的最适pH及其稳定性
重组β-木糖苷酶pelB-Xln-DT的最适pH及其稳定性的分析结果见图4。由图4可以看出,pelB信号肽的引入对酶的最适pH影响不大。原酶Xln-DT的最适pH为6.0,而重组酶pelB-Xln-DT的最适pH为5.5,降低了0.5。同时,将它们在不同pH状态下的缓冲液于4 ℃下保温24 h,测定各自的相对剩余酶活,pelB信号肽的引入没有明显影响酶的pH稳定性,原酶Xln-DT和重组酶pelB-Xln-DT在pH 4.0~7.0下均具有较好的pH稳定性。

图4 重组β-木糖苷酶pelB-Xln-DT的最适pH及其稳定性Fig. 4 Optimum pH value and stability of recombinant β-xylosidase pelB-Xln-DT

图5 全细胞催化剂pelB-Xln-DT转化三七皂苷R1的条件优化图Fig. 5 Optimization of the whole cell catalyst pelb-Xln-DT for the transformation of notoginsenoside R1
2.4 全细胞生物催化三七皂苷R1生成人参皂苷Rg1的单因素条件优化
以蒸馏水洗涤2~3次后的重组菌BL21/pET-20b-pelB-Xln-DT湿菌体作为全细胞的催化剂。取500 μL 灭菌后的LB培养基重悬菌体制成全细胞液体催化剂,加入底物三七皂苷R1后进行全细胞转化,分别探讨了温度、转化时间、底物质量浓度及转化重复次数对酶解效率的影响,结果见图5。
温度是影响酶催化反应的主要因素之一[13]。以全细胞pelB-Xln-DT作为全细胞催化剂,能够在培养菌的同时转化三七皂苷R1,因此需要选择大肠杆菌的最适生长温度。由图5a可知,随着温度的升高,人参皂苷Rg1的摩尔转化率也随之提高,当温度为37 ℃时,达到最大值,分析原因可能是温度的升高增加了细胞膜的通透性,从而使酶与底物三七皂苷R1之间的接触面增大,水解产物也能更快地渗透到胞外;随着温度的进一步提高,影响了细胞活性,降低了酶的催化反应效率。此外,pelB-Xln-DT在37 ℃下具有更好的稳定性,可以长时间反应,既能够高效转化,又能够节能省耗,更利于工业化转化工艺。因此,选择37 ℃为三七皂苷R1转化生成人参皂苷Rg1的最适反应温度。时间对水解效果有着显著的影响。时间过短,水解反应不充分;时间过长,酶容易失活降低活性,而且时间的延长意味着使用成本的增加。由图5b可知,人参皂苷Rg1的摩尔转化率随着时间的延长逐渐增加,超过3 h后酶解效率变化不大,说明最佳的酶解时间为3 h。底物质量浓度对转化率的影响结果如图5c所示,在1~3 g/L的底物质量浓度下,人参皂苷Rg1的摩尔转化率基本没有差别,均能达到90%以上,随着底物质量浓度的进一步增加,酶解效率开始下降,当底物质量浓度为10 g/L时,人参皂苷Rg1的摩尔转化率降低至69.3%。说明过量的底物对酶有一定的抑制作用,最佳的底物质量浓度为3 g/L。
酶解转化的HPLC图见6。由图6可知,经3 h反应后的人参皂苷Rg1(底物质量浓度为3 g/L)的摩尔转化率达到了91.6%。

图6 全细胞催化剂pelB-Xln-DT转化三七皂苷R1的HPLC液相图Fig. 6 HPLC diagram of the whole cell catalyst pelb-Xln-DT for the transformation of notoginsenoside R1
此外,对比了几种不同来源的β-木糖苷酶转化三七皂苷R1的效率,结果见表1。由表1可知:以Xln-DT[15]和TtGH9[16]作为催化剂时,转化效率达到98.2%以上,但不可重复利用;以TB13GH39[17]作为催化剂时,在30 ℃下需要反应24 h才能达到90.0%左右的转化率;而以pelB-Xln-DT作为全细胞催化剂时,不但反应条件温和,还可以重复利用,说明其具有极好的转化三七皂苷R1生成人参皂苷Rg1的能力,并提高了酶的使用重复率,降低了酶的使用成本。

表1 β-木糖苷酶转化三七皂苷R1的效率对比Table 1 Comparison of the efficiency of biotransforming notoginsenoside R1 by β-xylosidase
3 结 论
1)利用基因拼接技术将嗜热菌来源的木糖苷酶基因xln-DT重组至pET-20b质粒中pelB信号肽下游,重组质粒pelB-xln-DT转化大肠杆菌表达宿主E.coliBL21(DE3),成功构建分泌融合表达型基因工程菌pelB-Xln-DT。经IPTG诱导表达后发现引入pelB信号肽之后可大大提高β-木糖苷酶Xln-DT的可溶性表达。
2)对比了原酶Xln-DT和pelB-Xln-DT的酶学性质,结果表明pelB-Xln-DT的最适温度为85 ℃,较原酶提高了10 ℃,最适pH为5.5,较原酶降低了0.5;pelB-Xln-DT在85 ℃下的温度稳定性较原酶有了明显的提高,在85 ℃下保温1 h后酶活基本不变,保温2 h其剩余酶活为82.0%;在pH 4~7的范围内,pelB-Xln-DT具有良好的pH稳定性,由此说明引入pelB信号肽后能够提高酶蛋白的温度稳定性。
3)以基因工程菌pelB-Xln-DT作为全细胞催化剂,直接催化三七皂苷R1生成人参皂苷Rg1,探讨了转化温度、转化时间、三七皂苷R1添加量、重复次数等因素对转化效率的影响。结果表明,全细胞催化剂用量1 U/mL时,在37℃下,三七皂苷R1添加量为3 g/L,180 r/min的转速下反应3 h后,人参皂苷Rg1的摩尔转化率达到91.6%,且重复利用10次后,转化率仍能达到46.7%,显示出pelB-Xln-DT良好的重复催化转化三七皂苷R1生成人参皂苷Rg1的性能。当然,如何提高重复利用次数,可在今后的试验中继续研究菌培养时间、加入细胞表面活性剂、重悬菌体制成全细胞采用的液体种类、一步法转化等方面。
