MDC1对卵巢癌细胞迁移、侵袭与凋亡的影响
2020-07-13肖献花刘永军李贵梅
高 翔 肖献花 刘永军 郑 磊 李贵梅 于 华
(邯郸市第一医院,邯郸 056000)
卵巢癌是女性恶性肿瘤中较为常见的疾病,发病率高,死亡率高,易转移侵袭,患者预后较差。目前细胞减灭术与放化疗在一定程度上可以减轻肿瘤负荷,但不能明显改善患者的远期生存情况,归因于卵巢癌进展过程中具体的分子生物学作用机制尚未明确[1]。卵巢癌早期筛查的关键分子可能作为新型标志物有助于指导治疗的临床效果,提示患者预后。在卵巢癌中DNA损伤修复相关基因MDC1 (mediator of DNA damage checkpoint protein 1)作为潜在的原癌基因被报道,通过诱导上皮-间质转化促进卵巢癌转移[2]。MDC1是参与DNA损伤修复(是指DNA受到损伤后机体自发地进行相应的修复机制)的重要分子[3]。目前,MDC1在卵巢癌进展中的作用机制研究较少[4],本研究基于卵巢癌的临床病理和基因分子特点,旨在研究卵巢癌进展的目标分子MDC1对卵巢癌进展的影响及其作用机制。现报道如下。
1 资料与方法
1.1资料
1.1.1一般资料 选取我院2015年8月~2016年10月收治的80例卵巢癌患者,全部患者经病理确诊,年龄54~68岁,平均(56.3±1.2)岁。纳入标准:①均符合WHO卵巢癌诊断标准并分类;②纳入研究前未使用激素药物,或影响检测结果的药物;③接受定期随访与评估疾病预后者;④本次研究经患者同意并签署知情同意书。排除标准:①合并甲状腺激素异常者;②合并库欣综合征及其他内分泌疾病者;③其他肿瘤疾病者。
1.1.2细胞及主要试剂 细胞系人卵巢HO8910 PM,购于中国典型培养物保藏细胞库,经转染MDC1干扰载体pGIPZ-shMDC1及空载体pGIPZ-NC-backbone(美国Open Biosystems公司),命名为shMDC1-HO8910PM、NC(空白对照)-HO8910PM。购于美国Sigma-Aldrich的MDC1小干扰RNA (siR NA)序列为:negative control (5′-UUCUCCGAACGUGUCACGUdTdT-3′),siRNA2 (5′-CUCAUUGCUCCAUUCCACUdTdT-3′),siRNA3 (5′-GAAGAUCUUCCAUGGAGUAdTdT-3′);常规胰酶(上海生工公司);一抗(美国Gene Tex公司);二抗(英国Jastesm公司);MDC1抗体购自美国Sigma公司;染色液购自北京索莱宝生物公司;FBS培养基、碘化丙啶、苏木素、噻唑兰(MTT)等试剂购自中国联科生物公司。
1.2方法
1.2.1siRNA干扰的转染 控制第2天的对数生长期细胞密度为30%~50%,若第2天生长良好则进行转染,转移7.5 μl Lipofectamine RNAiMAX和20 μmol/L siRNA液在100 μl的Opti-MEM稀释后静置5 min,待混匀后再静置20 min。使用铺板细胞PBS洗2次,加入1.8 ml培养基与转染混合物;继续孵育4~6 h去除转染复合物,在转染24~72 h后(24 h检测RNA水平,48 h检测蛋白水平),检测siRNA干扰效率并进行后续实验。
1.2.2MTT试验 选取对数期细胞,常规胰酶消化细胞并计数,细胞铺于96孔板,接种密度1 000~3 000个/孔,边孔用无菌PBS填充;5% CO237℃孵育,至单层细胞铺满孔底(细胞贴壁后即可加药),加入浓度梯度的药物。每个孔中添加噻唑兰(MTT)试剂,继续孵育≥4 h。采用空针去除孔内液体,避免吸入结晶沉淀物,注意避光操作,利用检测仪测定吸光度值。
1.2.3Matrigel侵袭实验 按照1∶6稀释Matrigel和无血清培养液,Transwell小室中每孔转移15 μl,37℃静置1 h。HO8910PM细胞转染24 h后,1 000 r/min离心1 min,去上清,加入无血清培养液及3×105个细胞,达尔伯克改良伊格尔培养基(DMEM)稀释至400 μl,每组设3个复孔。将600 μl含10% 胎牛血清(FBS)的DMEM培养液加入小室,继续在CO2恒温箱中培养24 h。去掉嵌室内液,PBS洗3次,90%乙醇固定30 min,0.1%结晶紫染色30 min,风干后,显微镜拍照并计数。
1.2.4细胞划痕法实验 接种以上细胞待铺满培养板80%时,转染6 h后换液,直至铺满整个培养板,使用200 μl枪头划痕,用PBS冲洗5次去除残留细胞,以0 h为划痕时间点,每隔24 h拍照记录。
1.2.5免疫组织化学染色 依次按照如下步骤进行:组织切片脱蜡→抗原修复→去除过氧化物酶→封闭血清→孵育→显色→避光苏木素复染→脱水→盖玻片封片。由2位病理科医生进行评分[5],包括4级,0级为未出现染色,或者<5%细胞呈现染色;1级为低强度染色,或者5%~20% 染色细胞;2级为中度强度染色,或者21%~50%染色阳性;3级为强染色,或者>50%染色阳性。将MDC1表达水平分为2组:MDC1高表达组(3级染色强度)与MDC1低表达组(0~2级染色强度)。
1.2.6细胞周期与凋亡分析 转染siRNA干扰以上细胞的目的基因24 h后,用胰酶消化细胞并用10% FBS培养基终止消化后经800 r/min离心5 min,弃液后用PBS沉淀离心,避光碘化丙啶染色30 min。用300 目滤网滤至流式上样管,依据细胞形态调整条件上机检测,最后利用流式细胞仪采用Multicycle软件分析细胞周期与凋亡情况。
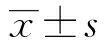
2 结果
2.1MDC1表达与卵巢癌临床病理学特征相关性分析 免疫组化结果显示卵巢癌中MDC1表达集中在细胞核部位,为核蛋白(图1)。图1A~C分别为MDC1典型特异性染色强度强、中、弱,MDC1表达集中于细胞核部位,为核蛋白;图1D为Kaplan-Meier生存分析,结果表明MDC1高表达组预后差(P<0.05)。两组患者FIGO分期、组织学分类、血清CA125及淋巴结转移存在相关性(P<0.05),而年龄无相关性(P>0.05)。见表1。
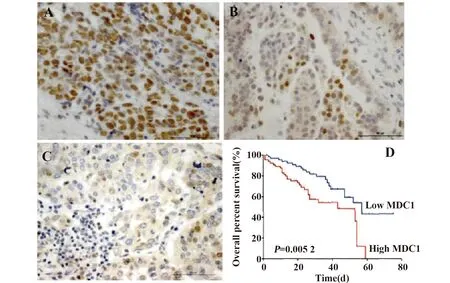
图1 80例卵巢癌石蜡组织切片的免疫组化染色Fig.1 Immunohistochemical staining of paraffin sections of 80 ovarian cancer tissuesNote: A-C.Immunohistochemical staining of paraffin sections of ovarian cancer (immunofluorescence,×20);D.The result of high and low expression of MDC1 in Kaplan-Meier survival analysis.
表1 MDC1表达与卵巢癌临床病理学特征相关性分析[n(%)]
Tab.1 Correlation analysis between MDC1 expression and clinicopathological features of ovarian cancer[n(%)]

Relevant factorsnMDC1 low expressionMDC1 high expressionχ2 valueP valueAge(year)<60309210.0350.852≥60501634Clinical stageⅠ-Ⅱ stage2414128.4340.004Ⅲ-Ⅳ stage56479Histological classificationSlurry554698.8860.003Non-slurry251312Serum CA125<35102834.1280.000≥3570655Lymph node metastasisNegative2071318.8080.000Positive60519

图2 Transwell实验检测MDC1对细胞迁移侵袭能力的影响Fig.2 Transwell assay to examine effect of MDC1 on cell migration and invasion

图3 MDC1 siRNA干扰后对细胞迁移侵袭能力的影响Fig.3 Effect of MDC1 siRNA interference on cell migration and invasion ability

图4 划痕实验检测MDC1干扰后对细胞迁移能力的影响Fig.4 Effect of scratch test on cell migration ability after MDC1 interference
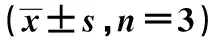
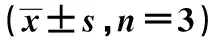
GroupsG0G1G2MSNC-HO8910PM47.55±2.4122.34±0.4930.11±2.14shMDC1-HO8910PM82.88±2.188.52±1.388.60±1.72t value18.83116.34613.570P value0.0000.0000.000
2.2MDC1对卵巢癌细跑的迁移和侵袭的影响 Transwell实验发现MDC1干扰细胞系shMDC1-HO8910PM穿入下室的细胞数明显较NC-HO8910-PM减少(P<0.05,图2),同时siRNA干扰实验结果也进一步证明以上结果(图3)。划痕实验也显示,shMDC1-HO8910PM的迁移能力弱于NC-HO8910 PM(P<0.05,图4)。
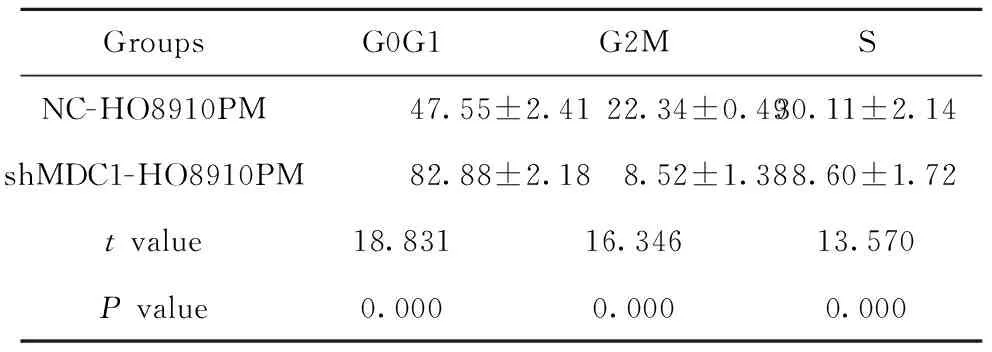
2.3MDC1对卵巢癌细胞的周期与凋亡的影响 siRNA干扰MDC1 24 h后,发现与NC-HO8910PM比较,细胞周期G0G1细胞比例明显增加,G2M、S细胞比例明显减少(P<0.05),提示MDC1促进卵巢癌细胞增殖与细胞周期的进展,见表2。
3 讨论
近年来,随着肿瘤生物学研究的不断深入,发现DNA损伤修复作为机体早期抵抗肿瘤过程的关键防线,而经典的抑癌基因参与DNA损伤修复过程[6]。若DNA损伤后不能进行有效的修复,则DNA遗传稳定性改变而导致基因突变形成肿瘤。临床上主要通过放化疗治疗手段损伤肿瘤细胞DNA来实现肿瘤治疗[7]。
近年来,MDC1被陆续发现参与肿瘤的进展。有研究指出MDC1参与胃癌细胞增殖和周期调控,揭示其可作为食管癌的一个潜在基因靶点[8]。而Qin等[9]研究表明MDC1影响胃癌的进展过程。此外,MDC1在肿瘤侵袭转移过程也发挥同样的作用。本课题组前期通过分析上皮性卵巢癌的不同蛋白质组学及其表达差异,以及与正常卵巢组织对比分析,发现MDC1参与DNA损伤修复过程,故推测其可能影响肿瘤的进展。虽然在不同肿瘤中MDC1的作用机制不同,但以上研究进一步揭示MDC1可能在卵巢癌进展过程发挥类似的调控机制[10]。本研究发现,shMDC1-HO8910PM与siRNA干扰后的实验均说明MDC1基因敲减后导致肿瘤细胞迁移和侵袭能力明显减弱。而划痕实验也表明MDC1促进肿瘤细胞的迁移能力,以上均揭示在卵巢癌中MDC1能促进卵巢癌细胞迁移侵袭,这为临床卵巢癌治疗提供可靠的信息。此外,在宫颈癌和食道癌的研究中,MDC1对细胞周期和耐药性有影响,但在卵巢癌中,siRNA干扰MDC1后,细胞周期G0G1细胞比例明显增加,G2M、S细胞比例明显减少,提示MDC1促进卵巢癌细胞增殖与细胞周期的进展。
为了进一步研究MDC1在卵巢癌中的表达位置,本研究采用免疫组织化学染色,发现MDC1主要集中在细胞核部位,这也与部分研究资料证实的MDC1通过与其他蛋白相互作用来进行DNA损伤修复是一致的[11,12]。原发性卵巢癌多采用铂类药物,但在治疗中发现较多患者出现复发或耐药性。目前,研究者深入探究卵巢癌铂类药物耐药机制去改善患者预后[13,14]。通过Kaplan-Meier生存分析发现MDC1表达与卵巢癌FIGO分期、组织学分类、血清CA125及淋巴结转移等因素均有相关性,高表达提示预后差,但与发病年龄无关。故MDC1可作为分析卵巢癌预后的分子标志物[15]。
综上所述,MDC1的表达水平可能与卵巢癌预后相关,其高表达提示预后差,同时MDC1具有促进卵巢癌迁移侵袭作用,并促进卵巢癌细胞增殖与细胞周期的进展。需要指出的是,MDC1对卵巢癌进展的机制还有待于更多的基础与临床研究去证实。
