从AMPK/PKC信号通路探讨盐酸药根碱促进NCI-H716细胞分泌GLP-1的作用机制*
2020-07-13魏世超徐丽君胡茹楠童凤雪张砾丹陆付耳
刘 谦 魏世超 徐丽君 邹 欣 胡茹楠 童凤雪 张砾丹 陆付耳
1华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 430030 2华中科技大学同济医学院附属同济医院药学部,武汉 430030 3华中科技大学同济医学院附属同济医院中西医结合系,武汉 430030
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种由肠道L细胞产生及分泌的多肽激素,该激素以葡萄糖浓度依赖性方式促进胰岛β细胞分泌胰岛素,调节血糖水平[1]。但GLP-1在体内很快被二肽基肽酶-IV(DDP-IV)分解,所以半衰期极短,只有5 min左右[2]。因此,寻找能够有效促进内源性GLP-1分泌的药物将会给2型糖尿病的治疗带来新的途径。目前研究[3-4]证实,黄连及其有效成分如小檗碱、表小檗碱、黄连碱、药根碱等均具有一定的降糖调脂功效。本课题组前期研究[5]进一步证实黄连有效成分小檗碱、黄连碱、药根碱及其混合物可升高荷糖小鼠胰岛素和GLP-1水平,并且证实其可直接作用于L细胞的研究模型之一的NCI-H716细胞而促GLP-1分泌,即可恢复内源性GLP-1的分泌,而且混合物的作用效果优于单一成分。在相关研究中,小檗碱的研究最为广泛和深入[6-8],体内外实验均证实其可促进GLP-1的分泌[9],并主要通过AMPK/PKC/PKA信号通路发挥作用,其他成分的作用机制目前尚不明确。本实验进行混合物中另一成分——盐酸药根碱(jatrorrhizine,JAT)相关作用及其机理的研究,即利用GLP-1分泌细胞模型——来源于人低分化的盲肠腺癌NCI-H716细胞株,初步探讨JAT恢复内源性GLP-1分泌的作用及其机制。通过该系列的相关研究,将为小檗碱、黄连碱和药根碱的新药开发奠定理论基础。
1 材料与方法
1.1 实验细胞
NCI-H716细胞株购买自上海中科院细胞库,由本实验室传代培养。
1.2 实验药品及试剂
盐酸药根碱(JAT)由南京普怡生物科技公司提供(纯度≥98%,批号111022),JAT对照品由成都普菲德生物技术有限公司提供(批号15050712)。AMPK通路抑制剂Dorsomorphin(批号115M4736V)和PKC通路抑制剂Chelerythrine chloride(批号C2932)均购于美国Sigma公司。胎牛血清(美国Gibco公司,批号10270-106)、GLP-1 ELISA试剂盒(美国R&D Systems,批号P148658)、CCK-8试剂盒(日本同仁,批号BC2060)、PCR试剂盒(日本Takara公司,批号AK5301、AK7301)、TRIZOL[安迪福诺生物科技(武汉)有限公司,批号AB312FP1]、GLP-1 Antibody-BSA Free(美国Novus公司,批号K0920)、Anti-mouse IgG、GAPDH Mouse mAb(美国CST公司,批号6)、Color-coded Protein Marker(美国CST公司,批号00556442)、BCA试剂盒(武汉赛维尔生物科技有限公司,批号181363)。
1.3 实验仪器
二氧化碳培养箱(5810F,美国Nuaire公司)、酶标仪(Synergr2,美国Bio-Tek公司)、迷你离心机(LX-200,中国其林贝尔仪器)、漩涡混合器(XW-80A,中国沪西仪器)、恒温箱(XMTD-8222,中国天康电子)、低温高速离心机型(Megafuge 8R,德国sigma公司)、电子天平(BT25S,中国赛多利斯)、微量加样器(P1000、P200、P100、P20、P2.5,德国Eppendorf公司)、PCR仪(Mastergyde,德国Eppfndorf公司)、荧光定量PCR仪(Stepone,美国Applied Biosystems公司)、电泳仪(DYY-6C,美国Bio-RAD公司)、扫膜仪(Odyssey公司)。
1.4 细胞培养
将NCI-H716细胞培养于含10%胎牛血清的DMEM高糖培养基中,置于37℃、含5%CO2、湿度饱和的恒温细胞培养箱内培养,每隔2~3 d换液或传代1次。
1.5 分组及给药
选取同批同代对数生长期细胞,离心弃上清,加入0.02 g/L的BSA溶液混悬细胞,调整细胞密度为1.5×106个/mL,接种于无菌6孔板,每孔2 mL,置于37℃、5% CO2培养箱培养90 min,分为最适JAT组、低JAT组、高JAT组、最适JAT+高、中、低浓度抑制剂Dorsomorphin组(50、10、2)μmol/L、最适JAT+高、低浓度抑制剂Chelerythrine组(10、2)μmol/L及空白组,共9组。向6孔板中加入等体积、不同浓度的实验药物,空白组加入等体积0.02 g/LBSA溶液,置于37℃、5% CO2培养箱干预36 h。收集各组细胞,提取RNA用于PCR检测,提取蛋白用于Western blot检测,离心上清用于酶联免疫吸附法(ELISA)检测。
1.6 检测指标
1.6.1 CCK-8方法检测细胞活性
①选择JAT浓度 取对数生长期NCI-H716细胞按照1×104个接种于96孔板中,每孔加入100 μL细胞悬液置于37℃、含5%CO2、湿度饱和的恒温细胞培养箱内培养24 h,加入100 μL含不同浓度JAT(6、30、60、90、150、300 μmol/L)的完全培养基在培养箱中继续培养36 h,加入10 μL CCK-8溶液,在培养箱中孵育4 h,用酶标仪测定在450 nm处的吸光度,记录实验结果,计算细胞存活率。实验重复2次。据此结果,绘制药物浓度与吸光度曲线,选择JAT 150 μmol/L作为本实验基本浓度。
②不同处理对细胞活性的影响 分组同前,每组设置6个复孔,使用上述CCK-8方法检测吸光度,计算细胞存活率,根据细胞存活率计算细胞相对活性,实验重复2次。细胞相对活性=(实验组细胞存活率/空白对照组细胞存活率)×100%。
1.6.2 ELISA法检测GLP-1蛋白含量 采用ELISA法检测GLP-1蛋白含量,分组同前,加上不加样的阴性对照组。参照ELISA试剂盒说明方法绘制标准曲线方程(y=1357x+30.915),同时每组取50 μL进行GLP-1含量的测定,重复8次。
错因:不清楚反应的实质。由于反应过程中KClO3得到6个电子被还原,而HCl失去一个电子被氧化,因此,氧化产物和还原产物的物质的量之比为6∶1;或者由于反应过程中KClO3得到电子还原为KCl(还原产物),而 HCl失去电子被氧化Cl2(氧化产物),根据化学方程式得到氧化产物和还原产物的物质的量之比为1∶3。
1.6.3 PCR法检测GLP-1 mRNA表达 参照Trizol试剂盒说明书提取RNA,波长260/280 nm处分别测吸光度,鉴定RNA纯度,取A260/280>1.8、0.1 1.6.4 Western blot法检测GLP-1蛋白水平 ①蛋白样品制备及变性 取药物干预36 h后的NCI-H716细胞于2 mL EP管中,每管加入RIPA裂解液(按照每孔裂解液150 μL),置碎冰上裂解30 min,4 ℃,12 000 r/min离心10 min,取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。各组吸取80 μL,按4:1加入5×Loding buffer,混匀后煮沸15 min。 ②制胶、上样及电泳 配制18%分离胶,依次加入去离子水、30% acrylamide、1.5 mol/L Tris-HCl(pH 8.8)、10% SDS充分混匀,再加入10% AP和TEMED后立即摇匀,并加入到2层玻璃板之间,去离子水液封,37 ℃放置30 min,待胶凝后将水倒出,吸除多余水分;再按上述方法配制5%浓缩胶,均匀灌胶,插入梳子,室温放置30~60 min后取出梳子,用水冲洗浓缩胶后放入电泳槽中,加入足够电泳缓冲液后,根据所测蛋白浓度,每孔按蛋白量40 μg上样;稳定电压80 V,电泳30 min,当染料进入分离胶后,将电压调至120 V继续电泳,到达凝胶底部时终止电泳。 ③转膜、封闭 将转膜支架放平,依次放置滤纸、PVDF膜、凝胶、滤纸,将凝胶面与负极相连,PVDF膜与正极相连,接通电源,200 mA转膜30 min。将PVDF膜放入含5%脱脂奶粉的TBST溶液,摇床上轻摇1 h后TBST洗膜。 ④抗体孵育及显影 4℃一抗孵育24 h(一抗浓度为GLP-1 1:1000、GAPDH 1:1000),次日用TBST洗膜,室温孵育1 h(二抗稀释浓度为GLP-1 1:5000、GAPDH 1:5000),洗膜。用Odyssey双色红外荧光成像系统对目的条带进行扫描,用Image J软件进行分析。 表1 PCR引物序列 图1 不同浓度JAT对细胞活性的影响 采用CCK-8方法检测细胞活性,不同处理间细胞活性比较,差异无统计学意义(P>0.05),可视为同等条件。见图2。 1为空白组;2为JAT(150)组;3为JAT+Dorsomorphin(150+2)组;4为JAT+Dorsomorphin(150+10)组;5为JAT+Dorsomorphin(150+50)组;6为JAT+Chelerythrine(150+2)组;7为JAT+Chelerythrine(150+10)组 ELISA法检测GLP-1浓度结果显示,药根碱可明显促进NCI-H716细胞分泌GLP-1,加入不同浓度的AMPK通路抑制剂Dorsomorphin和PKC通路抑制剂Chelerythrine均可抑制药根碱的这一作用,且Dorsomorphin的抑制作用具有浓度依赖性。此外,分别对比高浓度Dorsomorphin组、低浓度Chelerythrine组、高浓度Chelerythrine组与阴性对照组,无统计学差异,即可认为上述3组中NCI-H716细胞分泌GLP-1被完全抑制,故此3组不再进行GLP-1表达的测定。见表2。 RT-PCR法检测GLP-1表达结果显示,药根碱可明显促进NCI-H716细胞GLP-1 mRNA表达,而Dorsomorphin可抑制药根碱的作用,且浓度越高,抑制作用越明显。见表3。 表2 药物对GLP-1分泌的影响 与空白对照组比较,*P<0.05;与JAT(150)组比较,△P<0.05;JAT+Dorsomorphin(150+2)、JAT+Dorsomorphin(150+10)、JAT+Dorsomorphin(150+50)组两两比较,▲P<0.05 表3 各组细胞GLP-1 mRNA表达 与空白对照组组比较,*P<0.05;与JAT(150)组比较,△P<0.05;与JAT+Dorsomorphin(150+2)组比较,▲P<0.05 Western blot法检测GLP-1蛋白的表达结果显示,药根碱可明显促进NCI-H716细胞GLP-1表达,且150 μmol/L的药根碱效果最好,而Dorsomorphin可抑制药根碱的作用,且浓度越高,抑制作用越明显。见图3及图4。 1为空白对照组;2为JAT(100)组;3为JAT(150)组;4为JAT(200)组;5为JAT+Dorsomorphin(150+2)组;6为JAT+Dorsomorphin(150+10)组 1为为空白对照组;2为JAT(100)组;3为JAT(150)组;4为JAT(200)组;5为JAT+Dorsomorphin(150+2)组;6为JAT+Dorsomorphin(150+10)组 GLP-1促进葡萄糖依赖性胰岛素分泌,也能促进胰腺导管内皮细胞转为胰岛素样细胞,给予永久性胰腺上皮细胞(IMPE)GLP-1后能促使胰岛素分泌,可保护β细胞避免高游离脂肪酸、高浓度葡萄糖自身代谢引起的凋亡,故GLP-1通过保护β细胞来控制血糖,并且在降低血糖同时不会导致明显低血糖,为其临床应用奠定了基础[10]。基于GLP-1靶点的药物很多,现在临床上相继出现了GLP-1类似物类药物如索玛鲁肽和利拉鲁肽、DPP-IV抑制剂如维格列汀和西他列汀等,此类药物临床疗效明确,尤其是在心血管方面有所获益[11-13]。但是,GLP-1类似物给药方式为皮下注射,即使用药频率较高,也难以保持GLP-1浓度稳定,且存在可能导致的副作用如胰腺炎、胃肠道不适等[14]。而DPP-IV抑制剂完全依赖GLP-1发挥作用[13,15],若内源性GLP-1分泌不足,则其药效普遍不佳。由此可见,GLP-1类似物和DPP-IV抑制剂应用于临床过程中均存在严重的局限性。因此“从内求之”,促进内源性GLP-1分泌可能是基于GLP-1靶点治疗T2DM的突破口。 NCI-H716细胞是人结直肠腺癌细胞,是一种由低分化的盲肠腺癌产生的细胞系,具有内分泌特性,包括嗜铬粒蛋白和胰高血糖素原的表达,并可由脂肪酸、糖调节蛋白(GRP)、胆碱能激动剂、PKA和PKC活化剂刺激分泌GLP-1[16-17]。 腺苷酸活化蛋白激酶(AMPK)是一种由α、β和γ3个亚单位组成的异源三聚体蛋白。AMPK在调节机体能量代谢平衡方面起总开关作用,通过调节肝葡萄糖的转化,增强骨骼肌对葡萄糖的摄取和脂肪组织中葡萄糖的利用,以保证机体糖代谢的稳定。AMPK及其信号通路有望成为治疗肥胖和2型糖尿病的新药理学靶点[18-19]。AMPK是促进小檗碱发挥有益作用的主要中间体[20-21]。研究[22]表明,AMPK位于p38 MAPK上游,MAPK通路参与了GLP-1分泌。在NCI-H716细胞中,小檗碱、AMPK和GLP-1之间存在一定的相关性[9,23]。药根碱和小檗碱同为黄连提取物,其促进GLP-1的分泌可能也与AMPK相关。Dorsomorphin(又称Compound C)是一种有效的,可逆选择性AMPK抑制剂,无细胞试验中Ki为109 nmol/L,对几个结构相关的激酶,包括ZAPK、SYK、PKCθ、PKA、和JAK3没有显著的抑制作用,也会抑制I型BMP受体活性。 PKC是一种重要的调节细胞生长发育、收缩、分泌、传导、通透性、细胞外基质和基因表达等的第二信使,可以将胞外信息传递到细胞内,并且在糖尿病微血管并发症中发挥重要作用[24-25]。有报道[26-27]显示PKC依赖的途径参与调节NCI-H716细胞中GLP-1的分泌。用体外培养人肝细胞模型进行的研究[28]表明,小檗碱通过激活PKC依赖通路诱导胰岛素受体的表达,说明小檗碱的作用至少在某种程度上与PKC依赖的途径有关。药根碱和小檗碱同为黄连提取物,其促进GLP-1的分泌可能也与PKC依赖的途径相关。Chelerythrine是一种特异性的PKC通路抑制剂,Chelerythrine以1.5 μmol/L的IC50抑制BclXL-Bak BH3肽结合,并从BclXL中置换Bax(一种含BH3的蛋白质)。 综上所述,JAT具有恢复内源性GLP-1分泌的功效,该作用可被AMPK通路抑制剂Dorsomorphin和PKC通路抑制剂Chelerythrine所阻断,即与AMPK通路和PKC通路相关。有关组合物的另一成分——黄连碱,相关机理研究待续。
1.7 统计学方法
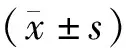
2 结果
2.1 基本药物浓度的选择

2.2 药物处理对细胞活性的影响
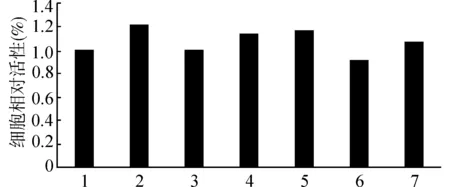
2.3 不同抑制剂对药根碱促进NCI-H716细胞分泌GLP-1的影响
2.4 不同抑制剂对药根碱促进NCI-H716细胞GLP-1 mRNA表达的影响


2.5 不同抑制剂对药根碱促进NCI-H716细胞GLP-1蛋白表达的影响


3 讨论
