制备方法对CuO-Cr2O3催化剂结构及其催化2-丙基-2-庚烯醛加氢性能的影响
2020-07-11王淇锋宋冰洁孙培永张胜红傅送保姚志龙
王淇锋,赵 雨,宋冰洁,陈 和,孙培永,张胜红,傅送保,姚志龙
1.北京石油化工学院,北京 102617;
2.恩泽生物质精细化工北京市重点实验室,北京 102617;
3.中海油炼油化工科学研究院,北京102209
2-丙基-1-庚醇(2-PH)是一种新型增塑剂醇,以2-PH为主要原料制备的邻苯二甲酸二(2-丙基庚)酯(DPHP)相较于邻苯二甲酸二辛酯(DOP)等传统增塑剂,具有增塑性能好、安全环保和成本低等优点[1]。近年来,大量研究证明了传统增塑剂具有潜在的致癌性[2]。美国、日本和欧洲等发达国家纷纷限制DOP等传统增塑剂的生产,并禁止其在医药、食品以及玩具包装等塑料产品中使用[3]。因此,2-PH的需求量逐年增加,具有广阔的市场前景。
目前,2-PH的制备有正戊醇Guerbet反应、正戊醛一步法和合成2-丙基-2-庚烯醛(PBA)加氢3种路线。Panchenko等[3]采用NaOH/Pt/Al2O3催化剂催化正戊醇Guerbet反应生成2-PH,目前还处于实验探索阶段,尚未应用于工业生产中。Sharma等[4]采用钌水滑石催化剂,用于正戊醛一步合成2-PH,但2-PH的选择性仅为48%。Zhao等[5]以NiO-Co3O4/Nb2O5-TiO2为催化剂,催化正戊醛加氢合成2-PH,2-PH的选择性可提高到60%左右。目前工业上主要采用PBA加氢合成2-PH。以廉价的混合丁烯为原料,与合成气(H2与CO)进行低压氢甲酰化反应生成戊醛,两分子戊醛在碱催化剂作用下发生羟醛缩合反应生成PBA,PBA再经过催化加氢得到2-PH[6]。该工艺不仅处理了从甲醇制烯烃装置中分离出的廉价混合丁烯,还满足了市场对2-PH的需求[7]。
常用的PBA加氢催化剂有铜铬催化剂[8]、铜锌催化剂[9]、镍系催化剂[10]和贵金属催化剂[11]。铜铬催化剂由于具有较高的羰基加氢活性和目标产品醇的选择性[12],因此目前工业上PBA加氢均采用铜铬催化剂的液相加氢技术。但是大量研究结果表明,铜铬催化剂的制备不可避免的会产生一些高价铬离子的废液,不仅导致原料金属盐的损失,还对环境以及生产人员的人身安全造成隐患[13-14]。本工作研究了以硝酸铜和硝酸铬溶液为原料,通过蒸发水解合成凝胶制备铜铬复合氧化物催化剂的方法,命名为蒸发水解凝胶法,以消除含铬、铜离子废水的排放,并探讨了制备条件和方法对CuO-Cr2O3催化剂结构及其催化PBA加氢性能的影响。
1 实验部分
1.1 催化剂制备
共沉淀法:分别配制浓度为1 mol/L的Cu(NO3)2溶液和0.9 mol/L的Cr(NO3)3溶液,按一定比例混合搅拌均匀备用。将一定量十六烷基三甲基溴化铵(CTAB)和去离子水以质量比为1:8溶解,搅拌2 h后加入铜铬混合盐溶液中,搅拌1 h,使三者混合均匀。配制质量分数为20%的无水碳酸钠溶液,在室温下,用蠕动泵将一定量质量分数为20%的Na2CO3溶液逐滴加入搅拌状态下的混合盐溶液,待溶液pH值为9时停止滴加,室温陈化12 h,然后用真空泵抽滤,并用去离子水洗涤5次得到湿滤饼,再转入120 ℃烘箱中干燥12 h得到前驱体,将前驱体在空气氛围下焙烧300 ℃并维持4 h,在7 MPa下压片成型,记为催化剂a。
蒸发水解凝胶法:以Na2CO3溶液为沉淀剂,与一定量Cu(NO3)2溶液反应获得所需Cu(OH)2沉淀,在沉淀中加入所需量一定浓度的Cr(NO3)3溶液,搅拌0.5 h,将所得溶液置于90 ℃油浴中搅拌蒸发水解,直至得到凝胶,再转入120 ℃烘箱中干燥12 h,得到前驱体,将前驱体在空气氛围下焙烧300 ℃并维持4 h,在7 MPa下压片成型,记为催化剂b。催化剂c与催化剂b的制备基本相同,区别在于蒸发水解获得凝胶的过程中滴加草酸溶液,草酸添加量为体系中硝酸根物质量的50%。催化剂d以草酸溶液为沉淀剂,与一定量Cu(NO3)2溶液反应获得所需CuC2O4沉淀,后续制备过程与催化剂b相同。
将一定量Cu(NO3)2溶液加入所需量一定浓度的Cr(NO3)3溶液中,搅拌0.5 h,将所得混合溶液置于90 ℃油浴中搅拌蒸发水解,在蒸发水解获得凝胶的过程中采用蠕动泵滴加草酸溶液,草酸添加量与体系中硝酸根物质量的比为1:1。将所得凝胶转入120 ℃烘箱中干燥12 h得到前驱体,将前驱体在空气氛围下焙烧300 ℃并维持4 h,在7 MPa下压片成型,记为催化剂e。
对于铜铬氧化物催化剂而言,采用共沉淀法制备过程中需要过滤、洗涤,而所有金属离子盐不可能完全沉淀,必然会存在含金属离子废水排放的问题。采用蒸发水解凝胶法制备催化剂的过程中无洗涤、过滤等操作,且水以水蒸气的形式移出催化剂合成体系。与催化剂a制备过程相比,采用蒸发水解法合成催化剂b,c和d的过程中消除了含铬离子废水的排放,而催化剂e的制备过程消除了含铬、铜离子废水的排放。
1.2 催化剂表征
采用日本岛津公司的XRD-7000型X射线衍射(XRD)仪分析催化剂晶型结构,Cu Kα靶,波长(λ)为0.154 2 nm,操作电压和电流分别为40 kV和40 mA,扫描速率为4 (o)/min。采用美国康塔公司Autosorb-iQ型N2物理吸附仪分析催化剂孔结构及比表面积,采用BET(Brunauer-Emmett-Teller)和BJH(Barrett-Joyner-Halenda)法分别计算催化剂的比表面积及孔容等参数。采用湖南华思仪器有限公司DAS-3000型动态吸附仪进行H2程序升温还原(H2-TPR)分析,载气为10% H2/Ar混合气,程序性升温升温速率为10 ℃/min。
1.3 催化剂性能测试
PBA加氢反应在固定床反应器(∅15 mm×500 mm)内进行。反应原料PBA采用工业级别原料,PBA质量分数为99.85%。催化剂装填量为10 g,装填于反应管中部的恒温区,上下两段用一定质量的惰性玻璃珠固定。首先在常压、氢气气氛(流量400 mL/min)、250 ℃条件下还原1 h,在达到反应条件后切入PBA原料并调节氢气流量开始反应。反应产物经气液分离和冷凝后采用岛津GCMS-QP2010型气相色谱-质谱联用仪定性分析,采用配有Wax-10色谱柱的安捷伦7890A-GC型气相色谱进行定量分析。
2 结果与讨论
2.1 铜铬催化剂物化性质分析
2.1.1 XRD分析
图1为不同方法制备的铜铬催化剂的XRD图谱,依据Scherrer公式计算的催化剂表面CuO晶粒尺寸数据列于表1。图1中曲线a~e分别对应催化剂a,b,c,d和e。从图1可以看出,不同制备方法获得的催化剂在结构上存在差别。虽然催化剂a~e在2θ为32.5,35.5,38.7,48.7,61.5,66.2,68.1,72.4和74.9°处均观察到归属于CuO的特征衍射峰,但在峰型和半峰宽等方面存在明显差异。催化剂b上归属于CuO的特征衍射峰较为尖锐,说明该催化剂上CuO结晶完整度较高,晶粒尺寸较大,而催化剂d和e上归属于CuO的特征衍射峰相对较为弥散而又宽化,表明催化剂d和e上的CuO晶粒较小且分散度较高。另外,在催化剂b上可以明显观察到在2θ为24.3,24.9,33.9,36.1,41.6,46.3和53.7°归属于CuCrO4的特征衍射峰,这可能是在以氢氧化铜与硝酸铬溶液采用蒸发水解法制备凝胶的过程中,反应体系中硝酸根将Cr3+氧化为Cr6+而形成了CuCrO4的缘故。对比催化剂b和c可以看出,催化剂c上没有观察到归属于CuCrO4的特征衍射峰,两种催化剂制备方法的区别仅在于催化剂c在蒸发水解形成凝胶过程中滴加了还原性草酸溶液。因此,这可能是由于在凝胶化条件下,草酸根优先与硝酸根反应抑制了硝酸根对Cr3+氧化作用。对比催化剂d和c发现,催化剂c在2θ为31.3,36.4,62.3,65.4,77.3和88.5°处存在归属于CuCrO2的特征衍射峰,且峰强度较催化剂d上的强。这是由于相对于催化剂d,催化剂c制备过程中还原剂草酸的添加量较低,部分草酸的引入抑制了Cr3+的氧化,但低浓度的硝酸根的存在有利于CuCrO2物种的形成。催化剂e对应蒸发水解凝胶法制备催化剂的反应体系中含有足量的草酸根,在相应催化剂XRD谱线上未观察到归属于CuCrO4和CuCrO2的特征衍射峰,进一步证实了上述推断。催化剂a采用共沉淀法制备,在催化剂a上除归属于CuO的特征衍射峰外,还可以明显观察到位于2θ为29.6,31.1,35.2,37.7,42.3,56.2,57.9,61.4,64.8和74.3°处归属于CuCr2O4的特征衍射峰。另外,在催化剂a~e上均未观察到归属于Cr2O3的特征衍射峰,说明Cr2O3以非晶相的形式存在[15]。由此可见,采用不同的制备方法获得的CuO-Cr2O3催化剂在物相组成上存在差别。共沉淀法制备的催化剂主要组成为CuO,CuCr2O4和无定型Cr2O3,而采用蒸发水解凝胶法制备催化剂时,若制备凝胶体系中不引入还原性物质草酸其主要物相为CuO,CuCrO4和无定型Cr2O3,当制备凝胶体系中引入足量草酸,则主要物相组成为CuO和无定型Cr2O3。

图1 不同方法制备的铜铬催化剂的XRD图谱Fig.1 XRD patterns of Cu-Cr catalysts prepared by different methods
2.1.2 H2-TPR分析
图2为不同方法制备的铜铬催化剂H2-TPR图谱,其中谱线a~e对应催化剂a~e。从图2可以看出,不同制备方法获得的催化剂在还原性能上存在差别,其中催化剂b的H2还原起始温度最高,催化剂a次之,催化剂c,e和d相近,相对较低。结合催化剂XRD分析结果可知,此温度与催化剂上CuO晶粒尺寸有关,温度越低对应晶粒尺寸越小。催化剂b不仅还原起始温度高,且氢气消耗峰面积最大。这是由于采用蒸发水解凝胶法合成催化剂b的过程中未引入还原剂草酸,合成的催化剂b中不仅CuO晶粒尺寸大且含有CuCrO4物相,在氢气还原过程中CuCrO4也被还原,消耗一部分氢气。催化剂c在189 ℃和465 ℃处可以观察到两个明显的氢气消耗峰,与其它谱线相比低温处氢气消耗峰面积相对较小。这是由于在催化剂c制备过程中虽引入还原剂草酸抑制了CuCrO4物相的形成,但添加量不足导致CuCrO2的生成,催化剂上CuO含量相对较低,而高温处氢气消耗峰对应于催化剂上CuCrO2物种的还原。对比谱线a,d和e可以看出,采用还原性蒸发水解凝胶法比共沉淀法制备的催化剂具有更低的氢气起始还原温度,这进一步说明还原性蒸发水解凝胶法制备的催化剂上CuO晶粒尺寸更小。
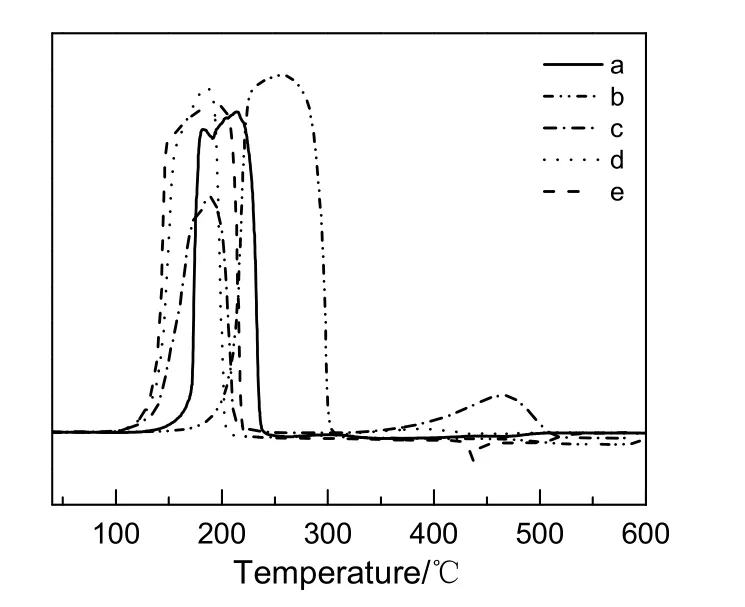
图2 不同方法制备的铜铬催化剂的TPR图谱Fig.2 TPR profiles of Cu-Cr catalysts prepared by different methods
2.1.3 BET分析
表1为不同方法制备铜铬催化剂的孔结构表征数据。
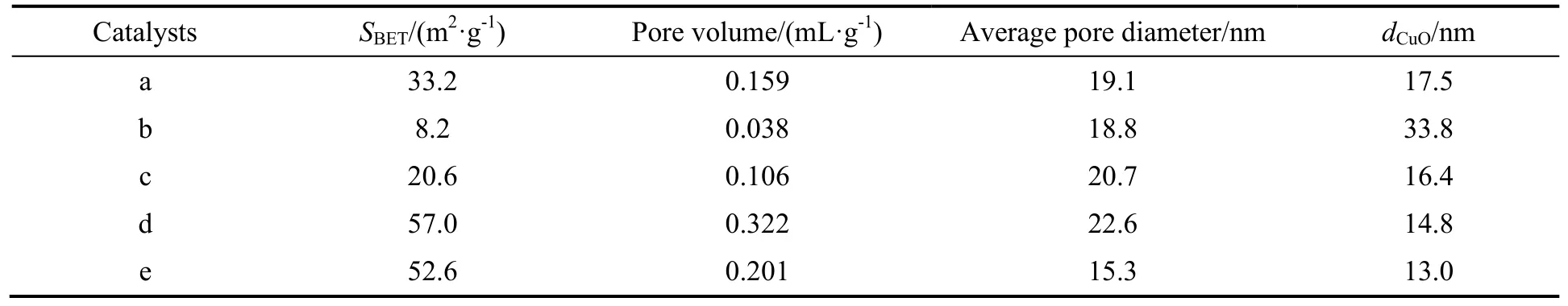
表1 不同方法制备的铜铬催化剂的孔径及比表面积Table 1 The pore size and specific surface area of Cu-Cr catalysts prepared by different methods
由表1可看出,以Cu(OH)2沉淀与硝酸铬溶液蒸发水解凝胶法制备的催化剂b的比表面积和孔体积最小,分别为8.2 m2/g和0.038 mL/g,当在该凝胶制备体系中添加草酸后获得的催化剂c的比表面积和孔体积增大到20.6 m2/g和0.106 mL/g,结合催化剂XRD分析结果,推断这可能是由于凝胶制备体系中引入了草酸抑制CuCrO4形成的缘故。对比共沉淀法制备催化剂a与还原性蒸发水解凝胶法制备的催化剂d和e的孔结构表征数据可以看出,催化剂d和e的比表面积和孔体积均明显高于催化剂a。结合催化剂XRD分析结果推测,这可能是由于共沉淀法制备催化剂物相中含有一定量的CuCr2O4,而还原性蒸发水解凝胶法制备的催化剂物相主要为CuO和无定型Cr2O3,且晶粒较小,分布相对均匀的缘故。
图3为不同方法制备的催化剂的N2吸脱附曲线和孔径分布情况。由图3各曲线可以看出,催化剂的孔道结构均归属于H4型狭缝状孔,孔径分布范围宽,且平均孔径相差不大。这说明催化剂的孔主要由氧化物晶粒间缝隙构成,催化剂的比表面积大小主要取决于氧化物的粒径尺寸和分散状态,不同方法制备的催化剂孔结构分析数据与XRD分析结果相吻合。

图3 不同方法制备的铜铬催化剂的(a)N2吸脱附曲线和(b)孔径分布Fig.3 N2 adsorption-desorption curve (a) and pore size distribution (b) of Cu-Cr catalysts prepared by different methods
2.2 铜铬催化剂PBA加氢性能
2.2.1 PBA加氢反应结果
表2为不同方法制备的铜铬催化剂催化PBA加氢反应结果。2-丙基庚醛(PHA)和2-丙基-2-庚烯醇(Enol)是PBA加氢的中间产物。
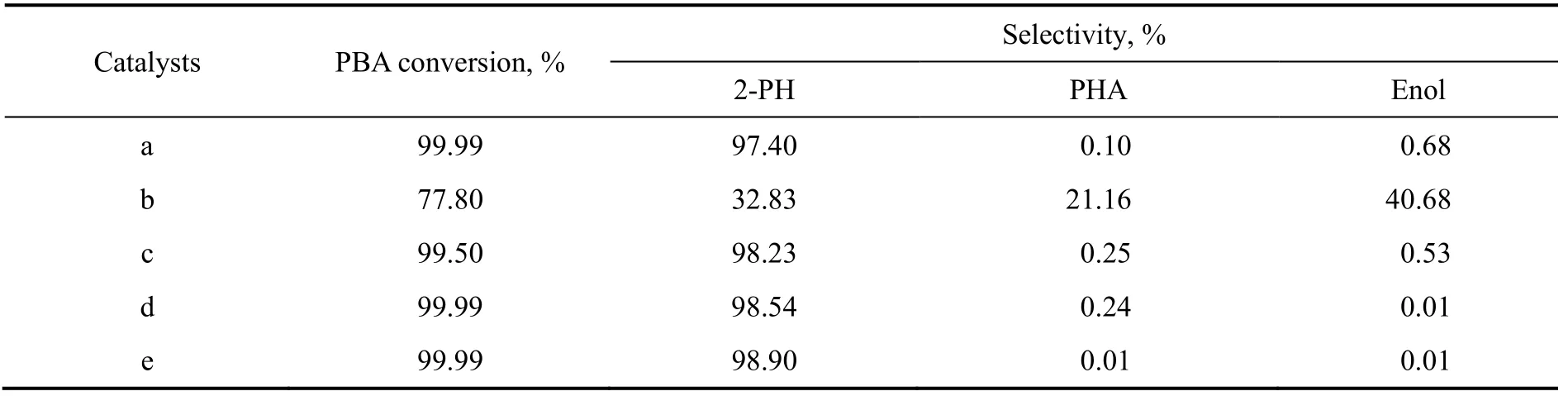
表2 不同方法制备的铜铬催化剂的PBA加氢性能Table 2 PBA hydrogenation performance of Cu-Cr catalysts prepared by different methods
由表2可知,催化剂b对PBA加氢转化率和目标产物2-PH选择性最低,仅为77.80%和32.83%,主要是由于催化剂b的比表面积较小,CuO晶粒尺寸较大,可接触的加氢活性中心数目较少,因此对碳碳双键和碳氧双键的加氢效果相对较差。另外,由于碳氧双键上的氧原子具有较大的电负性,电子云密度偏向于氧,因此在铜基催化剂上,优先吸附碳氧双键,产物中烯醇的选择性高于PHA。与催化剂b相比,催化剂a和c无论是对PBA的加氢活性还是2-PH选择性均有大幅度提高,PBA转化率均大于99.50%,但产物中均含有少量PHA和烯醇等加氢中间产物。而催化剂d和e对PBA加氢转化率均接近100%,尤其是催化剂e,其加氢产物中未检测到PHA和烯醇等PBA加氢中间产物,表明催化剂e具有优异的碳碳双键、碳氧双键加氢活性和对目标产物2-PH选择性。这说明具有大比表面积,CuO晶粒尺寸较小且分散均匀的CuO-Cr2O3复合氧化物是PBA加氢制2-PH的优良催化剂。这也证明了采用还原性蒸发水解凝胶法制备CuO-Cr2O3复合氧化物催化剂是合适的。
2.2.2 催化剂稳定性实验
在实验室规模上放大21倍,制备200 mL催化剂e进行稳定性测试,反应温度为150~160 ℃,反应压力为2.8 MPa,氢气流量为20 L/h,PBA进料量为70 g/h,循环量为1 050~1 400 g/h。反应结果如图4所示,经过2 000 h的评价实验(其中前500 h为反应温度条件实验)PBA转化率始终保持在99.99%以上,2-PH选择性稳定在98%以上,平均在98.50%。长周期评价实验结果表明,催化剂e具有优异的PBA加氢活性和活性稳定性。
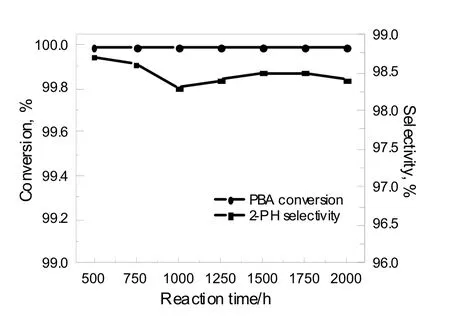
图4 催化剂稳定性实验Fig.4 Stability test of catalyst
3 结 论
本工作通过研究不同制备方法对铜铬催化剂的结构与PBA加氢性能的影响,得出以下结论:
a)与共沉淀法相比,蒸发水解凝胶法可以消除CuO-Cr2O3催化剂制备过程所含金属离子,尤其是含金属铬离子废液的排放;蒸发水解凝胶法制备CuO-Cr2O3催化剂过程中还原剂的引入可以改变催化剂的物相组成以及表面结构。
b)与共沉淀法相比,还原性蒸发水解凝胶法可以获得比表面积更大,CuO晶粒分散均匀的CuO-Cr2O3催化剂,适量草酸的引入抑制了CuCrO4等物种的形成,有利于形成物化性质均一的CuO-Cr2O3催化剂。
c)还原性蒸发水解凝胶法制备的CuO-Cr2O3催化剂对PBA加氢反应具有优异的加氢活性和活性稳定性。
