黄连素对人胃癌细胞SGC7901凋亡影响的研究
2020-07-09李舒杨从意鲁艳平徐靖雯胡敬宝
李舒 杨从意 鲁艳平 徐靖雯 胡敬宝


摘要 目的:探討黄连素对人胃癌细胞SGC7901凋亡的影响。方法:MTS法检测不同浓度的黄连素(100、150、200 μmol/L)对胃癌细胞的抑制作用,Hoechst 33258染色检测不同浓度的黄连素(100、150、200 μmol/L)对细胞凋亡的影响;Real Time Q-PCR检测胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax的mRNA表达;Western blot检测胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax的蛋白表达。结果:不同浓度的黄连素能显著降低人胃癌细胞SGC701活性(P<0.05,P<0.01),促进其凋亡,升高Cleaved Caspase-3、Bax的mRNA和蛋白表达水平(P<0.05,P<0.01),降低Bcl-2的mRNA和蛋白表达水平(P<0.05,P<0.01)。结论:不同浓度的黄连素可诱导胃癌细胞凋亡,其机制可能与升高Cleaved Caspase-3、Bax的表达,降低Bcl-2的表达有关。
关键词 黄连素;SGC7901细胞;细胞凋亡;Cleaved Caspase-3、Bcl-2、Bax;抗肿瘤;机制研究
Effects of Berberine on Apoptosis of Gastric Cancer Cell Line SGC7901
LI Shu1,YANG Congyi1,LU Yanping1,XU Jingwen2,HU Jingbao1
(1 Bao′an Hospital of Traditional Chinese Medicine,Shenzhen 518101,China; 2 Guangzhou University of Chinese Medicine,Guangzhou 510405,China)
Abstract Objective:Current studies showed that berberine had a certain anti-tumor effect,but its antitumor mechanism did not have depth study yet.This study discussed that the influence of berberine on human gastric cancer cells SGC7901′s apoptosis.Methods:The inhibition of gastric cancer cells induced by different concentrations of berberine(150 μM,200 μM,250 μM)was determined by MTS.Hoechst 33258 staining method detected the apoptosis of gastric cancer cells induced by different concentrations of berberine(100 μmol/L,150 μmol/L,200 μmol/L).The mRNA and protein expressions of Cleaved Caspase-3,Bcl-2,and Bax of gastric cancer cells were assessed by Real Time Q-PCR and western blot.Results:Different concentrations of berberine could significantly reduce the human gastric cancer cells SGC701′s activity,promote its apoptosis,increase mRNA and protein expressions of Cleaved Caspase-3,Bax,and reduce the mRNA and protein expressions of Bcl-2.Conclusion:Different concentrations of berberine could reduce gastric cancer cells apoptosis.The mechanism might be elevated the expressions of Cleaved Caspase-3,Bax and reduced the expression of bcl-2.
Keywords Berberine; SGC7901; Cell apoptosis; Cleaved Caspase-3; Bcl-2; Bax; Anti-tumor; Mechanism research
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.01.011
黄连素(Berberine)是中药黄连的主要提取物,研究证实具有广泛的生物学作用。近年来大量的实验证实黄连素具有抗肿瘤的作用[1],对肺癌、食管癌、肝癌、乳腺癌等多种肿瘤细胞有一定的抑制作用。Ahmadiankia等[2]发现,10、20、40、80 μmol/L的黄连素可降低乳腺癌细胞MCF-7的迁移能力,并可下调某些趋化因子受体的mRNA表达水平。研究[3]发现,黄连素可通过抑制N乙酰转移酶活性而抑制肺癌细胞A549的增殖。Yip NK[4]发现黄连素可通过升高Bax基因的表达降低肝癌细胞的活性,但其对胃癌细胞是否有抑制作用还有待进一步研究。本研究拟以人胃癌细胞SGC7901为靶细胞,观察不同浓度的黄连素对其凋亡发挥的作用,为临床运用提供一些参考。
1 材料与方法
1.1 材料
1.1.1 细胞 人胃癌细胞株SGC7901由广州中医药大学岭南医学研究中心中医内科实验室赠予。
1.1.2 试剂和仪器 黄连素(纯度≥98%)购自美国sigma公司,批号LRAA9232。1640培养基购自美国Gibico公司,批号LRAA9232;胎牛血清购自美国Biological Indμstries公司,批号1608796;青霉素、链霉素购自美国Gibico公司,批号1829771;胰酶购自美国Gibico公司,批号1846496。Cleaved Caspase 3一抗购自Cell Signaling Technology公司,批号21;Bcl-2一抗购自R&D System公司,批号CDVT0116122;Bax一抗购自ABclonal公司,批号9002211001;所有二抗均购自美国ABclonal公司;PCR试剂盒购自瑞士Roche公司,批号16241700。
1.2 方法
1.2.1 细胞培养 人胃癌细胞SGC7901常规置于1640完全培养基,内含10%胎牛血清,1%青霉素、链霉素,在37 ℃,体积分数为5% CO2条件下培养。
1.2.2 MTS筛选黄连素干预SGC7901的最佳浓度取对数生长期的胃癌细胞,制成2×103/mL的单细胞悬液,100 μL/孔接种于96孔板中,边缘用PBS填充,细胞贴壁后吸弃培养液,对照组加入1640培养基100 μL,实验组分别添加含不同浓度黄连素(100、150、200 μmol/L)的培养液100 μL,每组接种10个副孔,分别培养24、48、72 h后,每孔加入MTS/PMS混合液20 μL,继续避光孵育4 h后用酶标仪检测490 nm波长的吸光度。
1.2.3 Hoechst 33258染色检测细胞凋亡情况 取对数生长期的胃癌细胞接种于6孔板中,待细胞长至80%满时吸弃培养液,对照组加入1640培养基2 mL,实验组分别添加含不同浓度黄连素(100、150、200 μmol/L)的培养液2 mL继续培养24 h。吸去培养液后加入固定液,固定5 min,PBS清洗2遍后加入Hoechst 33258染色液,染色5 min,PBS再次清洗2遍后滴一滴抗荧光淬灭液,荧光显微镜下观察结果。凋亡细胞的细胞核、细胞质呈浓染致密荧光,而正常细胞的细胞核、細胞质呈均匀的荧光。
1.2.4 Real Time Q-PCR检测胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax的表达 取生长良好的MSC,调整细胞浓度为1×106/mL接种于60 mm培养皿,待细胞长至80%时换液,实验组分别加入含100、150、200 μmol/L黄连素的培养液,对照组只加1640培养基,培养24 h后,用PBS洗细胞3次,采用Trizol法提取总RNA。PCR反应体系:cDNA 5 μL、上游引物(10 μmol/L)0.5 μL、下游引物(10 μmol/L)0.5 μL、2x SYBR Green PCR Master Mix 10 μL、dH2O 4 μL,反应条件:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 32 s读板,循环40次,反应完成后,计算机自动分析荧光信号,并将其转换为Ct值,根据2-△△Ct计算Cleaved Caspase-3、Bcl-2、Bax的相对表达量。引物序列见表1。
1.2.5 Western blot检测胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax的表达 取对数生长期的胃癌细胞,接种于6孔板内,待细胞长至80%时换液,实验组分别加入含100、150、200 μmol/L黄连素的培养液,对照组只加1640培养基,培养24 h后收集细胞,提取细胞总蛋白,BCA法检测蛋白浓度后进行SDS-PAGE电泳,电转,封闭后4 ℃孵育一抗过夜,TBST洗膜后加入相应二抗稀释液37 ℃孵育1 h后显影。并用Image J软件分析灰度值。
1.3 统计学方法 采用SPSS 23.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,采用One-Way ANOVA检验。以P<0.05为差异有统计学意义。
2 结果
2.1 黄连素对胃癌细胞存活率的影响 不同浓度的黄连素(100、150、200 μmol/L)干预24~72 h后,均对胃癌细胞存活有一定的抑制作用,且伴随作用浓度及作用时间的增加,胃癌细胞的存活率越低,与对照组比较差异有统计学意义(P<0.05,P<0.01),表明黄连素对降低胃癌细胞存活率有一定的浓度与时间依赖性。见图1。
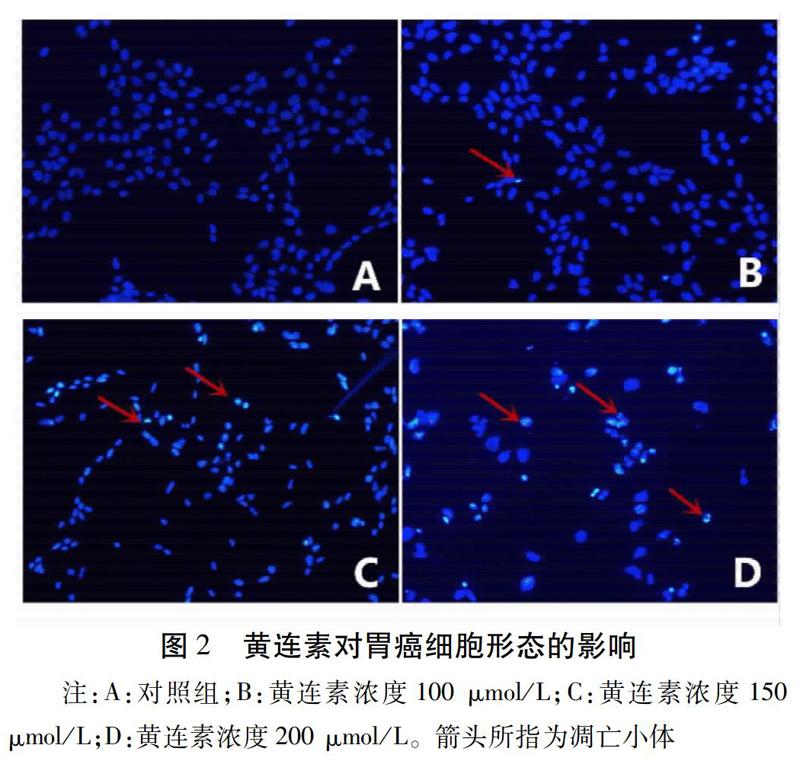
2.2 黄连素对胃癌细胞形态的影响 不同浓度的黄连素(100、150、200 μmol/L)干预24 h后,对照组细胞的细胞核边缘光滑整齐,呈均匀的淡蓝染色,黄连素组细胞的细胞核边缘不整齐,核固缩,呈致密浓染,并伴随黄连素的浓度增高,细胞核的改变更明显。见图2。
2.3 黄连素对胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax表达mRNA的影响 与对照组比较,随着黄连素给药浓度的增加,胃癌细胞中Cleaved Caspase-3、Bax的mRNA表达水平逐渐升高,Bcl-2的mRNA表达水平逐渐降低,呈明显的浓度依赖性,差异有统计学意义(P<0.05,P<0.01)。见图3。
2.4 黄连素对胃癌细胞中Cleaved Caspase-3、Bcl-2、Bax蛋白表达的影响 与对照组比较,随着黄连素给药浓度的增加,胃癌细胞中Cleaved Caspase-3、Bax蛋白的表达水平逐渐升高,Bcl-2蛋白的表达水平逐渐降低,呈明显的浓度依赖性,差异有统计学意义(P<0.05,P<0.01)。见图4。
3 讨论
胃癌是起源于胃上皮的恶性肿瘤,是最常见的消化道恶性肿瘤之一,在全世界有很高的发生率和死亡率[5-6]。研究表明,黄连素的抗肿瘤功能是通过诱导细胞发生凋亡实现的[7],而细胞的凋亡又与Bcl-2家族和Caspase家族密切相关。
细胞凋亡是各种内外因素作用下细胞发生的程序性死亡过程,是维持机体内环境稳定的重要机制,其与癌症等诸多疾病的发生发展密切相关。诱导肿瘤细胞凋亡是治疗癌症的重要途径之一[8]。Caspase家族可通过线粒体通路调节细胞凋亡,而Caspase-3是Caspase家族重要的凋亡执行者,属于凋亡执行因子,位于级联反应的下游[9],活化后的Caspase-3是凋亡进入不可逆阶段的标志[10]。Cleaved Caspase-3是Caspase-3活化过程中产生的活性片段,其表达水平可反应Caspase-3活性程度及细胞凋亡水平[11]。Bcl-2家族是线粒体通路的重要环节,可调节线粒体外膜的通透性,从而释放细胞色素C,导致细胞凋亡[12]。Bax位于细胞质,其可在凋亡程序启动后助细胞色素C释放,从而激活其下游的Caspase家族,促进凋亡[13]。Bcl-2位于线粒体膜,其作用是稳定线粒体膜,阻止释放细胞色素C,进而抑制凋亡[14-15]。
为了探讨黄连素抑制人胃癌细胞SGC7901的作用机制,本实验首先通过MTS法观察不同浓度黄连素对胃癌细胞活性的抑制作用,随后通过Hoechst 33258染色法观察其对细胞形态的影响,再通过Real Time Q-PCR和Western Blot检测不同浓度的黄连素对胃癌细胞基本和蛋白的表达水平。本实验结果表明,超过100 μM的黄连素可以显著降低人胃癌细胞SGC7901的活性,且有明显的浓度与时间依赖性;黄连素还可以显著上调Cleaved Caspase-3和Bax的表达,下调Bcl-2的表达,且随着其浓度的升高,表达差异越显著。表明黄连素诱导人胃癌细胞SGC7901凋亡可能是通过活化Bax和Bcl-2,激活Caspase-3通过线粒体途径实现的。
综上所述,黄连素对人胃癌细胞SGC7901增殖有较好的抑制作用,可能通過线粒体途径诱导其凋亡,为中医药在临床的运用提供了新的方向。
参考文献
[1]Ayati SH,Fazeli B,Momtazi-Borojeni A A,et al.Regulatory effects of berberine on microRNome in Cancer and other conditions[J].Crit Rev Oncol Hematol,2017,116(5):147-158.
[2]Ahmadiankia N,Moghaddam HK,Mishan MA,et al.Berberine suppresses migration of MCF-7 breast cancer cells through down-regulation of chemokine receptors[J].Iran J Basic Med Sci,2016,19(2):125-131.
[3]Xi S,Chuang K,Fang K,et al.Effect of berberine on activity and mRNA expression of N-acetyltransferase in human lung cancer cell line A549[J].J Tradit Chin Med,2014,34(3):302-308.
[4]Yip NK,WS Ho.Berberine induces apoptosis via the mitochondrial pathway in liver cancer cells[J].Oncol Rep,2013,30(3):1107-1112.
[5]Kurihara,Nakazawa K,Miyamoto H,et al.A Case of Metachronous Metastasis to the Pancreas from Ascending Colon Cancer after Subtotal Stomach-Preserving Pancreaticoduodenectomy(SSPPD)[J],Gan To Kagaku Ryoho,2019,46(1):136-138.
[6]Cui Y,Wen W,Zheng T,et al.Use of Antihypertensive Medications and Survival of Breast,Colorectal,Lung,or Stomach Cancer[J].Am J Epidemiol,2019,188(8):106.
[7]Zhuo Y,Chen Q,Chen B,et al.Berberine promotes antiproliferative effects of epirubicin in T24 bladder cancer cells by enhancing apoptosis and cell cycle arrest[J].Int J Clin Pharmacol Ther,2017,55(1):32-40.
[8]Dillon CP,Green DR.Molecular Cell Biology of Apoptosis and Necroptosis in Cancer[J].Adv Exp Med Biol,2016,930:1-23.
[9]Tsai YH,Lin JJ,Ma YS,et al.Fisetin Inhibits Cell Proliferation through the Induction of G0/G1 Phase Arrest and Caspase-3-Mediated Apoptosis in Mouse Leukemia Cells[J].Am J Chin Med,2019,47(4):841-863.
[10]Zhao L,Zhu Z,Yao C,et al.VEGFC/VEGFR3 Signaling Regulates Mouse Spermatogonial Cell Proliferation via the Activation of AKT/MAPK and Cyclin D1 Pathway and Mediates the Apoptosis by affecting Caspase 3/9 and Bcl-2[J].Cell Cycle,2018,17(2):225-239.
[11]Buschhaus JM,Humphries B,Luker KE,et al.A Caspase-3 Reporter for Fluorescence Lifetime Imaging of Single-Cell Apoptosis[J].Cells,2018,7(6):1-20.
[12]Vinod Prebhu V,Elangovan V,Niranjali Devaraj S,et al.Targeting apoptosis by 1,2-diazole through regulation of EGFR,Bcl-2 and CDK-2 mediated signaling pathway in human non-small cell lung carcinoma A549 cells[J].Gene,2018,679:352-359.
[13]Pu X,Storr SJ,Zhang Y,et al.Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J].Apoptosis,2017,22(3):357-368.
[14]劉卜玮,蔡明成,杨雪,等.microRNA调控细胞凋亡的研究进展[J].生理科学进展,2018,49(4):309-314.
[15]Chiang CH,Yeh CY,Chung JG,et al.Amentoflavone Induces Apoptosis and Reduces Expression of Anti-apoptotic and Metastasis-associated Proteins in Bladder Cancer[J].Anticancer Res,2019,9(7):3641-3649.
(2018-12-04收稿 责任编辑:芮莉莉)
基金项目:广东省青年创新人才类项目自然科学类基金(2016KQNCX018);高水平大学建设项目(A1-AFD018171Z11087)作者简介:李舒(1990.05—),女,博士,医师,研究方向:中医药防治消化系统疾病,E-mail:suelee525@126.com通信作者:胡敬宝(1965.07—),男,硕士,主任医师,研究方向:中西医结合治疗消化道疾病,E-mail:rzzyhjb@126.com
