仙灵骨葆制剂上市后临床安全性真实世界多维度研究设计
2020-07-09王志飞彭时雨谢雁鸣黎元元刘峘廖星张寅
王志飞 彭时雨 谢雁鸣 黎元元 刘峘 廖星 张寅

摘要 藥品上市后临床安全性研究应开展真实世界的多维度设计,充分考虑多种来源的数据、证据及证据的整合。论文以仙灵骨葆制剂的上市后临床安全性研究设计为例,报告了国家不良反应监测中心自发呈报系统数据、医院信息系统数据、文献数据的统计分析以及数据、分析结果和证据的整合,通过证据整合发现:仙灵骨葆制剂的一般ADR主要是胃肠系统损害,表现为恶心、呕吐、口干、便秘、腹泻等;严重ADR主要表现为肝胆系统损害,表现为肝功能异常、肝酶升高、肝细胞损害等;过敏反应有时候表现为一般ADR,有时候表现为严重ADR;肝功能异常具有性别差异,女性比例偏高;肝功能异常出现3~7 d和15 d及以2个发病高峰,提示可能存在不同的发病机制;恶心、呕吐和胃功能紊乱是仙灵骨葆制剂的ADR预警信号。论文进一步讨论了回顾性数据对于前瞻性研究设计的支撑,初步明确了安全性真实世界多维度研究设计中主要数据源的优势和不足,从安全性证据的角度分析了数据之间的互补性和相应研究的时序性。
关键词 安全性评价;多维度设计;真实世界;仙灵骨葆制剂;证据整合;上市后评价;自发呈报系统;医院信息系统
Real World Multi-dimensional Design of Clinical Safety Research on Xianling Gubao Preparation
WANG Zhifei1, PENG Shiyu2, XIE Yanming1, LI Yuanyuan1, LIU Huan1, LIAO Xing1, ZHANG Yin1
(1 Institute of Basic Research in Clinical Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China; 2 The Beijing Tongzhou District Combine Traditional Chinese and Western Medicine Hospital, Beijing 101100, China)
Abstract The clinical safety research on post-marketing medicines should carry out the multi-dimensional design of the real world study, and fully consider the data, evidence from multiple sources, and fully consider the evidence integration. This paper reported the clinical safety research design of Xianling Gubao capsule, reported the analysis of spontaneous reporting system data, hospital information system data, and literature data. Through the integration of safety data and evidence, it was found that the general ADR of Xianling Gubao capsule is mainly gastrointestinal system damage, which is manifested as nausea, vomiting, dry mouth, constipation and diarrhea, etc.; serious ADR is mainly manifested in liver and gall system damage, which is manifested in liver function abnormality, liver enzyme elevation, liver cell damage, etc.; anaphylaxis is sometimes manifested in general ADR, sometimes in serious ADR; liver function abnormality has gender difference, and the proportion of women is on the high side; liver function abnormality occurs in 3~7 days, 15 days and two peak periods, suggesting that there may be different pathogenesis. Nausea, vomiting and gastric dysfunction are the ADR warning signals of Xianling Gubao capsule. The paper further discussed the support of retrospective data for prospective research design, initially clarified the advantages and disadvantages of the main data sources in the security real world multi-dimensional research design, and analyzed the complementarity between the data and the timing of the corresponding research from the perspective of security evidence.
Keywords Safety evaluation; Multi-dimensional design; Real world; Xianling Gubao capsule; Evidence integration; Evaluation of post-marketing; Spontaneous reporting system; Hospital information system
中图分类号:R242文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.01.002
确定药品临床应用的安全性,是上市后研究的首要任务。药品上市前的临床研究也会评估其安全性,但是由于新药临床试验期间用药单一并用于特定目标人群和针对单一的适应证,且样本量相对较小,患者受试范围较窄,观察期限较短,因此一些罕见或迟发的不良反应/事件(Adverse Drug Reactions/Adverse Drug Events,ADR/ADE)难以观察到[1]。确定药物在临床应用中的真实风险,必须在真实世界中观察药物的安全性,观察其在广泛的人群中、针对诸多复杂疾病、合并用药、长期用药等情况下的ADR/ADE[2]。研究实践中,针对上市药品ADR/ADE的研究,常采用多源数据相互印证的作法,从多个维度设计,强调研究的时序性和互补性[3],逐步增强对药品风险真实性的把握度。在这一理念的指导下,开展了仙灵骨葆制剂上市后安全性研究的方案设计,以回顾性研究的结果支撑前瞻性研究的设计,取得较好的效果。现报道如下,以期能为同类研究所借鉴。
1 不同来源的安全性数据分析
1.1 国家不良反应监测中心自发呈报系统数据分析
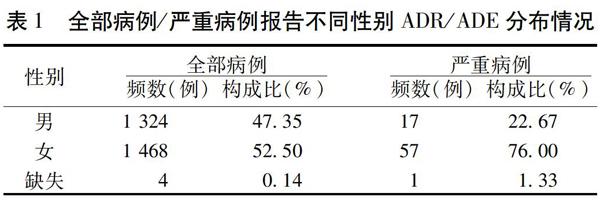
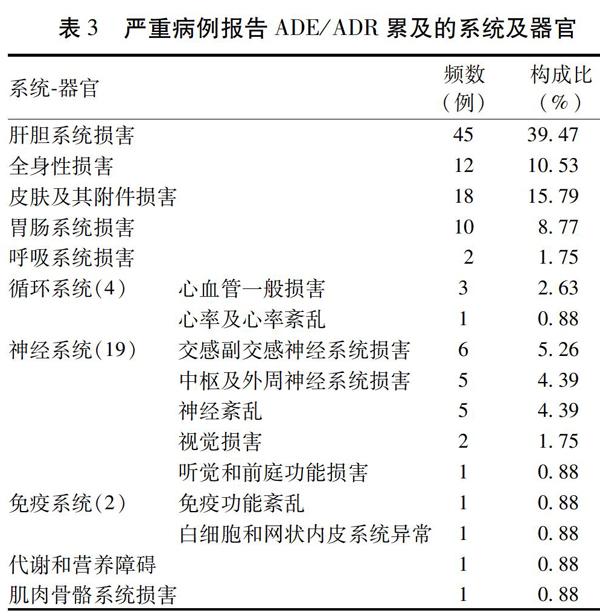
国家不良反应监测中心自发呈报系统(Spontaneous Reporting System,SRS)是我国目前药物上市后安全性研究最重要的数据源,具有监测范围广、参与人员多、不受时空间限制等优点[4],且可以与产品的销售数据相对应。2009年,国家药品不良反应监测中心开始将SRS数据发给相应的制药企业,鼓励企业开展研究,以制定措施提高药品的安全性。本研究的SRS数据来自制药企业,为2004年1月1日至2016年7月21日国家药品不良反应监测中心收到的仙灵骨葆制剂ADR/ADE,共计2 796例,其中胶囊2 455例,片剂302例,颗粒剂0例(该剂型未上市销售),未明确剂型者39例,其中肝损伤患者67例;同时,制药企业还提供了同期的销售数据。根据《世界卫生组织药品ADR术语集》(WHO-ART)对ADR名称及累及系统进行统一的数据编码[5],描述分析了全部/严重ADR/ADE的上报情况、ADR/ADE特征、人群特点、用药特点,采用比例报告比法(Proportion Reporting Ratio,PRR)和贝叶斯置信度传播神经网络法(Bayesian Confidence Propagation Neural Network,BCPNN)挖掘药物警戒信号[6]。结果发现:1)ADR/ADE病例上报逐年增加;严重ADR/ADE上报也呈增长趋势,但与销售数据持平;肝损伤病例上报在2014年达到顶峰,而后逐渐下降。2)与医院信息系统真实世界数据结合分析,全部病例报告ADR/ADE的性别分布(男:女=47∶53)与临床用药者的性别分布(男:女=44∶56)基本相同,但无论全部病例还是严重病例,女性都多于男性,相对于全部病例,严重病例报告中女性比例明显升高。见表1。3)与医院信息系统真实世界数据结合分析,ADR/ADE患者年龄(中位数56岁)与用药人群年龄(中位数57岁)基本一致,用药患者45岁以上占比近80%,与ADR/ADE患者尤其是严重病例报告年龄分布基本一致;但是与用药人群基础数据相印证,严重ADR/ADE病例呈现出年龄越高越容易发生的趋势。4)全部病例报告恶心、皮疹、瘙痒、胃功能紊乱、呕吐占比都超过10%,提示ADE/ADR主要为胃肠功能损害和皮肤过敏反应。见表2。严重ADR/ADE超过10%的只有肝功能异常,说明严重ADR/ADE主要是肝胆系统损害。见表3。5)ADR/ADE病例超过一半发生于2 d之内,间隔时间越长构成比越低,严重病例报告中,15 d及以上占比高达57.33%,14 d以下的ADR/ADE占比近90%;严重ADR/ADE占比超过40%,患者出现肝损伤的时间呈现双峰,即3~7 d和15 d以上。6)对出现频次最多的10种ADR/ADE表现(皮疹、瘙痒、恶心、呕吐、寒战、胃功能紊乱、头晕、发热、过敏反应、气胸)采用PRR算法和BCPNN算法进行分析,并应用倾向评分法对混杂因素进行控制,结果恶心、呕吐、胃功能紊乱是仙灵骨葆胶囊/片较稳定的预警信号。
1.2 医院信息系统数据分析
医院信息系统(Hospital Information System,HIS)数据来自全国24家医院,为2002年至2015年的住院患者数据[7],共10 765例。采用国际疾病分类(International Classification of Diseases,ICD)第十次修订版编码疾病诊断[8],采用药物的解剖学、治疗学及化学分类法(Anatomical Therapeutic Chemical,ATC)编码西药[9],采用医保编码对中成药进行标准化。对用药特征的描述发现:1)使用仙灵骨葆的患者年龄偏大,中位数为57岁,45岁以上患者占比达76.11%。2)用药人群的性别分布女性约为男性的1.28倍,但男性急诊入院比例约为女性急诊入院比例的2倍。3)患者主要以骨科入院;住院天数集中在14~28 d,占比41.47%;西医诊断以各种骨折、关节脱位、骨关节病、骨质疏松等为主;中医证候诊断以肝肾阴虚、瘀血阻滞为主。4)绝大多数患者(98.21%)服用3粒/次;绝大多数患者服用5~6粒/d,部分患者服用7~10粒/d。5)疗程的中位数是18 d,其中14~28 d最多。6)合并用药主要为活血化瘀剂、抗生素类药和解热镇痛抗炎药。7)以同类药物为对照,仙灵骨葆制剂10 765例中肝功能异常8例,对照组12 826例中肝功能异常4例。筛选出30个可能的混杂因素,计算其对分组的影响程度,采用倾向评分法控制混杂因素[10],倾向评分未能控制的混杂因素作为协变量处理,计算带协變量的倾向评分加权logistic回归处理变量的回归系数以及对该系数进行检验(P>0.05),认为观察组的肝功能异常与对照组比较,差异无统计学意义。8)采用SOMTE抽样+Logistic回归的方法分析肝功能影响因素[11],结果发现年龄、疗程、合并疾病和合并用药可能会对患者肝功能产生影响。
1.3 文献数据分析
检索Cochrane Library、PubMed、EMBASE、The Web of Science、Clinical trials.gov、中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、万方数据库[12],获得745篇文献,最终纳入与安全性相关的文献156篇(包括167项研究),其中随机对照试验117篇,半随机对照试验11篇,非随机对照试验10篇,病例系列11篇,个案报告7篇。7 496例患者使用仙灵骨葆胶囊,累计发生ADR共377例,严重ADR 4例,其中包含1例死亡病例,1例脑血管意外,1例皮肤过敏反应和1例胃肠道不适;轻度ADR中最常见为胃肠损害。
2 研究数据和分析结果的整合(多维度的整合)
多维度方案设计的目的在于各种来源数据报道的ADR/ADE之间的相互印证[13]。SRS是我国目前药物上市后安全性数据的主要来源,数据规模大、监测范围广、参与人员多,具有不可替代的优势;HIS数据是真实临床的第一手记录,随着医疗信息化的发展,其科研价值与日俱增;文献是各种研究的荟萃,是获知相关研究前沿进展的主要渠道,更是发现罕见或偶发ADR的重要线索。
SRS数据和文献数据均可以获得ADR/ADE的症状表现和构成比,2个数据相互印证,对于初步确定仙灵骨葆制剂的ADR表现具有重要意义。
由表5可见,仙灵骨葆制剂的ADR表现主要包括恶心、胃肠功能紊乱、便秘、皮疹、腹泻、呕吐、口干、腹胀、潮红、头晕、返酸、腹痛、心悸、乏力、头痛、憋气、肝功能异常等。
HIS数据则从另外一个维度描述了仙灵骨葆制剂临床应用的具体细节,这是对SRS数据的最有用补充。SRS数据只反映了ADR发生的绝对數量,但是这一数量产生的用药人群基础和临床用药方式方法,却无法从SRS数据中获悉。只有SRS数据与HIS数据结合起来,两者相互印证,才能更深入理解ADR绝对数量所提示的用药风险。
综合SRS、HIS和文献数据发现:1)仙灵骨葆制剂的一般ADR主要是胃肠系统损害,表现为恶心、呕吐、口干、便秘、腹泻等;严重ADR主要表现为肝胆系统损害,表现为肝功能异常、肝酶升高、肝细胞损害等;另外过敏反应,有时候表现为一般ADR,有时候表现为严重ADR。2)仙灵骨葆制剂的一般ADR集中于45~64岁,严重ADR随年龄增长而增长;严重ADR女性比例偏高。3)恶心、呕吐和胃功能紊乱是较稳定的ADR预警信号。4)肝功能异常的发生在时间上呈现双峰表现,3~7 d出现1个发病高峰、15 d及以上出现1个发病高峰,提示可能存在不同的发生机制。
3 小结
3.1 药品上市后安全性研究应开展多维度的方案设计
循证医学(Evidence-based Bedicine,EBM)强调“证据体”的概念,即证据应由多种研究方法、多种来源的证据构成,而非仅限于某一种研究类型所获得的证据[14-15]。临床医学研究的目的是发现真实的效应,对于有效性研究来说,这往往是一个逐步确证的过程:临床实践中基于对个体的观察积累经验,形成假说;在假说的指引下开展更多观察,修正假说;采用较易实施的回顾性研究,初步验证假说;采用前瞻性队列研究、非随机对照试验等,进一步验证假说;采用严格设计的随机对照试验,最终验证假说。
对药物安全性的确认也是一个把握度由低到高的过程,但是无论从研究理念还是从试验设计上都与有效性评价不同。有效性评价针对人群中的大概率事件,因此要通过统计学发现规律;而安全性评价的研究对象往往被归于偶然事件而被统计学所忽略。现有质量评级体系中,安全性研究的证据级别往往不高,但这并不意味着其临床意义小;同时,如果多个临床证据指向同一安全性事件,则该事件的真实性大大增加。因此,安全性评价需要从多源证据中找到线索的相互印证和统一指向,以此来发现药物的ADR。
主动监测是目前获得中药ADE发生率的最有效方法,但由于前瞻性研究费用高、周期长,试错成本高,因此必须做好前期的调研工作,为前瞻性主动监测提供充分的设计依据。本项研究中,前期对于仙灵骨葆制剂SRS、HIS和文献的研究提供了前瞻性设计中需要的关键信息,包括样本量、研究周期、观察时点、观察项目等,为成功开展安全性主动监测提供了保障。同时,主动监测由于监测时间有限、范围有限,其结果也需要SRS、HIS和文献数据的补充和完善。事实上,药品的安全性研究永无止境,应贯穿于整个生命周期[16];而贯穿整个生命周期的安全性研究,必须基于多种来源的证据,基于多源证据的整合。
3.2 回顾性数据分析支持前瞻性主动监测设计
前瞻性主动监测的优势是能够确认ADR发生率,这是对临床用药风险最直接的证据。回顾性的数据分析为前瞻性研究的方案设计提供了支持:1)计算样本量:文献报道纳入分析的165个研究,符合适应证的研究有137个。其中61个研究,2 918名患者使用了仙灵骨葆制剂,报告了249例ADR/ADE,发生率约为8.53%。超出适应证的研究有20个,约占总研究数的12%,其中11个研究,597名患者使用了仙灵骨葆制剂,报告了51例ADR/ADE,发生率为8.54%[12]。SRS数据分析,虽然没有对应的用药人群数据,但可以通过销售数据、HIS用药数据近似评估用药人群的数量,从而近似地估计ADR发生率。2)确定观察周期和观察时点:综合SRS数据和文献数据,ADR的发生距离患者开始用药,最长时间达到15个月,因此前瞻性主动监测,必须要有长期随访,随访时间应不少于15个月。另外,回顾性数据中,肝功能异常呈现双峰表现,即在3~7 d有1个发病高峰,15 d以上有1个发病高峰,而且肝功能异常往往呈现一过性,因此前瞻性主动监测一定要在3~7 d和15 d分别设置观察时点。3)确定肝功能检查:肝功能异常患者不一定出现临床症状,也可能表现为单纯肝生化指标变化。因此,前瞻性主动监测不能只针对ADR症状,还要检查肝功能,掌握患者肝生化指标变化。
3.3 开展安全性证据整合,构建安全性证据体
开展真实世界的安全性多维度设计,其目的是开展安全性多源证据的整合,从而构建安全性证据体[17]。有学者提出,根据当前可得的证据,应将前瞻性大样本长期的注册登记的医院集中监测研究视为最高级证据[18],其实不仅前瞻性的医院集中监测,前瞻性的大样本长期的主动监测均可获得总体的ADR发生率和各种一般的、新的、严重的ADR症状的表现和发生率,是评估目标药物临床用药风险最直接的证据,应成为上市后安全性证据体构建的基石。然而主动监测也存在不足,由于监测范围和时间有限,一些罕见或迟发的ADR未必能在监测期间出现,因此主动监测的证据也需要其他来源的证据作补充。SRS数据来源于全国各个医疗机构、生产企业和患者,覆盖范围广,不受监测周期限制,可有效补充主动监测证据的不足;文献研究是既往研究的综合,严重的、特殊的ADR以及针对ADR的研究,常会通过文献予以报道。这2个来源的证据,有时会指出未在主动监测中发现的ADR,虽然难以获知其ADR发生率,但常常具有十分重要的临床价值。HIS数据中一般较少安全性信息,常被用于作为ADR发生的背景数据,与主动监测、SRS或文献数据对照分析。针对HIS数据,研究者也可采用处方序列分析[19]开展疑似过敏反应的研究,或针对能反应安全性的实验室指标分析目标药物对肝[20]、肾[21]功能以及凝血功能等的影响。这些证据从不同侧面补充了前瞻性主动监测证据的不足,共同构建起安全性证据体,全面刻画了目标药物的ADR特征,为进一步控制目标药物的用药风险奠定了基础。
参考文献
[1]杨焕.新药上市前临床试验安全性数据的分析与评价[J].中国临床药理学杂志,2009,25(5):464-466,470.
[2]谢雁鸣.中医药大数据与真实世界[M].北京:人民衛生出版社,2016:19-20.
[3]王永炎,谢雁鸣,王志飞.大数据时代中药上市后数据的整合与应用[J].中国中药杂志,2013,38(18):2917-2918.
[4]王志飞,向永洋,谢雁鸣.基于自发呈报系统的喜炎平注射液不良反应风险预警研究[J].中国中药杂志,2013,38(18):3008-3012.
[5]侯永芳.乌普萨拉监测中心在Vigibase数据库中应用MedDRA术语集[J].中国药物警戒,2008,5(4):242-243.
[6]向永洋,谢雁鸣,易丹辉.药物警戒数据挖掘方法比较及其在中成药预警中的应用[J].中国中药杂志,2011,36(20):2831-2835.
[7]赵岩,章轶立,谢雁鸣,等.仙灵骨葆胶囊真实世界临床应用特征分析[J].世界中西医结合杂志,2019,14(4):455-459.
[8]邹义壮,肖春玲,韩素欣.ICD-10在我国医疗和信息系统中的应用情况[J].中国心理卫生杂志,2009,23(7):507-508.
[9]陈红斗,蒋进广,朱秀银.ATC分类编码和中成药分类编码比较分析[J].南京中医药大学学报,2013,29(6):510-513.
[10]崔伟锋,王秉权,董永书,等.倾向评分法在中医药临床研究中的应用[J].中国全科医学,2016,19(13):1591-1593.
[11]王志飞,赵维,张寅,等.基于大型前瞻性安全性监测的参附注射液不良反应影响因素分析[J].中国中药杂志,2015,40(24):4746-4751.
[12]章轶立,廖星,刘福梅,等.仙灵骨葆胶囊上市后用药安全性系统评价[J].中国中药杂志,2017,42(15):2845-2856.
[13]王永炎,王志飞,谢雁鸣.以再评价为契机的中药上市后系统研究[J].中国中药杂志,2014,39(18):3421-3423.
[14]刘建平.传统医学证据体的构成及证据分级的建议[J].中国中西医结合杂志,2007,27(12):1061-1065.
[15]陈薇,方赛男,刘建平.基于证据体的中医药临床证据分级标准建议[J].中国中西医结合杂志,2019,39(3):358-364.
[16]张靖,李红颖,耿兴超,等.药品生命周期管理最新指南介绍与安全性评价的作用浅析[J].中国药事,2018,32(6):770-774.
[17]廖星,谢雁鸣.构建中药上市后安全性评价证据体的思考[J].世界中医药,2014,9(9):1141-1144.
[18]廖星,谢雁鸣.上市后中药临床安全性循证证据体评价研究[J].中国中西医结合杂志,2017,37(1):109-114.
[19]陶庆梅,詹思延.处方序列分析与处方序列对称分析在药物流行病学中的应用[J].药物流行病学杂志,2012,21(10):517-519.
[20]王志飞,霍剑,姜俊杰,等.疏血通注射液不同剂量对肝功能影响的真实世界研究[J].中国中药杂志,2013,38(18):3068-3075.
[21]黎元元,赵敏,谢雁鸣,等.参芪扶正注射液对肾功能影响的临床实效分析研究[J].中国中药杂志,2013,38(18):3031-3038.
(2019-12-10收稿 责任编辑:徐颖)
基金项目:国家重点研发计划项目(2018YFC1707400,2018YFC1707410);中央级公益性科研院所基本业务费项目(Z0439)作者简介:王志飞(1979.11—),男,博士,副研究员,博士研究生导师,研究方向:中药上市后再评价,Tel:(010)64093205,E-mail:wzhftcm@163.com通信作者:谢雁鸣(1959.11—),女,首席研究员,博士研究生导师,研究方向:中医临床评价,Tel:(010)64093302,E-mail:ktzu2018@163.com
