毛水苏组织培养技术研究
2020-07-09刘德江
金 琼, 刘 悦, 刘德江, 申 健
(1.佳木斯大学生命科学学院, 黑龙江 佳木斯 154007; 2.牡丹江市第十五中学, 黑龙江 牡丹江 157000)
毛水苏(StachysbaicalensisFisch.ex Benth.)为唇形科水苏属多年生草本植物,别名水苏草、野紫苏、山升麻等,是国家重点保护兼蜜源植物。毛水苏分布在我国黑龙江、吉林、辽宁、内蒙、山东、山西、陕西等地,多呈零星分布[1]。毛水苏作为一种中药,全草及根入药,具有祛风解毒,止血之功效。此外,毛水苏花期长,流蜜量大,蜜色洁白透明,气味纯正芳香,低温不易凝稠结晶,其质量仅次于椴树蜜,是一种经济价值高有发展前景的蜜源植物[2]。
毛水苏喜湿润肥沃土壤,天然多分布在湿地杂草稀疏的隙地和河床边缘的河滩地,曾经是遍布三江平原的典型地域性植物[1]。然而经过多年的围垦造田,截流改河道,盲目开发湿地等,毛水苏近30年来大面积消失,濒临灭绝。在对破坏生态为代价发展经济的反思后,生态文明建设纳入国家总体战略布局。国家对三江湿地珍贵濒危植物的恢复非常重视,2016年已批复在三江湿地核心区——大佳河湿地试验区投入1 000余万元恢复毛水苏[3]。可以预见,毛水苏的恢复与发展不但可再现往年湿地盛景,在一定程度上也为东北黑蜂种群的存续繁衍提供雄厚的物质基础。
毛水苏根蘖和种子均可繁殖,但具有种子不便采收,根蘖繁殖数量有限等缺点。采用植物组织培养方法繁殖幼苗,可以缩短繁殖周期,扩大繁殖数量[4],加大其植株储备量。本试验的目的是筛选出适合毛水苏快速繁殖的组织培养技术,为湿地植被恢复及毛水苏的开发利用提供材料及技术支持。
1 材料与方法
1.1 试验材料
供试材料为野生毛水苏植株,取材于饶河县大佳河湿地。选取长势粗壮,无病虫害的植株茎段作为外植体。
1.2 试验方法
1.2.1外植体消毒处理
挑选长势一致的植株,剪去叶片,保留叶柄基部,用软毛刷加洗洁精刷洗1次,然后用自来水流水冲洗1 h,75%乙醇浸泡30 s后用无菌水冲洗3~4次[5]。最后用0.1%HgCl2溶液加5滴吐温80浸泡5 min,无菌水冲洗3~4次后备用。
1.2.2基本培养基的筛选
在WPM,MS,1/2 WPM,1/2 MS 4种培养基上分别接入茎段外植体,每种培养基接10瓶,每瓶接5个外植体,观察茎段腋芽生长情况,20 d后统计萌芽率和芽长,筛选出适宜基本培养基。
萌芽率(%)=(萌芽数/外植体的总数)×100%。
1.2.3不同植物激素对不定芽增殖的影响
在筛选出的基本培养基中分别加入6-BA(0.5,1.0,1.5 mg·L-1),NAA(0.01,0.05,0.10 mg·L-1),2,4-D(0.2,0.4,0.6 mg·L-1)及IBA(0.01,0.05,0.10 mg·L-1),将腋芽接入培养基中,每个处理接10瓶,每瓶接5个腋芽。20 d后统计芽增殖系数及芽长,筛选出较适宜的激素种类。然后进行正交试验,研究几种激素组合作用效果,正交试验因素水平见表1。
芽增殖系数=再生丛生芽总数/接种腋芽总数。
表1 正交试验因素水平

水平因 素6-BA/(mg·L-1)NAA/(mg·L-1)IBA/(mg·L-1)10.50.010.0121.00.050.0531.50.100.10
1.2.4最佳生根培养基筛选
将增殖获得的丛生芽切成1.0 cm左右高的不定芽,接种于不同的生根培养基中进行培养,每瓶接种5个不定芽,每个处理接种10瓶。选择1/2 WPS为基本培养基,分别附加3个IBA浓度梯度0.05、0.10、0.15 mg·L-1,3个NAA浓度梯度0.10、0.20、0.30 mg·L-1,共6个处理。30 d后统计生根率、生根数、根长、芽长以及生长情况等。
以上增殖培养基附加蔗糖30 g·L-1,生根培养基附加蔗糖20 g·L-1,琼脂7 g·L-1,pH调至6.0,121 ℃灭菌20 min。培养温度为(25±2)℃,光照强度为1 200~1 500 lx,光照时间12 h·d-1[6]。
1.2.5生根苗与不生根苗移栽比较
将生根良好的组培苗从培养室取出,置于室内光照下炼苗3 d,打开瓶口2 d后进行移栽。从瓶中小心取出小苗,用20 ℃左右温水洗净在根系上附着的培养基,然后迅速移栽入塑料穴盘中。移栽基质为田园土∶粗沙∶腐殖土=1∶1∶1。移栽初期注意增大湿度并遮阴,移栽30 d后调查移栽成活率、株高及生长情况。将未经过生根培养的苗同时进行移栽,比较生根苗和不生根苗的生长差异。
1.3 数据分析
采用Excel 2007软件进行数据处理,采用SPSS 16.0软件进行统计分析。
2 结果与分析
2.1 基本培养基的筛选结果
接种20 d后,观察茎段腋芽生长情况,结果见表2。
4种基本培养基中的毛水苏均可从叶腋处长出不定芽,由于培养基中未添加植物激素,所以没有出现增殖现象。由表2可知:WPM培养基的萌芽率最高,为188.00%,显著高于其他3种培养基。WMP和MS培养基的芽长无显著性差异,但显著高于另外2种培养基。WPM培养基中芽长最大,为2.86 cm。从长势上看,WPM培养基中的不定芽生长得较粗壮,颜色浓绿。1/2 WPM培养基中的不定芽颜色黄白,茎纤细。MS和1/2 MS培养基中的不定芽生长得纤细,颜色黄绿到黄白,且有玻璃化现象出现。所以,选择WPM培养基作为基本培养基。
表2 不同基本培养基对毛水苏腋芽生长的影响

基本 培养基 萌芽率/%芽长/cm生长状况 WPM188.00±4.00a2.86±0.15a颜色浓绿,茎粗壮MS156.67±4.23b2.78±0.21a颜色黄绿,茎纤细,有玻璃化现象1/2WPM123.33±2.54c2.25±0.11b颜色黄白,茎纤细1/2MS118.00±2.05c2.07±0.08b颜色黄白,茎纤细,有玻璃化现象
注:同列不同字母表示差异显著(p<0.05)。下同。
2.2 不同植物激素对不定芽增殖的影响
在WPM培养基中添加不同种类和浓度的植物激素,将组织培养中诱导出的腋芽接种于不同培养基中,不同植物激素对不定芽增殖的影响见表3。
表3 不同植物激素对毛水苏腋芽增殖效果的影响

激素种类 浓度/(mg·L-1) 芽增殖系数芽长/cm6-BA0.502.16±0.13c3.45±0.21a6-BA1.003.76±0.19a3.38±0.19a6-BA1.502.68±0.17b3.42±0.22aNAA0.011.76±0.11d3.37±0.17aNAA0.051.28±0.09e3.31±0.14aNAA0.101.56±0.10de3.33±0.15a2.4-D0.200.00±0.00g0.00±0.00b2.4-D0.400.00±0.00g0.00±0.00b2.4-D0.600.00±0.00g0.00±0.00bIBA0.011.04±0.05ef3.40±0.22aIBA0.051.56±0.08de3.36±0.17aIBA0.101.10±0.05ef3.38±0.21a
培养中观察到,添加激素2,4-D的培养基中不定芽全部死亡,其他3种激素培养基中有不同程度的增殖。添加6-BA的培养基中增殖系数最大,显著高于另外2种激素。添加6-BA的3个处理间增殖系数有显著性差异,6-BA 1.00 mg·L-1的处理增殖系数最大,为3.76。从芽长看,3种激素各处理间差异不显著。这说明所选激素对增殖系数产生了差异影响,对芽长没有差异影响。
将6-BA、NAA和IBA 3种激素进行正交试验,研究其混合效果,结果见表4。
通过试验结果分析可知:A2为A因素的优水平,B1为B因素的优水平,C2为C因素的优水平。3个因素的优水平组合为A2B1C2,即毛水苏不定芽增殖的最佳激素浓度组合为6-BA 1.0 mg·L-1+NAA 0.01 mg·L-1+IBA 0.05 mg·L-1,增殖系数为2.36。因为RA>RC>RB,所以,3个因素对增殖系数的影响主次顺序为A、C、B,即6-BA最大,其次是IBA,而NAA最小。
表4 正交试验优化增殖培养基试验结果
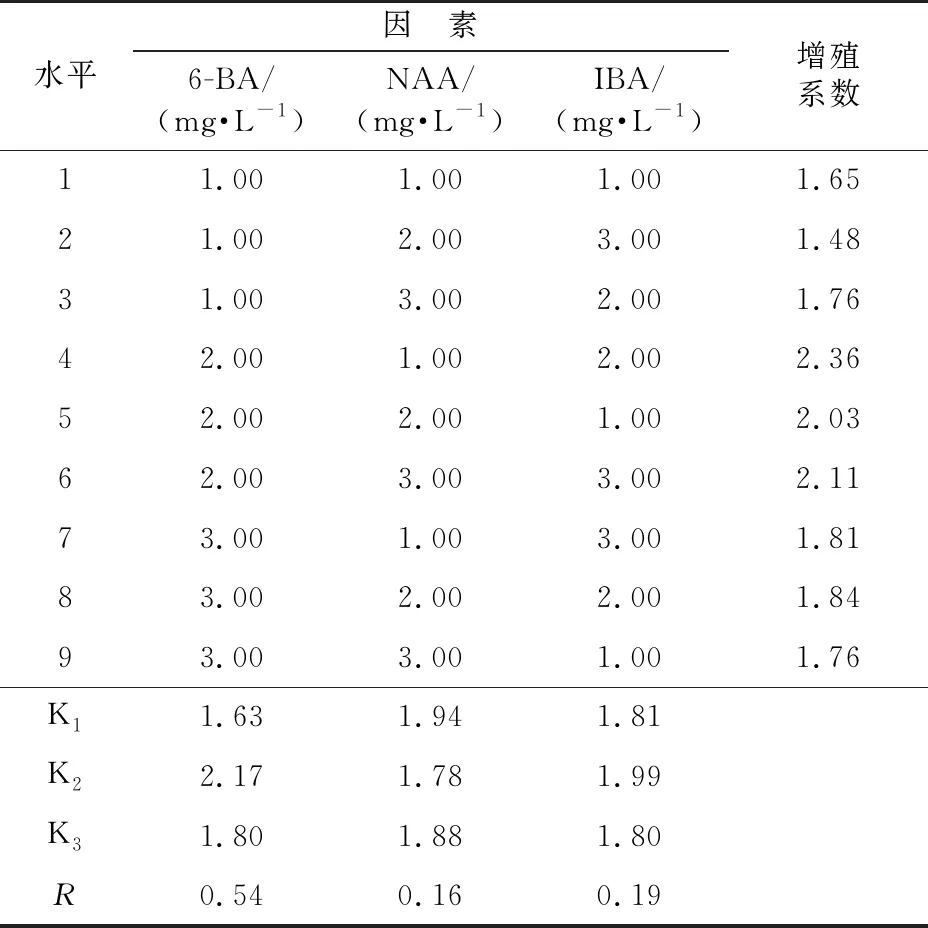
水平因 素6-BA/(mg·L-1)NAA/(mg·L-1)IBA/(mg·L-1)增殖系数11.001.001.001.6521.002.003.001.4831.003.002.001.7642.001.002.002.3652.002.001.002.0362.003.003.002.1173.001.003.001.8183.002.002.001.8493.003.001.001.76K11.631.941.81K22.171.781.99K31.801.881.80R0.540.160.19
注:K值为同一水平的平均值,R为极差。

图1 毛水苏增殖培养
2.3 最佳生根培养基的筛选结果
将增殖培养出的丛生芽接种到生根培养基中,30 d后观察生根情况,结果见表5。
培养中发现,毛水苏是极易生根植物,所选激素及浓度均可生根,生根率93.85%~100%,各处理间无显著性差异。NAA 0.30 mg·L-1的处理生根数最多,平均4.17条,显著高于其他处理。NAA 0.30 mg·L-1和0.20 mg·L-1处理根长最长,此2个处理根长差异不显著,但显著高于其他处理。NAA各处理间芽长无显著性差异,但显著高于IBA各处理的芽长。IBA各处理间芽长无显著性差异。综合考虑,NAA更适合在毛水苏组培苗生根培养基中使用,使用浓度为0.30 mg·L-1。
表5 不同植物激素对毛水苏生根效果的影响
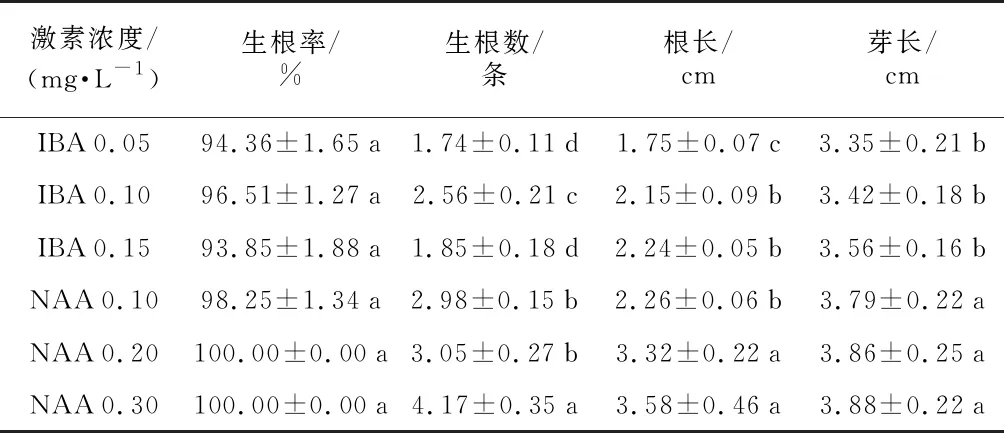
激素浓度/(mg·L-1)生根率/% 生根数/条根长/cm芽长/cmIBA0.0594.36±1.65a1.74±0.11d 1.75±0.07c 3.35±0.21bIBA0.1096.51±1.27a2.56±0.21c 2.15±0.09b3.42±0.18bIBA0.1593.85±1.88a1.85±0.18d2.24±0.05b3.56±0.16bNAA0.1098.25±1.34a2.98±0.15b2.26±0.06b3.79±0.22aNAA0.20100.00±0.00a3.05±0.27b3.32±0.22a3.86±0.25aNAA0.30100.00±0.00a4.17±0.35a3.58±0.46a3.88±0.22a

图2 毛水苏生根培养
2.4 生根苗与不生根苗移栽比较
将组织培养中生根苗及未经生根培养的苗同时移栽,30 d后观察生长情况,结果见表6。
表6 生根苗与不生根苗栽培比较

成活率/%株高/cm生长状况生根苗100.00±0.00a8.56±0.350a缓苗快,植株健壮,颜色浓绿不生根苗71.36±3.65b6.21±0.026b缓苗慢,植株健壮,颜色淡绿
由表6可知,毛水苏是极易成活植物,生根苗移栽成活率100%,即使没有经过生根培养的苗,移栽后成活率也能达到71.36%。生根苗移栽后缓苗快,植株健壮,颜色浓绿,株高可达8.56 cm。不生根苗移栽后缓苗慢,颜色淡绿,株高6.21 cm。
3 讨论与结论
WPM和MS培养基是植物组织培养中常用的基础培养基,一般木本植物多选择WPM培养基[7],草本植物多选择MS培养基。本试验中,不添加任何植物激素条件下,WPM培养基更适合毛水苏组织培养,萌芽率高,植株生长健壮,颜色浓绿,未出现玻璃化现象,这说明WPM也不局限于木本植物使用。
单因素试验表明:6-BA对毛水苏增殖培养效果最好。添加6-BA 1.00 mg·L-1的处理增殖系数最大,为3.76。正交试验结果表明:6-BA 1.0 mg·L-1+NAA 0.01 mg·L-1+IBA 0.05 mg·L-1对毛水苏增殖培养效果最好,增殖系数为2.36。从增殖系数大小看,3种激素的组合不如单独使用6-BA的效果好,但比单独使用NAA或IBA效果好。所以,可选择WPM+6-BA 1.00 mg·L-1作为毛水苏的增殖培养基使用。正交试验表明,3个因素主次顺序为6-BA最大,其次是IBA,而NAA最小。这与单因素试验中6-BA效果优于其他两种激素相吻合。
毛水苏是极易生根植物,在试验所选激素及浓度条件下均可生根,生根率为93.85%~100%。综合考虑生根率、生根数、根长和芽长等指标,认为毛水苏组培苗生根培养基为1/2 WPM+NAA 0.30 mg·L-1。鉴于毛水苏易生根特性,试验中进行了生根苗和不生根苗移栽比较,从移栽成活率看,生根苗成活率100%,不生根苗成活率71.36%。生根苗移栽缓苗期短,植株生长快,同期株高明显高于不生根苗。但从生产周期和成本角度考虑,如果省略生根培养环节,可以缩短20~30 d的培养时间,同时节省培养中所需试剂、水、电、人工等各方面的成本。虽然不生根苗移栽成活率低于生根苗,但如果大量工厂化生产,从节省成本,创造更大经济效益角度考虑,可以省去生根培养环节,直接将增殖培养出的苗进行移栽。
