欧前胡素对Aβ1-42致阿尔茨海默病模型小鼠的神经保护作用
2020-07-06刘鑫,余盈,何蔚
刘 鑫,余 盈,何 蔚
(赣南医学院 1.2017级硕士研究生;2.2014级硕士研究生;3.药理学教研室;4.江西省脑血管药理重点实验室;5.心脑血管疾病防治教育部重点实验室,江西 赣州 341000)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的中枢神经系统退行性疾病,是老年人群痴呆的最常见类型,其主要临床表现是进行性记忆和认知障碍、判断力和日常生活自理能力下降,严重的患者甚至产生行为失常精神神经症状。AD的主要神经病理性特征有β淀粉样蛋白(beta-amyloid,Aβ)沉积老年斑形成、神经元内纤维缠结、神经元丢失和突触丢失等[1-2]。AD的发病与年龄相关,随着老龄化进程的加剧,AD的发病率逐年升高,已成为严重危害老年人健康的主要疾病之一。
欧前胡素(imperatorin)是伞形科中药蛇床子、白芷、羌活的有效成分之一,是一种呋喃香豆素[3-5]。欧前胡素具有抗炎、抗氧化、抗焦虑、抗惊厥、舒张血管平滑肌、抗血栓形成和阻滞钙通道等作用[5-8]。研究证实,欧前胡素对东莨菪碱和脂多糖诱导的学习记忆障碍有明显的改善作用[8-9]。本课题组前期研究显示,欧前胡素有神经保护作用,欧前胡素有抗脑缺血损伤的作用,另外,欧前胡素还有抗痴呆作用,在跳台实验中,欧前胡素对Aβ1-42致AD痴呆模型小鼠的被动回避性学习记忆障碍有明显的改善作用,欧前胡素可减轻Aβ1-42致小鼠AD后脑组织氧化应激反应,抑制活性氧自由基的产生和抑制脂质过氧化反应及增强机体的抗氧化能力[10-11]。由于Aβ沉积及其触发的炎症反应在AD的发生和发展过程中起着重要作用,本课题利用Aβ1-42诱导小鼠AD模型,采用八臂迷宫评估欧前胡素对小鼠空间学习记忆障碍的影响,检测欧前胡素对大脑皮层和海马中炎症因子TNF-α和IL-1β产生及p-p38和p-ERK蛋白表达的影响,观察欧前胡素对AD模型小鼠空间辨别学习记忆障碍的改善作用以及对大脑皮层和海马组织中炎症反应的抑制作用,进一步揭示欧前胡素防治AD的作用机制,为把欧前胡素开发用于防治AD提供理论依据。
1 材料及方法
1.1实验动物SPF级BALB/c小鼠,♂,体重20~25 g,赣南医学院实验动物中心提供,生产许可证SCXK(赣)2014-0001。动物实验过程中严格遵守中华人民共和国科学技术部《关于善待实验动物的指导性意见》(国科发财字﹝2006﹞398号)的相关规定,严格遵守美国NIH发布的实验动物的保护和使用指南(NIH 出版 No. 85-23, 1996修订),并严格遵守用最少的动物数量完成实验并尽量减少实验动物痛苦的原则。
1.2药品和试剂欧前胡素(纯度>99.5 %,购自中国食品药品鉴定研究院,批号110826-201214),用二甲基亚砜(DMSO,美国Sigma公司产品)溶解,吐温-80(Tween 80,美国Sigma公司产品)助溶后用生理盐水稀释至所需浓度,溶媒对照液为含12.5% DMSO + 2% Tween 80的生理盐水;Aβ1-42(美国sigma公司产品),TNF-α和IL-1β ELISA试剂盒(美国R&D 公司产品),p-p38、p38、p-ERK、ERK一抗抗体(美国Cell Signaling Technology公司产品),辣根过氧化物酶标记的山羊抗兔二抗抗体(美国Cell Signaling Technology公司产品),BCA 蛋白检测试剂盒(美国Pierce公司产品),ETC化学发光液(美国Pierce公司产品),Marker蛋白(美国Pierce公司产品),PVDF膜(美国Millipore公司产品),其它试剂为市售分析纯。
1.3主要仪器RMT-100八臂迷宫视频分析系统(成都泰盟科技有限公司),ChemiDocTMXRS+成像系统(美国Bio-Rad公司),Bio-Rad电泳系统(美国Bio-Rad公司),Thermo Varioskan Flash全波长读数仪(美国thermo公司),TS-1000型脱色摇床(江苏海门其林贝尔仪器制造有限公司),多用途旋转摇床(江苏海门其林贝尔仪器制造有限公司),CR22GⅢ高速冷冻离心机(日本日立公司),隔水式电热恒温培养箱(上海跃进医疗器械有限公司)。
1.4方法
1.4.1小鼠AD模型的建立将Aβ1-42溶于灭菌注射用水中,密封后置37 ℃培养箱内孵育72 h。将小鼠用10%水合氯醛(350 mg·kg-1) 腹腔注射麻醉后,脑室内注射参照文献[12]进行定位,用10 μL微量注射器在小鼠脑室内(Bregma点后0.5 mm,中线旁开1.0 mm,深度2.5 mm)缓慢注射410 pmol (3.0 μL)凝聚态Aβ1-42,1 min注完,注射完后停留3 min再拔针。正常对照组小鼠脑室内注射等体积灭菌注射用水。
1.4.2实验动物分组及给药雄性BALB/c小鼠48只,随机分为4组,分别为正常对照组、AD模型组、AD模型+欧前胡素2.5 mg·kg-1和AD模型+欧前胡素5.0 mg·kg-1组,每组12只。AD模型+欧前胡素用药组动物在手术当天开始腹腔注射给药,1次/d,连续给药13 d,正常对照组和AD模型组在相同时间点腹腔注射溶媒10 mL·kg-1。
1.4.3八臂迷宫实验小鼠腹腔注射给药连续13 d后,进行八臂迷宫实验评估各组小鼠的学习记忆功能,记录小鼠的工作记忆错误次数(working memory errors,WME,即在同一次测试中小鼠再次进入已吃过食粒的臂的次数)、 参考记忆错误次数(reference memory errors,RME,即在同一次测试中小鼠进入未放置食粒的臂的次数)和总错误次数(total errors,TE)。迷宫实验结束后将动物麻醉后断头取脑,分离出大脑皮层和海马组织并分装于冷冻管中,液氮中保存,用于各观察指标测定。
1.4.4小鼠大脑皮层和海马组织中炎症因子的测定按照试剂盒说明书配置匀浆介质处理大脑皮层和海马组织样本,严格按照说明书的操作步骤,用ELISA检测小鼠大脑皮层和海马组织中TNF-α和IL-1β含量,蛋白定量采用BCA法。
1.4.5 WesternBlot检测蛋白表达每组分别随机取4只小鼠的部分大脑皮层和海马组织,利用蛋白提取试剂盒提取蛋白,BCA法蛋白定量,实验各组取等量蛋白质进行电泳,再转膜至PVDF膜;将转膜好的PVDF膜放置于含5%脱脂奶粉的TBST封闭液中,室温下反应1 h;封闭后加一抗抗体ERK(1∶1 000)、p-ERK(1∶2 000)、p38(1∶1 000)、p-p38(1∶1 000)、GAPDH(1∶1 000),4 ℃孵育过夜,TBST洗膜3次,每次10 min;再加用辣根过氧化物酶标记的山羊抗兔二抗溶液(1∶5 000),室温下反应2 h,用TBST洗膜3次,每次10 min;化学发光法检测,扫描灰度值用Image J进行测定分析。
2 结 果
2.1欧前胡素对AD小鼠空间学习记忆障碍的影响八臂迷宫实验显示,正常对照组、AD模型组、欧前胡素2.5 mg·kg-1和5.0 mg·kg-1给药组这4组小鼠在工作记忆错误次数、 参考记忆错误次数和总错误次数三个指标上差异均有统计学意义(P均<0.01)。通过LSD检验显示,与正常对照组比较,AD模型组小鼠的工作记忆错误次数、 参考记忆错误次数和总错误次数较多,差异有统计学意义(P<0.01);与AD模型组比较,欧前胡素2.5 mg·kg-1给药组和5.0 mg·kg-1给药组小鼠的工作记忆错误次数、参考记忆错误次数和总的错误次数均较少,差异均有统计学意义(对于2.5 mg·kg-1给药组P均<0.05,对于5.0 mg·kg-1给药组P均<0.01)(图1)。说明欧前胡素可以改善AD模型小鼠的空间学习记忆障碍。

图1 欧前胡素对AD小鼠空间学习记忆障碍的影响
注:Control:正常对照组,Model:AD模型组,IMP-L:欧前胡素 2.5 mg·kg-1组,IMP-H:欧前胡素5.0 mg·kg-1组;WME:工作记忆错误次数,RME:参考记忆错误次数,TE:总错误次数。与正常对照组比较##P<0.01;与AD模型组比较*P<0.05,**P<0.01。
2.2欧前胡素对小鼠大脑皮层和海马中TNF-α和IL-1β的含量的影响ELISA结果显示,正常对照组、AD模型组、欧前胡素2.5 mg·kg-1和5.0 mg·kg-1给药组这4组小鼠大脑皮层和海马组织中TNF-α和IL-1β含量存在组间差异(P均<0.01)。通过LSD检验显示,与正常对照组相比,AD模型组大脑皮层和海马两个部位中 TNF-α和IL-1β的含量均较高,差异有统计学意义(P均<0.01);与AD模型组比较,欧前胡素两个给药组的TNF-α和IL-1β含量均较低,差异有统计学意义(对于2.5 mg·kg-1组P均<0.05,对于5.0 mg·kg-1组P均<0.01),如图2所示,说明欧前胡素可抑制Aβ1-42致小鼠AD后TNF-α和IL-1β的产生。
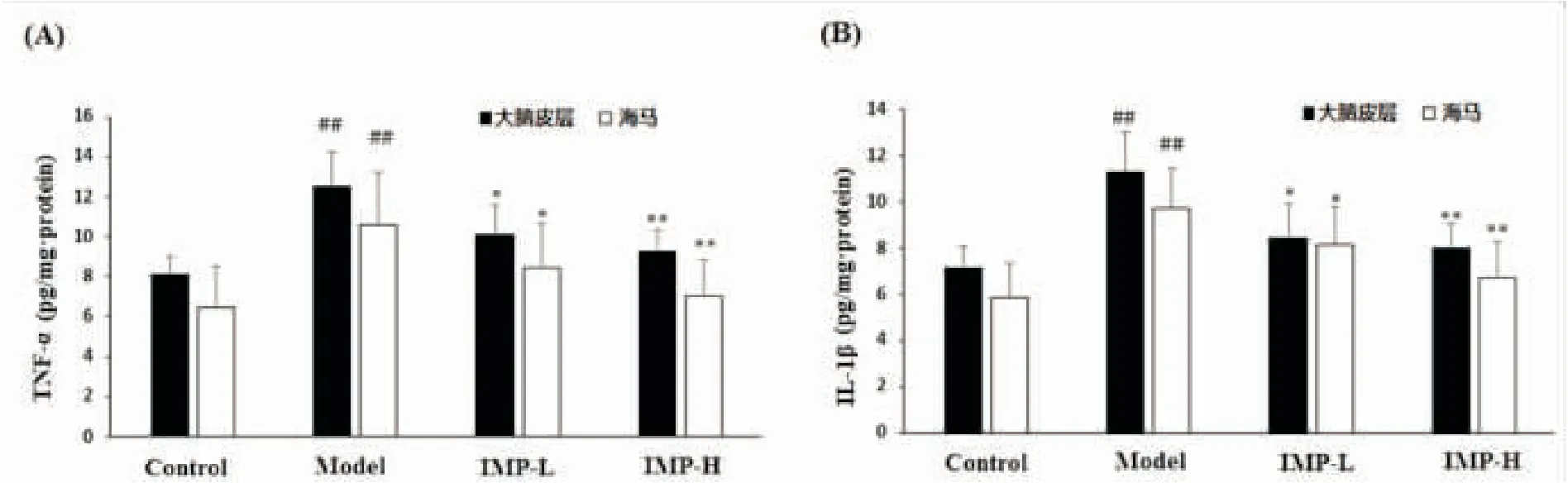
图2 欧前胡素对小鼠大脑皮层和海马中 TNF-α和IL-1β的含量的影响
注:Control:正常对照组,Model:AD模型组,IMP-L:欧前胡素 2.5 mg·kg-1组,IMP-H:欧前胡素5.0 mg·kg-1组。与正常对照组比较##P<0.01;与AD模型组比较*P<0.05,**P<0.01。
2.3欧前胡素对p-p38、p38、p-ERK和ERK蛋白表达的影响无论是大脑皮层还是海马组织中,4组小鼠p-p38/p38和p-ERK/ERK这两个指标均有差异(P均<0.01)。通过LSD检验,AD模型组小鼠同正常对照组相比,大脑皮层和海马中p-p38/p38和p-ERK/ERK的比值均更高(P均<0.01);与AD模型组比较,欧前胡素2.5 mg·kg-1和5.0 mg·kg-1两个给药组p-p38/p38和p-ERK/ERK的比值均更低(对于2.5 mg·kg-1组P均<0.05,对于5.0 mg·kg-1组P均<0.01)(图3)。

图3 欧前胡素对p-p38、p38、p-ERK和ERK蛋白表达的影响
注:Control:正常对照组,Model:AD模型组,IMP-L:欧前胡素 2.5 mg·kg-1组,IMP-H:欧前胡素5.0 mg·kg-1组。与正常对照组比较##P<0.01;与AD模型组比较*P<0.05,**P<0.01。
3 讨 论
我们前期利用脑室内注射Aβ1-42诱导小鼠AD模型,采用跳台法观察了欧前胡素能改善小鼠被动回避反应学习记忆障碍。本实验采用八臂迷宫实验进一步观察欧前胡素对空间学习记忆障碍的影响,研究显示,欧前胡素能减少迷宫实验工作记忆错误次数、参考记忆错误次数和总的错误次数,说明欧前胡素可以改善AD模型小鼠的空间学习记忆障碍。
大量研究证实,β淀粉样蛋白沉积老年斑和神经元内纤维缠结是AD的重要神经病理性特征,炎症反应在AD的病理生理变化中起着重要作用[13-14]。TNF-α和IL-1β是介导AD发病及病理变化的重要炎症介质,在AD患者和AD动物模型的脑中都已观察到TNF-α和IL-1β明显升高,抑制TNF-α和IL-1β产生及炎症反应,可防止和减慢AD的发病及进展[15-16]。我们的结果显示,脑室内注射Aβ1-42诱导小鼠AD后,大脑皮层和海马组织中TNF-α和IL-1β的含量升高,欧前胡素给药组TNF-α和IL-1β含量低于AD模型组,说明欧前胡素可抑制Aβ1-42致小鼠AD后炎症因子TNF-α和IL-1β的产生。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是真核细胞介导细胞外信号到细胞内反应的重要信号转导系统,此通路可调节细胞的生长、分化、凋亡和死亡等多种生理过程。p38丝裂原活化蛋白激酶(p38 MAPK)、细胞外调节蛋白激酶 (extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和ERK5是哺乳类细胞中MAPK信号通路的主要亚族。大量研究证实,p38和ERK激活在AD的发生和发展过程中起重要作用,抑制p38和ERK的激活有减轻炎症反应和抗AD的作用[17-19]。我们实验结果显示,Aβ1-42诱导小鼠AD后可导致大脑皮层和海马中p-p38和p-ERK蛋白表达增加,而欧前胡素治疗组p-p38和p-ERK蛋白的表达比模型组降低,欧前胡素可抑制p38和ERK 的激活。
综上所述,欧前胡素具有改善AD痴呆模型小鼠空间学习记忆障碍的作用,欧前胡素可抑制大脑皮层和海马组织中炎症反应。结合我们的前期研究发现,欧前胡素可减轻AD痴呆模型小鼠脑组织氧化应激反应,抑制活性氧自由基和脂质过氧化物的产生,增强机体的抗氧化能力,对AD小鼠的被动回避性学习记忆障碍具有改善作用。我们的研究结果提示,欧前胡素有防治AD的作用,其作用机制部分可能通过抑制氧化应激损伤和炎症反应有关。我们将进一步揭示欧前胡素防治AD的作用机制,为把欧前胡素开发用于防治AD提供理论依据。
