斑马鱼移植瘤模型在抗肿瘤药物研发和临床治疗研究中的应用*
2020-07-06杨莉莉海博宁邵吉民
杨莉莉,海博宁,邵吉民
(浙江大学医学院病理学与病理生理学系,浙江大学附属第二医院肿瘤研究所,浙江杭州310058)
人类肿瘤的动物异种移植模型是肿瘤研究的关键临床前工具。目前最常用的动物移植瘤模型是免疫缺陷小鼠模型。近十年来,由于斑马鱼(Danio rerio)与人类基因组同源性高达70%,个体小,可大规模快速繁殖,胚体透明易于观察,发育前一个月无适应性免疫,以及成本低等原因[1-2],这种动物模型逐渐发展成为另一种相对快速且具有较高成本效益的人类肿瘤体内研究模型。本综述中,我们讨论了使用斑马鱼模型的优势及其局限性,并与小鼠模型进行了对比;整理了目前斑马鱼移植瘤模型的构建及不同的类型;总结了该模型在抗肿瘤药物研发和临床治疗研究中的应用及其在精准医学中的应用前景。
1 斑马鱼模型的优势与局限性
1.1 生物学特性 斑马鱼在二十世纪六十年代成为发育遗传学的典范生物。由于斑马鱼体外受精、体外发育、胚体完全透明的特征,使得研究者不仅能通过记录特定细胞在胚胎发育中的分裂历史,跟踪观察每一个细胞的发育命运,同时也给遗传操作和人工诱变提供了极为有利的条件[3]。斑马鱼胚胎发育迅速,从单细胞受精卵发育至具有可辨认的脊椎动物体节、跳动的心脏和正常的神经系统,只需要1周时间[4],因此应用于药物筛选大多在1周内即可完成。斑马鱼模型不仅使实验周期大大缩短,实验通量大为提高,而且斑马鱼在出生后1周内,胚胎只需置于培养皿中,其会消耗自身的卵黄作为营养物质,无需人工喂食或维护,只需偶尔更换培养基,极大地节约了实验空间和饲养消耗。
1.2 免疫学特性 斑马鱼的先天免疫系统至少在受精后2 d(2 d post-fertilization,2 dpf)时才发挥其功能,而在受精后约4~6周时其适应性免疫在形态和功能上才趋于成熟[5-7]。因此如果在斑马鱼早期胚胎阶段(囊胚阶段至受精后48 h),即其适应性免疫应答尚未建立时,通过显微注射建立异种移植则不需要免疫抑制剂处理。所以在斑马鱼早期胚胎中进行的研究是在其不具有完全免疫能力情况下进行的。
1.3 可视化特性 斑马鱼胚体透明可实现体内细胞和亚细胞成像,使其体内药物作用效果变得可视化。而且,还可利用组织特异性表达荧光报告基因来构建转基因斑马鱼,目前已有的如标记血管[8-9]、神经元[10]、血液[11-12]、免疫细胞[13-14]等。尽管如此,斑马鱼的成像能力仅限于较早年龄的胚胎,随着年龄的增长,其胚胎变大且不透明,影响体内成像。目前已有光片成像技术,或称选择性平面照明显微镜技术(selective planar illumination microscope,SPIM)[15-16],允许更深的组织穿透和更小的光毒性,但还无法穿透成年斑马鱼的组织。
1.4 局限性 斑马鱼的上述生物学特性使其与脊椎动物发育而来的哺乳动物小鼠模型相比具有明显的优势,但其依然存在着一些固有的局限性。首先,虽然斑马鱼与人类基因组具有较高同源性,但其与人类蛋白质的差异不可避免地产生不同药效[17]。其次,斑马鱼胚胎总体形态在1~5 dpf之间变化不大,但脉管系统和其它器官经历了广泛扩张和重塑[4,18],此特点有助于发育研究,但在肿瘤研究中可能需要较稳定的发育过程。携带移植瘤的斑马鱼饲养于34°C,低于人体生理体温,移植瘤细胞的增殖速度不同于人类体内,而且移植瘤微环境与人类肿瘤存在差异。再者,斑马鱼主要通过直接浸泡给药,其药物渗透率以及口服摄取率较难预测。尽管已有研究表明斑马鱼体内的药物分布、代谢和排泄与人类相似,但是迄今为止几乎没有研究深入探索这些领域。此外,斑马鱼胚胎与幼鱼体积小,实验操作较难,现有针对斑马鱼蛋白质的抗体数量有限。这些优缺点的总结见表1。

表1 斑马鱼和小鼠异种移植瘤模型的优缺点Table 1.The advantages and limitations of zebrafish and mouse xenograft models
2 斑马鱼移植瘤模型的构建和类型
2.1 移植瘤构建 对斑马鱼移植人类肿瘤细胞时,每次可以显微注入50~300个细胞,由于斑马鱼早期免疫功能缺失因而成瘤能力明显,还可以利用斑马鱼的成像能力进行体内的深层次观察。研究者们尝试了斑马鱼的几个注射部位用以模拟不同的癌症阶段。在斑马鱼受精卵发育至囊胚阶段,卵黄是唯一可能的接种部位。Lee等[19]在斑马鱼发育的囊胚阶段,约受精后3.5 h,将黑色素瘤细胞首次移植到囊胚期卵黄中,提供了肿瘤细胞在注射后长达8 d的迁移行为证据。多数研究选择2 dpf的胚胎作为异种细胞移植受体[20-21],此时提供了更多注射部位的可能性。除了卵黄,另外两个允许癌细胞直接释放到血液循环中的接种部位是居维叶导管(位于卵黄囊的上部)和主静脉(尾巴区域)[22-23]。根据移植部位的不同,可以追踪不同的肿瘤发生发展表型,例如癌细胞的侵袭,外渗和转移等[24],或细胞与肿瘤微环境的相互作用等[25]。
2.2 不同移植物 构建斑马鱼移植瘤模型既可以应用体外传代的肿瘤细胞系,又可以使用患者来源的原代肿瘤细胞(patient-derived xenograft,PDX),而采用PDX构建的移植瘤模型则能更好地模拟肿瘤细胞的真实行为。PDX通常可以维持原始肿瘤的个体间遗传异质性,模仿患者中的疾病反应,从而反映每个患者的独特性[26]。
Marques等[27]首先研究并证实了斑马鱼可用于人类PDX移植,为检测原发癌细胞的转移行为提供了一种简单而快速的方法。他使用了多种癌细胞系以及来自胰腺癌,结肠癌和胃癌的原代人类癌细胞。利用Tg(fli1a::eGFP)斑马鱼评估了肿瘤细胞的侵袭和微转移,并在体内进行了追踪。Mercatali等[28]使用了来自乳腺癌患者骨转移的PDX,并将PDX的行为与已建立的乳腺癌细胞系进行了比较,发现患者原代细胞可从血管中渗出并侵入斑马鱼尾部造血组织(caudal hematopoietic tissue,CHT)。作者认为斑马鱼可能是识别乳腺癌预后标志物以及预测治疗反应的良好临床前模型。另一项研究调查了人类白血病细胞的发病机理和药物抑制作用,除细胞系外增加了从急性髓系白血病患者血液中分选出的CD34+白血病祖细胞,表明异种移植的癌细胞能够在斑马鱼中存活,并被伊马替尼和其他抗白血病药物抑制[23]。
2.3 成年斑马鱼移植瘤模型 与胚胎不同,成年斑马鱼具有发育完全的免疫系统,因此需要防止移植排斥。辐照和药物处理是用于免疫抑制的两种最常用方法。低至20 Gy的单次放射剂量或25~250 mg/L的地塞米松足以形成免疫抑制[29-30]。最近,Yan等[31]建立了完全免疫缺陷的斑马鱼转基因品系(prkdc-/-,il2rga-/-),构建了16种肿瘤细胞系及6种原代细胞的斑马鱼移植瘤模型,可饲养于37℃的类似人体的生理环境中。他们的结果提示这种成年斑马鱼的异种移植模型可以作为与小鼠媲美的临床前模型,在未来的肿瘤研究中具有相当高的价值。表2总结了人类肿瘤异种移植的斑马鱼模型。

表2 斑马鱼移植瘤模型类型Table 2.Varity of zebrafish xenograft models
3 斑马鱼移植瘤模型在抗肿瘤药物中的应用
3.1 新药开发的药物药效评价 2003年,美国国家卫生研究院将斑马鱼列为仅次于大鼠和小鼠的第三重要实验生物(http://www.fda.gov/forconsumers/consumerupdates/ucm343940.htm)。目前已有主要基于斑马鱼模型发现的新药进入临床试验[39-40]。同时已有355例报道表明斑马鱼模型可作为药物发现过程中的基本工具[41]。斑马鱼移植瘤模型可用于发现和鉴定新型小分子的作用、以及优化和改造化合物研究,确定药效、毒性以及作用机理。表3概述了目前已报道的应用斑马鱼移植瘤模型进行药物药效评价的情况。
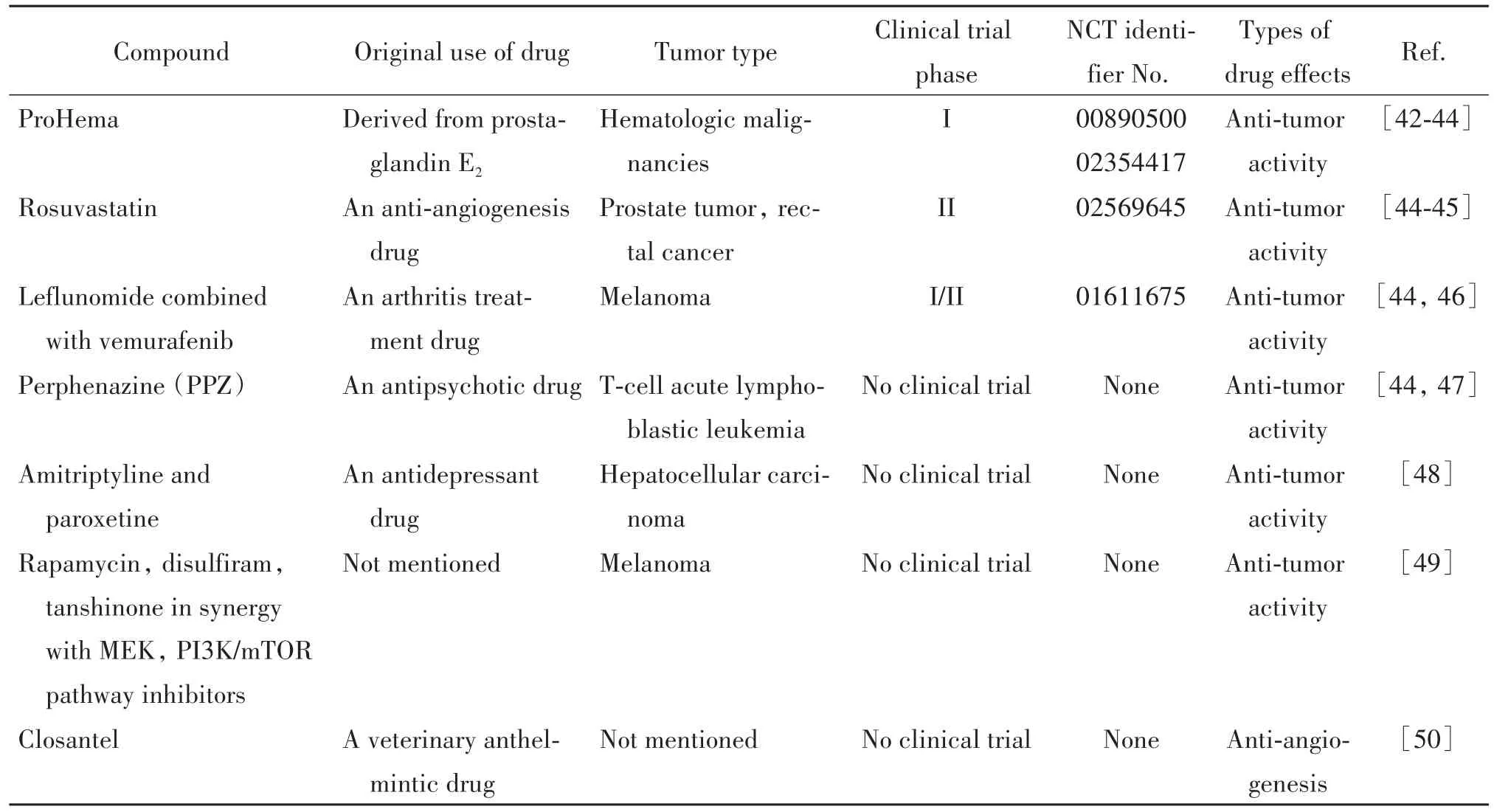
表3 斑马鱼移植瘤模型在新药研发中的应用Table 3.Applications of zebrafish xenograft models in drug development
目前大部分已报道的斑马鱼药效研究通常使用转基因斑马鱼,通过表型实验或异种移植实验来评估化合物的抗肿瘤活性,可同时鉴定化合物对多种肿瘤类型的抗肿瘤作用。抗肿瘤活性评价多采用共聚焦成像观察肿瘤荧光强度、或将斑马鱼裂解后通过计数肿瘤细胞得到。目前在药物研发中,应用斑马鱼模型研究的常见癌症类型有乳腺癌、白血病、肺癌和黑色素瘤等,表明斑马鱼移植瘤模型具有出色的通用性(表1)。由于血管生成和淋巴管形成是涉及肿瘤进展和扩散的关键过程,而斑马鱼胚胎透明性和带有荧光脉管系统的转基因斑马鱼模型使得血管和淋巴管形成可视化,因此斑马鱼移植瘤模型常用于靶向这些分子途径的化合物的研究、发现抗血管和抗淋巴管形成的活性药物等。此外,斑马鱼模型还涉及一些与胚胎发育有关的信号传导通路研究如TGFβ、Notch或Wnt通路等,以及细胞机制如凋亡和细胞周期调控等的研究[51-52]。
3.2 新药开发的药物毒性及安全性评价 美国食品药品监督管理局(Food and Drug Administration,FDA)和欧洲药品评估局(European Agency for the Evaluation of Medicinal Products,EMEA)也已接受斑马鱼毒性和安全性评估数据用于新药的批准。斑马鱼的胚胎毒性试验包括急性毒性试验和早期生命毒性试验。急性毒性试验的评估标准,一个是导致胚胎死亡的半数致死浓度(50%lethal concentration,LC50);另一个是观察到的胚胎异常表型,如胚胎凝结、未形成体节、缺乏心跳以及尾巴未从卵黄中脱出等[53]。早期毒性测试在受精后不久开始,并在自由进食阶段或生命的前30 d结束,评估指标为孵化、存活以及形态、行为和大小的异常[54]。在应用斑马鱼模型进行发育毒性和致畸评估时,通常使用12个主要观察点(心脏、大脑、下颌、眼睛、肝脏、肠、躯干/尾巴/脊柱、肌肉/体节、身体色素沉着、循环系统、身体浮肿和出血)和8个次要观察点(鳍、耳、鳔、红细胞形成、肾囊肿、胰腺、运动性和体长)来进行药物的评估[55]。
3.3 在临床治疗研究中的应用 2017年,Fior等[37]应用斑马鱼移植瘤模型筛选了晚期结直肠癌国际诊疗指南中的几种主要治疗方案。他们首先分析了5个传代结直肠癌细胞系的斑马鱼移植瘤模型对两种最常见一线化疗方案FOLFOX和FOLFIRI的反应,观察到对FOLFIRI的总体敏感性高于对FOLFOX的敏感性,与之前Sadanandam等[56]报道一致。同时,他们又用HCT116KRASG13D斑马鱼移植瘤测试了二线推荐疗法西妥昔单抗的敏感性,发现其对HCT116KRASG13D移植瘤有效,与目前的临床报告结果一致。他们的结果还表明,用于难治性转移结直肠癌的三线药物雷戈非尼在斑马鱼移植瘤中诱导凋亡并伴有肿瘤缩小,具有明显的药效。最后他们还运用病人来源的原代肿瘤细胞构建PDX用于FOLFOX治疗,并能在五分之四的患者中预测病人术后3~6个月内有无复发。
多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂奥拉帕尼与DNA损伤剂替莫唑胺联用,可有效抑制人尤文氏肉瘤的生长,并已进入II期临床试验[57-58]。2019年,Yan等[31]在Cell报道了利用免疫缺陷的成年斑马鱼移植瘤模型,采取口服方式,发现奥拉帕尼与替莫唑胺联用能显著抑制横纹肌肉瘤的增殖。上述研究提示,斑马鱼移植瘤模型可用于临床抗肿瘤药物敏感性研究。
4 展望
动物移植瘤模型对肿瘤治疗尤其是精准医学具有重要的意义和价值。迄今研究表明,斑马鱼移植瘤是一种有用的肿瘤研究模型,尤其适用于大规模快速筛选,便于研究者们尽快得到实验结果,是对现有其它动物模型系统有价值的补充。在此基础上,可进一步应用更高等的动物模型模仿人类体内环境,进行较长期毒性、药效以及药代药动分析。肿瘤是高度异质性的疾病,而且可以不断演化。斑马鱼移植瘤模型可快速繁殖、高通量筛选以及成本低的特点,使得应用该模型构建临床肿瘤组织来源的移植瘤、跟踪癌症的异质性和不断变化成为可能,从而帮助理解体内肿瘤生物学过程和机制,并指导临床个性化治疗。
