解郁丸对WKY抑郁样大鼠前额叶皮层与海马树突棘的影响*
2020-07-06刘红梅
刘红梅,李 琦,宋 苗,张 宇,徐 勇△
(山西医科大学 1基础医学院,2第一医院精神卫生科,山西太原030001)
抑郁症具有高患病率、高致残率、高自杀率及高复发率的特点,严重影响了人类的身心健康[1]。目前,抑郁症的治疗手段甚多,但都没有得到满意的疗效。复方中药解郁丸(Jieyuwan,JYW)由十多种成分组成,副作用较少,研究表明此药可以影响海马与前额叶皮层中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达量,其抗抑郁机制与突触可塑性存在密切关系[2]。树突棘是中枢神经系统兴奋性突触传递的原始位点[3],是接受信息、形成突触联系的重要部位,被认为是脑功能可塑性的基础。树突棘在数量和形态上都具有易变性,所以常导致突触结构和功能发生病理性的改变而引发各类疾病的发生,但在抑郁症中树突棘结构改变的相关报道尚少。
突触后致密区蛋白95(postsynaptic density protein-95,PSD-95)是突触后膜致密区的一种支架蛋白,存在于兴奋性谷氨酸能突触内[4],在树突棘中位于其头部,参与兴奋性突触传递的功能调控[5]。在抑郁症中PSD-95蛋白的表达水平与树突棘的病理变化是否一致,目前报道很少。
由此,本研究选用Wistar-koyoto(WKY)抑郁模型大鼠研究前额叶皮质与海马组织中树突棘的病理变化及PSD-95蛋白的表达情况,并观察中药解郁丸的影响。
材料和方法
1 实验动物
以45只成年雄性WKY大鼠(体重约250~280 g)为研究对象,选取同品系SPF级Wistar大鼠15只作为空白对照(Wistar)组,均由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2016-0006。大鼠饲养于山西医科大学SPF级动物中心,每个笼子3只,设施维持在12 h亮/暗循环、温度(22±2)℃、湿度50%~60%的环境中,实验期间除行为学测试外动物可以自由获得食物和水。
2 方法
2.1 动物分组与药物处理 动物适应性喂养1周后,将Wistar大鼠(Wistar组)与WKY大鼠(WKY组)进行行为学实验,以作为基线;然后将45只WKY大鼠随机分为模型(WKY+NaCl)组、解郁丸(WKY+JYW)组和西酞普兰(WKY+citalopram,WKY+CPM)组,每组15只,以15只Wistar大鼠为对照(Wistrar+NaCl)组。各组的给药处理方式如下:(1)对照组:Wistar大鼠予以生理盐水灌胃21 d;(2)模型组:WKY大鼠予以生理盐水灌胃21 d;(3)解郁丸组:将解郁丸(212 mg/kg,河南泰丰制药股份有限公司)根据文献[6]用0.5%的羧甲基纤维素钠制备混悬液,灌胃21 d;(4)西酞普兰组:基于前人实验[7]将氢溴酸西酞普兰(10 mg/kg,丹麦灵北药厂)溶于生理盐水,灌胃21 d。
2.2 糖水偏好实验 用糖水偏好实验对抑郁大鼠快感缺失行为进行检测。将大鼠均单独饲养于一个笼子并自由饮食,实验第1天适应双瓶饮水,第2天换成含1%蔗糖的双瓶饮用1天,第3天放置相等重量的双瓶(一瓶为纯水,一瓶为1%的蔗糖水)进行测试,测试时间为9:00~15:00,期间每3 h交换一次位置,防止产生位置偏爱,测试结束后称量两只水瓶剩余量,计算糖水偏好程度。糖水偏好系数(%)=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
2.3 旷场实验 用旷场实验检测抑郁大鼠在空旷空间的探索行为。大鼠被放置于装有摄像机的自发活动箱(100 cm×100 cm×50 cm),设定中央区和外周区。将每只大鼠轻轻放在活动箱中央开始实验,视频记录5 min。在每只大鼠测试之间,清理干净活动箱并使用75%乙醇去除气味。记录大鼠在空旷空间活动的总距离以及在中央区的探索总时间。
2.4 强迫游泳实验 用强迫游泳实验检测抑郁大鼠的绝望行为。强迫游泳实验设备为直径200 mm、高400 mm的装有摄像机的透明玻璃箱。实验水温在23~25℃,水深在300 mm左右。实验第1天为适应阶段,将大鼠放入水中自由活动5 min,24 h后(第2天),用同样的方法记录自由活动5 min。每只大鼠游泳后都更换清水,游泳测试结束后将大鼠擦干,放回笼中。实验记录分析大鼠的漂浮不动时间。
2.5 高尔基染色 大鼠称重,腹腔注射戊巴比妥钠(1%,50 mg/kg)进行深度麻醉,然后快速剥离出脑组织,并用三蒸水迅速冲洗脑组织表面的血液;再将脑组织切片,厚度不超过1 cm,放入浸渍液中浸泡(按照FD Rapid GolgiStain™Kit说明书进行操作)。取出浸泡好的脑组织,慢慢放入含有干冰的异戊烷快速冷冻组织;将冷冻好的组织固定在冰冻切片机上进行切片,切片厚度为100 μm。切片置于室温黑暗处自然风干,然后进行染色,三蒸水洗片2次,每次4 min,再用工作液(FD Rapid GolgiStain™ Kit提供)染片10 min,三蒸水洗2次。在50%、75%和95%乙醇中进行梯度脱水,每个梯度4 min。之后再在无水乙醇中脱水4次。在二甲苯中进行透明3次,之后用树脂封片剂封片。在显微镜下拍照观察。
2.6 Western blot实验 大鼠腹腔注射戊巴比妥钠(1%,50 mg/kg)进行麻醉,快速取出脑组织于冰上分离前额叶皮层和海马组织,速冻并转移至-80℃保存。提取蛋白质,BCA法测蛋白浓度。配胶、电泳、转膜、封闭,I抗(抗PSD-95抗体,1∶1 000;Abcam)4℃孵育过夜,TBST洗膜,加入II抗(anti-mouse IgG,HRP-linked antibody,1∶2 000;Cell Signaling Technology)室温孵育1 h。TBST洗膜,ECL进行曝光。
3 统计学处理
采用SPSS 22.0软件对数据进行处理分析,数据以均数±标准误(mean±SEM)表示,组间差异采用单因素方差分析(one-way ANOVA),以P<0.05表示差异有统计学意义。
结 果
1 糖水偏好实验结果
糖水偏好实验结果显示,给药前,与Wistar大鼠相比,WKY大鼠糖水偏好程度明显降低(P<0.05),表明WKY大鼠表现出快感缺失的抑郁样行为;经过21 d药物干预后,WKY+JYW组和WKY+CPM组大鼠比给药前的WKY大鼠糖水偏好程度明显提高(P<0.05),说明解郁丸使WKY大鼠的抑郁样行为有所减少;药物组之间无明显差异,见图1A。
2 强迫游泳实验结果
与Wistar大鼠相比,WKY抑郁大鼠给药前在强迫游泳实验中的不动时间明显增加(P<0.05),即WKY大鼠表现出明显的绝望抑郁样行为;但给予药物治疗21 d后的WKY大鼠此情况明显好转,即WKY+JYW组和WKY+CPM组不动时间较给药前的WKY大鼠显著减少(P<0.05),药物组之间的差异无统计学显著性,见图1B。
3 旷场实验结果
与对照组Wistar大鼠相比,WKY大鼠给药前的总运动距离(P<0.01)和在中心区的停留时间(P<0.05)明显降低,即WKY大鼠表现出对陌生空间的探索活动减少;但给予药物治疗21 d后的WKY大鼠此情况得到逆转,即WKY+JYW组和WKY+CPM组总运动距离(P<0.01)和中心探索时间(P<0.05)显著增加,药物组之间的差异无统计学显著性,见图1C、D。
4 前额叶皮层与海马组织高尔基染色结果
Golgi染色观察显示,与正常对照组Wistar大鼠相比,WKY大鼠前额叶皮层与海马组织中的树突棘明显减少(P<0.01),但在给药治疗后前额叶皮层和海马组织中树突棘密度显著增多(P<0.01),且药物组之间的差异无统计学显著性,见图2。
5 Western blot实验检测前额叶皮层与海马组织中PSD-95的表达水平
与对照组Wistar大鼠相比,WKY大鼠的前额叶皮层与海马组织中PSD-95的蛋白表达量明显降低(P<0.01),经过21 d的药物治疗后,前额叶皮层与海马中的PSD-95的表达水平增加(P<0.01),而药物组之间的差异无统计学显著性,见图3。
讨 论
在研究抑郁症的发病机制以及寻找新药的作用靶点过程中,虽然以人类为研究对象更为直接,但是伦理的局限性让我们不能更为深入地探讨,因此在抑郁症动物模型上的研究可能会大大提高我们对抑郁症的发病机制及对新药作用机制的理解。WKY大鼠是一种内源性抑郁样大鼠模型,是通过其同品系Wistar大鼠杂交筛选获得的大鼠,已经广泛应用于抑郁症的研究[8-10]。有研究发现该模型动物在强迫游泳实验中的活动明显减少,不动时间延长[9]。在本研究中,同样发现WKY大鼠对糖水的偏好程度下降,表现出抑郁症中的快感缺失,同时强迫游泳不动时间增加,展示出绝望的抑郁样表现,并且旷场实验中发现WKY大鼠活动距离减少,在中心探索的时间也下降,显示出探索能力下降的抑郁样表现,这些行为学结果与抑郁症患者表现一致,经过中草药解郁丸21 d的干预之后,发现WKY大鼠的上述抑郁样行为有明显逆转,且与西酞普兰组的差异无统计学显著性,提示解郁丸对WKY抑郁模型大鼠长时间的治疗可以同样达到较好的效果。
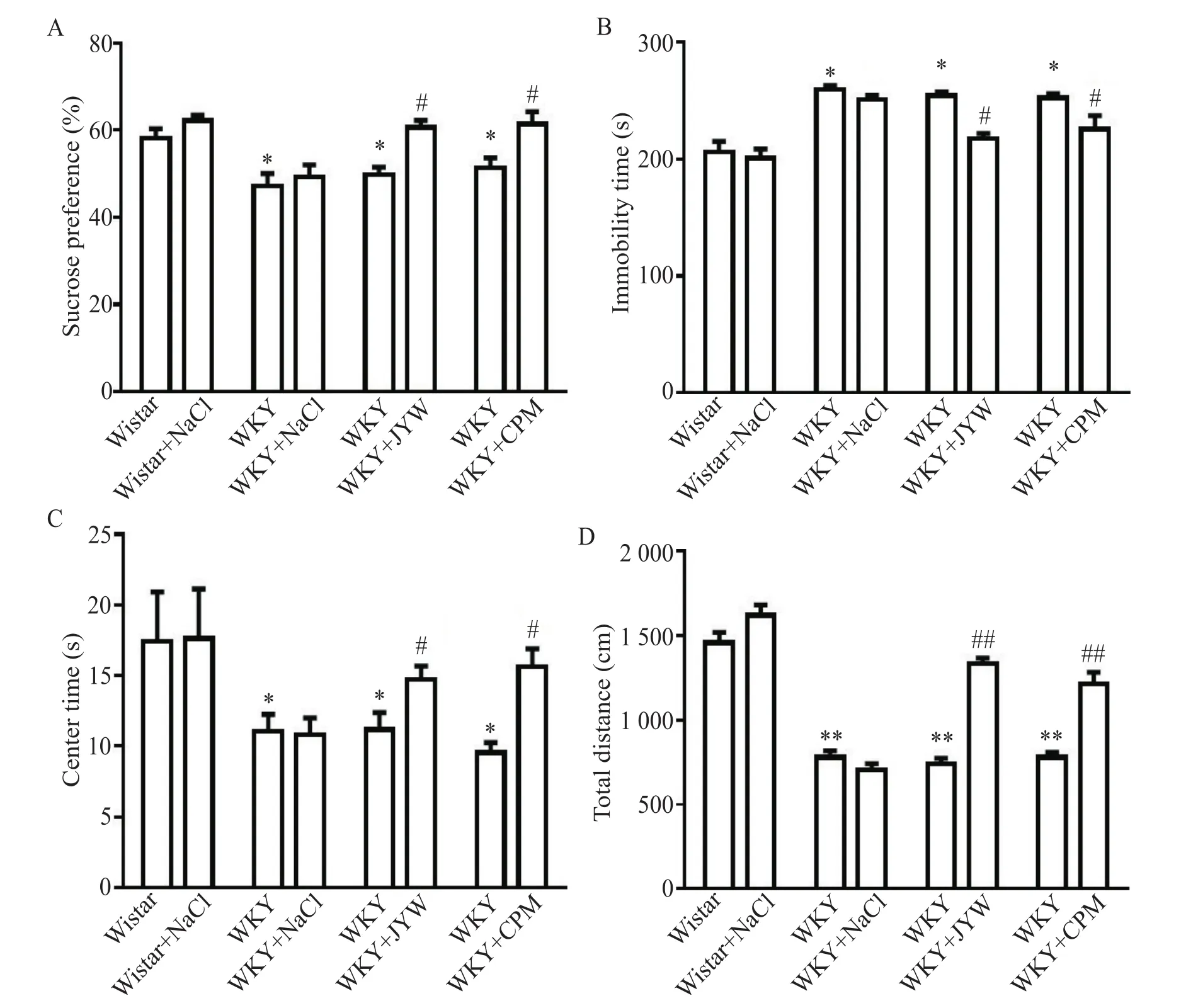
Figure 1.The results of behavioral experiments.A:the results of sucrose preference test;B:immobility time in the forced swimming test;C:center time in the open-field test;D:total distance in the open-field test.Mean±SEM.n=15.*P<0.05,**P<0.01 vs Wistar group;#P<0.05,##P<0.01 vs WKY group.图1 行为学实验结果
树突棘是兴奋性突触的主要突触后结构基础,它们通常接受来自轴突的兴奋性输入,构成大部分兴奋性突触的突触后膜。在中枢神经系统中,大部分兴奋性突触位于树突棘上,是神经元连接、信息存储和处理大脑回路的、重要高度动态的结构[11-12]。有研究发现,重度抑郁症患者的前额叶皮层中突触蛋白表达减少,突触数目减少[13],且海马存在树突棘萎缩,树突棘密度减少的病理状态[14]。在慢性不可预测的轻度应激(chronic unpredictable mild stress,CUMS)大鼠模型上,发现海马和内侧前额叶皮层的主要神经元中树突棘密度下降[15-16]。在本研究中,WKY大鼠模型中同样发现海马和前额叶皮层中树突棘的密度降低,通过解郁丸或西酞普兰治疗后能够提高WKY大鼠树突棘密度值。因此,我们认为树突棘具有高度的敏感性,可能是抑郁症发生发展的重要结构之一,有可能成为研制新型抗抑郁药物的重要靶结构。
PSD-95是突触后致密区核心构架蛋白之一,位于中枢神经系统所有轴-树突棘突触的突触后膜上,参与神经元生长、突起形成和突触可塑性调节等[17],是突触后信号转导和整合的结构基础。有研究表明,创伤后应激障碍模型大鼠海马CA1区PSD-95蛋白表达是减少的[18];王雪银等[19]发现,PSD-95表达的增加可以增强阿尔兹海默病大鼠的空间学习记忆能力。同样在本研究中发现WKY抑郁大鼠的前额叶皮层与海马组织中PSD-95的表达是降低的,经过药物治疗后明显提高了PSD-95的表达水平,提示抑郁症的发生以及抗抑郁药物的作用机制与突触可塑性均存在着联系,可以应用PSD-95作为治疗抑郁症的观察指标之一。
综上所述,我们观察到WKY抑郁样模型大鼠具有快感缺失、绝望、认知下降等抑郁样行为表现,并且海马与前额叶皮层中树突棘密度明显下降,PSD-95蛋白的表达水平也降低,说明树突棘的变化是抑郁症导致的分子结构改变之一,抑郁症的发生与突触可塑性存在着联系。以西药西酞普兰为阳性对照药物,解郁丸可以减少WKY大鼠的抑郁样行为,并提高海马与前额叶皮层中的树突棘密度及PSD-95蛋白的表达量,提示中药解郁丸长时间应用效果与西药的药效相当,而且副作用少。本研究为解郁丸在临床上的应用提供了更多的支持依据。

Figure 2.The results of Golgi staining.Dendritic spines in the prefrontal cortex(A)and hippocampus(B)were visualized by Golgi staining.The scale bar=10 μm.Mean±SEM.n=6.**P<0.01 vs Wistar group;##P<0.01 vs WKY group.图2 高尔基染色结果

Figure 3.The protein expression of PSD-95 in prefrontal cortex(A)and hippocampus(B)of rats was detected by Western blot.Mean±SEM.n=6.**P<0.01 vs Wistar group;##P<0.01 vs WKY group.图3 Western blot检测PSD-95蛋白的表达水平
