CD36/Src/ERK通路参与单核细胞向巨噬细胞的分化*
2020-07-06夏珺,俞婷,赵蕾
夏 珺, 俞 婷, 赵 蕾
(重庆医科大学脂糖代谢性疾病重庆市重点实验室,脂质研究中心,重庆400016)
随着生活水平的提高,动脉粥样硬化已经成为世界范围内血管性死亡的主要原因[1]。在动脉粥样硬化的发病过程中,循环中的单核细胞黏附于血管壁内皮细胞,分化成为巨噬细胞,进而进入内膜、吞噬脂质,形成泡沫细胞,因此单核细胞向巨噬细胞的分化是动脉粥样硬化病变早期的典型事件。有研究提示通过抑制单核细胞向巨噬细胞的分化可以抑制动脉粥样硬化的发展[2],但具体机制还有待进一步研究。
CD36又称脂肪酸转位酶(fatty acid translocase,FAT),是一种广泛分布于单核细胞、巨噬细胞和脂肪细胞上的膜糖蛋白,属于B类清道夫受体家族。有研究报道,CD36在单核细胞向巨噬细胞的分化过程中表达增加[3]。但是CD36的表达是否会影响巨噬细胞的分化还尚未见相关报道。因此,本研究拟用人源单核巨噬细胞THP-1为研究对象,通过干扰和过表达CD36,探讨CD36对单核细胞向巨噬细胞分化过程的影响及其分子机制。
材料和方法
1 细胞株
人源单核细胞THP-1购于美国模式培养物保存中心(American Type Culture Collection,ATCC)。
2 主要试剂
胎牛血清购于UTR;RPMI-1640培养基购于Hy-Clone;佛波酯(phorbol 12-myristate 13-acetate,PMA)和牛血清白蛋白(bovine serum albumin,BSA)购于Sigma;Trizol RNA抽提试剂盒、逆转录试剂盒及SYBR real-time PCR试剂盒购于TaKaRa;BCA蛋白检测试剂盒、β-actin兔抗人多克隆抗体和结晶紫购于北京鼎国公司;FAT/CD36兔抗人多克隆抗体购于Novus;CD36-PE抗体购自BD;细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p-ERK、p-Src和Src兔抗人多克隆抗体购于CST;辣根过氧化物酶标记的山羊抗兔或鼠IgGⅡ抗购于北京中杉金桥公司;PVDF膜购于Millipore;ECL化学发光试剂购于Bio-Rad;引物由北京华大基因公司合成;CD36过表达慢病毒购于上海吉凯基因化学有限公司。
3 主要方法
3.1 细胞培养及传代 使用含10%(体积分数)胎牛血清、1×105U/L青霉素G和100 mg/L链霉素的RPMI-1640完全培养基,将细胞置于37℃、5%CO2恒温箱中培养。每天将细胞吹散,每2 d换液1次,3~4 d传代1次。
3.2 细胞诱导 给予0、100和200 μg/L PMA诱导THP-1细胞,使之分化为贴壁生长的巨噬细胞。
3.3 干扰细胞的CD36表达CD36小干扰RNA(CD36small interfering RNA,siCD36)由上海生工生物工程公司设计并合成,正义链为5’-GGCUGUGUUUGGAGGUAUUCUTT-3’,反义链为 3’-TTCCGACACAAACCUCCAUAAGA-5’;阴性对照 scrambled siRNA(scrRNA)也由该公司提供。将THP-1细胞接种于6孔板,用scrRNA及siCD36分别转染THP-1细胞:在50 μL RPMI-1640培养基中加入0.25 μL siRNA,短暂轻柔涡旋,加入1 μL RNAiMAX,短暂轻柔涡旋,室温孵育15 min(15~25 ℃),将转染复合物逐滴加入到THP-1细胞中12 h,进行后续实验。
3.4 构建CD36过表达细胞系 采用CD36 cDNA的重组慢病毒转染构建CD36过表达(CD36OE)细胞系,或以空载体(vector)作为对照,然后用嘌呤霉素筛选转染的细胞,进行后续实验。
3.5 Western blot实验 取对数生长期的THP-1细胞接种于6 cm皿中常规诱导24和48 h后收集细胞,PBS洗涤细胞3次,加RIPA(含蛋白酶抑制剂,磷酸酶抑制剂),4℃裂解30 min。4℃、12 000×g离心15 min,吸取上清液,BCA法进行蛋白定量。经8%SDS-PAGE分离蛋白,PVDF膜转膜,3%BSA室温封闭1 h后,加入抗CD36抗体(1∶1 000)、抗p-ERK抗体(1∶1 000)、抗ERK抗体(1∶1 000)、抗p-Src抗体(1∶1 000)、抗Src抗体(1∶1 000)和抗β-actin抗体(1∶3 000)4℃孵育过夜,TBST洗膜3次,每次15 min,加Ⅱ抗于37℃摇床中孵育1 h,TBST清洗2次,每次15 min,最后用TBS洗涤1次,化学发光剂ECL显色曝光,采用ImageJ软件进行分析。
3.6 real-time PCR检测mRNA水平 使用Trizol提取细胞总RNA并检测其含量和纯度。将1 μg总RNA逆转录成cDNA,逆转录条件为:37℃5 min,85℃5 s,4℃5 min后终止。反应产物保存于-20℃。取2 μL逆转录产物进行real-time PCR,以β-actin为内参照,反应体系为25 μL。扩增条件为:94℃1 min;94℃ 10 s,54℃ 10 s,72℃ 10 s,39个循环。记录Ct值,以2-ΔΔCt计算目的基因转录水平。引物序列见表1。
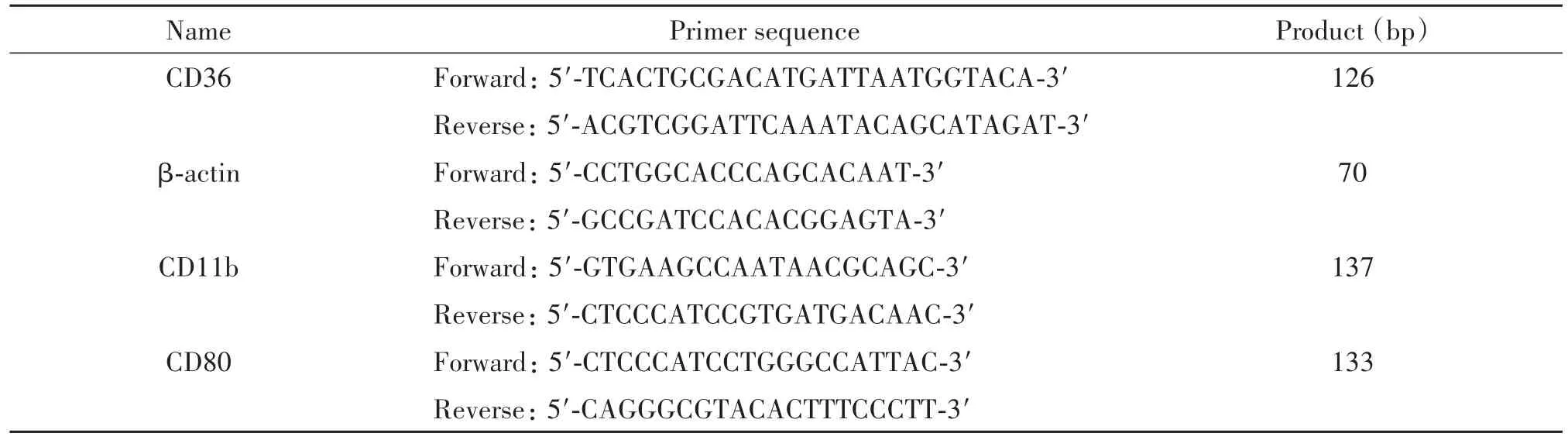
表1 real-time PCR的引物序列Table 1.The sequences of the primers for real-time PCR
3.7 细胞黏附实验 结晶紫染色观察细胞黏附情况。将细胞种于96孔板中,PBS洗2次,附着的细胞固定在4%的多聚甲醛中5 min。0.5%的结晶紫在20%的甲醇中溶解,配制成结晶紫染色液,染色3 min。将细胞在空气中干燥,用10%乙酸洗脱,595 nm下分光光度计检测吸光度(A)值。
3.8 细胞形态观察 取对数生长期的THP-1细胞接种于6 cm皿中常规诱导24 h,在普通光学显微镜下拍摄其形态,用ImageJ处理图像,求每个细胞的相对表面积(总的细胞相对表面积/细胞数)。
3.9 流式细胞术 取对数生长期的THP-1细胞接种于6 cm皿中,给予100 μg/L PMA诱导分化0 h、24 h、48 h和72 h。PBS洗涤细胞3次,收集细胞。对照管不加抗体,向待测管中加入抗人CD36-PE抗体,常温下孵育15 min。加入1 mL PBS,流式细胞仪检测细胞表面的CD36表达。
4 统计学处理
所有数据均采用GraphPad Prism 5统计分析软件进行处理,所得到的数值均以均数±标准误(mean±SEM)表示,两组之间的差异采用t检验差异分析,用单因素方差分析通过Tukey的多重比较检验对3组之间的差异进行统计分析。以P<0.05为差异有统计学意义。
结 果
1 人单核细胞THP-1向巨噬细胞分化过程中CD36表达增加
给予不同浓度的PMA处理THP-1细胞,诱导THP-1细胞向巨噬细胞分化。巨噬细胞分化过程中,细胞黏附性增加(P<0.01),见图1A。采用PMA(100 μg/L)处理THP-1细胞不同时间,分别用流式细胞术、Western blot和real-time PCR检测THP-1细胞内CD36的蛋白和mRNA水平,结果显示,在分化过程中CD36表达增加(P<0.01),见图1B~D。
2 干扰CD36抑制人单核巨噬细胞THP-1向巨噬细胞的分化
构建敲减CD36基因(CD36i组)和阴性对照(NCi组)THP-1细胞,利用real-time PCR和Western blot检测CD36的mRNA和蛋白表达情况。结果显示,与NCi组比较,CD36i组CD36的mRNA和蛋白表达显著降低(P<0.05),见图 2A、B。这表明敲减CD36基因的THP-1细胞模型建立成功。
在光学显微镜下观察两组THP-1细胞分化过程中的形态变化。结果显示,与NCi组比较,CD36i组细胞表面积明显减小(P<0.01),见图2C;结晶紫染色法检测两组THP-1细胞分化过程中黏附活性差异显示,CD36i组的THP-1单核细胞黏附活性明显小于阴性对照组(P<0.01),见图2D;real-time PCR检测两种THP-1细胞分化过程中CD11b和CD80的mRNA表达,结果表明CD36i组的THP-1单核细胞CD11b和CD80的mRNA明显低于阴性对照组(P<0.01),见图2E、F。
3 过表达CD36促进人单核巨噬细胞THP-1向巨噬细胞分化
构建CD36OE THP-1细胞系,同时采用vector转染细胞作为对照,利用real-time PCR和Western blot检测CD36的mRNA和蛋白表达情况。结果显示,与vector组比较,CD36OE组CD36的mRNA和蛋白表达显著升高(P<0.05),见图3A、B。这表明CD36过表达THP-1细胞系建立成功。

Figure 1.CD36 expression in the process of monocyte-macrophage differentiation.A:THP-1 cells were incubated with PMA(0,100 and 200 μg/L)for 24 h,and the crystal violet absorbance(A)was measured at a wavelength of 595 nm;B:the protein expression of CD36 was analyzed by flow cytometry;C:the mRNA level of CD36 was detected by real-time PCR;D:the protein expression of CD36 was determined by Western blot.Mean±SEM.n=3.##P<0.01 vs 0 μg/L group;*P<0.05,**P<0.01 vs 0 h group.图1 CD36在单核巨噬细胞向巨噬细胞分化过程中的表达变化
在光学显微镜下观察两种THP-1细胞分化过程中的形态变化。结果显示,与vector组比较,CD36OE组细胞表面积明显增大(P<0.05),见图3C;结晶紫染色法检测两种THP-1细胞分化过程中黏附活性差异,CD36过表达组的THP-1单核细胞黏附活性明显大于对照组(P<0.01),见图3D;real-time PCR检测两种THP-1细胞分化过程中CD11b和CD80的mRNA,结果显示,CD36过表达组的THP-1单核细胞CD11b和CD80的mRNA水平明显高于对照组(P<0.01),见图3E、F。
4 干扰CD36表达抑制ERK的磷酸化
THP-1细胞向巨噬细胞分化过程中,Western blot检测ERK及其磷酸化水平,结果表明,随着分化时间延长,ERK的磷酸化水平明显升高(P<0.05),见图4A。NCi组和CD36i组的THP-1细胞向巨噬细胞分化过程中,Western blot检测p-ERK和ERK的蛋白水平变化,结果表明干扰CD36表达后,ERK的磷酸化水平明显低于对照组(P<0.05),见图4B。
5 干扰CD36表达抑制Src信号通路
NCi组和CD36i组的THP-1细胞向巨噬细胞分化过程中,采用Western blot检测Src酪氨酸激酶及其磷酸化水平。结果表明,干扰CD36后,Src的磷酸化水平明显低于对照组(P<0.05),见图5。
讨 论
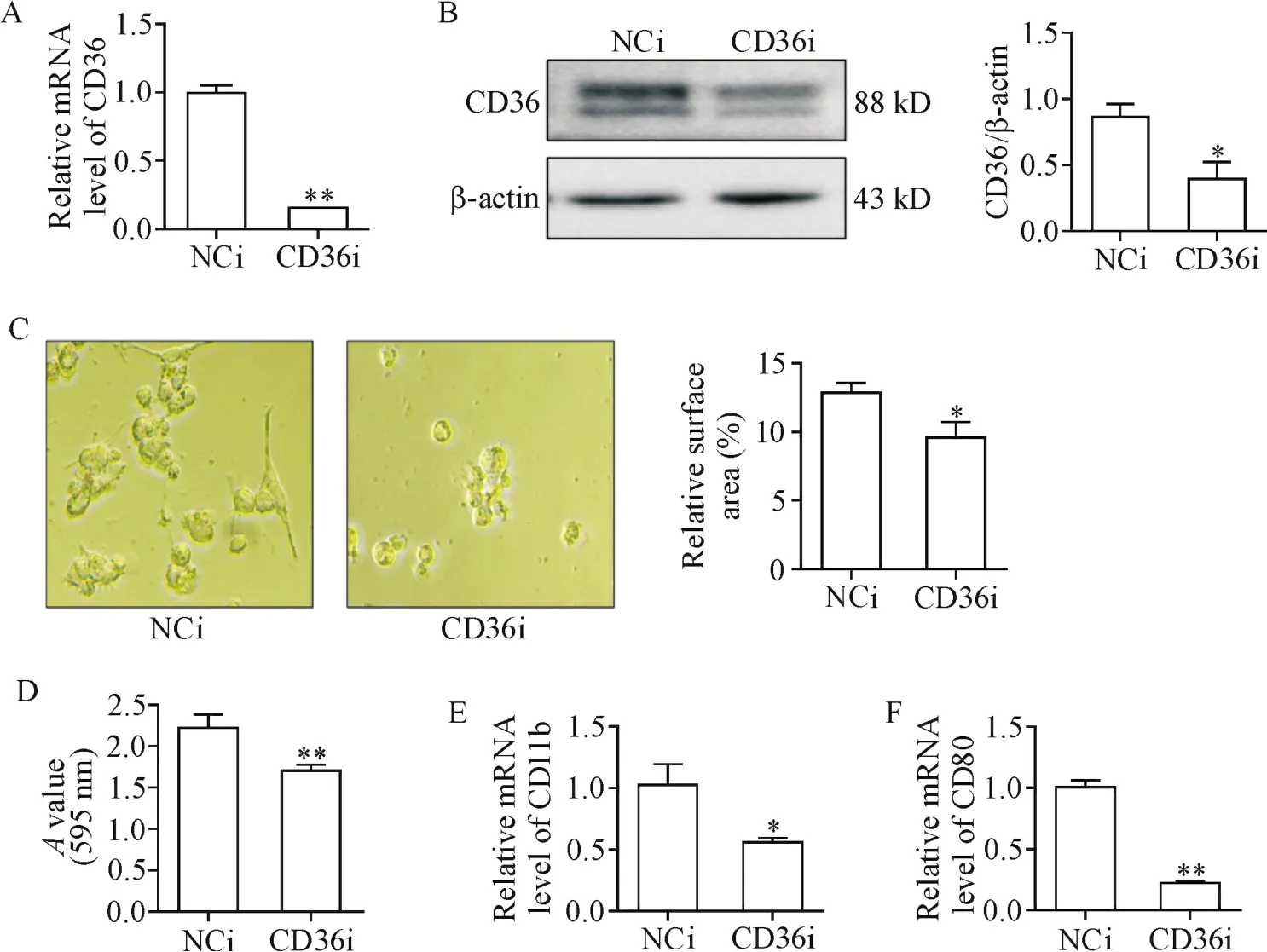
Figure 2.The effect of CD36 expression knock-down on the differentiation of THP-1 cells into macrophages.THP-1 cells were incubated with PMA(100 μg/L)for 24 h.A:the mRNA expression of CD36 in the THP-1 cells was detected by real-time PCR;B:the protein expression of CD36 in the THP-1 cells was determined by Western blot;C:the optical microscopic images(×400)showed the monocyte adhesion,and the surface area was determined;D:the crystal violet absorbance(A)was measured at a wavelength of 595 nm;E:the mRNA expression of CD11b in the THP-1 cells was detected by real-time PCR;F:the mRNA expression of CD80 in the THP-1 cells was detected by real-time PCR.Mean±SEM.n=3.*P<0.05,**P<0.01 vs NCi group.图2 敲减CD36表达对THP-1细胞向巨噬细胞分化的影响
既往研究认为,单核细胞向巨噬细胞的分化在动脉粥样硬化的发展中起着重要的作用。循环单核细胞在暴露于各种调节信号后会分化为组织巨噬细胞,并继续积累,形成具有黏附性的动脉病变斑块。众所周知,单核细胞向巨噬细胞的分化可以促进炎症和动脉粥样硬化[4]。因此,调节单核细胞向巨噬细胞的分化可以为炎症性疾病如动脉粥样硬化提供至关重要的保护。
CD36作为B类清道夫受体,可识别较多致炎的内源性代谢产物,如氧化低密度脂蛋白、长链脂肪酸、非修饰的脂蛋白和淀粉样蛋白等[5],已被认为是将机体的天然免疫和代谢过程有机联合在一起的重要靶点。既往研究提示,CD36调控巨噬细胞迁移、炎症和介导氧化低密度脂蛋白的摄取,导致泡沫细胞形成,在动脉粥样硬化发生发展中起关键作用[6-7]。人主动脉粥样斑块中巨噬细胞上CD36的表达显著增加[8]。CD36的异常升高可能是动脉粥样硬化病变发生和发展的生物标志事件之一。但目前CD36在动脉粥样硬化中的功能是有争议的,CD36表达可能存在“最佳保护窗口”[1]。
本研究发现,在THP-1细胞向巨噬细胞的分化过程中,CD36的表达是升高的,与既往的研究结果一致[3]。单核细胞向巨噬细胞分化的一个重要标志是细胞表面积增大,有伪足样突起,黏附性增加[9]。分化标记物CD11b,CD80的表达也增加[10-11]。我们发现干扰CD36后THP-1细胞向巨噬细胞的分化减少,表现为细胞表面积和伪足样突起减少,粘附能力下降;CD11b和CD80的表达降低;同时在CD36过表达的THP-1细胞上,THP-1细胞向巨噬细胞的分化增加,表现为细胞表面积和伪足样突起增加,黏附能力增强;CD11b和CD80的表达升高。
ERK1和ERK2是涉及许多细胞途径的丝氨酸/苏氨酸激酶。既往研究表明ERK1/2途径参与细胞生长和分化,ERK1/2完全缺失的骨髓前体细胞,由于M-CSF无法通过ERK传递关键的生长信号而无法有效生长或分化为巨噬细胞[12]。单核巨噬细胞中ERK1/2的激活,可通过影响单核细胞分化而导致心血管炎症性疾病,参与动脉粥样硬化的形成[13]。我们发现单核细胞分化过程中ERK的磷酸化水平是升高的,与既往的研究一致[9]。干扰CD36抑制了单核细胞分化过程中磷酸化ERK1/2的上调,并且减少了其向巨噬细胞的分化,说明CD36可能通过ERK通路调节单核细胞向巨噬细胞的分化。

Figure 3.The effect of CD36 over-expression on the differentiation of THP-1 cells into macrophages.THP-1 cells were incubated with PMA(100 μg/L)for 24 h.A:the mRNA expression of CD36 in the THP-1 cells was detected by real-time PCR;B:the protein expression of CD36 in THP-1 cells was determined by Western blot;C:the optical microscopic images(×400)showed the monocyte adhesion,and the surface area was determined;D:the crystal violet absorbance(A)was measured at a wavelength of 595 nm;E:the mRNA expression of CD11b in the THP-1 cells was detected by real-time PCR;F:the mRNA expression of CD80 in the THP-1 cells was detected by real-time PCR.Mean±SEM.n=3.*P<0.05,**P<0.01 vs vector group.图3 CD36过表达对THP-1细胞向巨噬细胞分化的影响
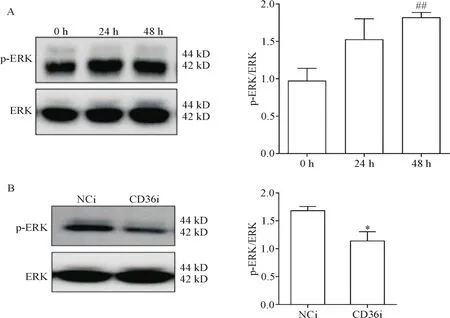
Figure 4.The effect of CD36 expression knock-down on ERK phosphorylation.A:THP-1 cells were incubated with PMA at 100 μg/L for 0,24 and 48 h,and the protein levels of p-ERK and ERK were determined by Western blot;B:THP-1 cells were incubated with PMA(100 μg/L)for 24 h,and the protein levels of p-ERK and ERK in the THP-1 cells was determined by Western blot.Mean±SEM.n=3.##P<0.01 vs 0 h group;*P<0.05 vs NCi group.图4 敲减CD36表达对ERK磷酸化的影响
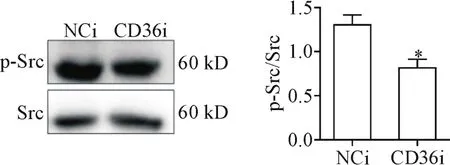
Figure 5.The effect of CD36 expression knock-down on Src phosphorylation.THP-1 cells were incubated with PMA at 100 μg/L for 24 h after knock-down of CD36,and the protein levels of p-Src and Src in the THP-1 cells were determined by Western blot.Mean±SEM.n=3.*P<0.05 vs NCi group.图5 敲减CD36对Src磷酸化的影响
在许多情况下,CD36介导的细胞内信号转导是由Src家族非受体酪氨酸激酶引发的。Src家族激酶不仅在肿瘤生物学中发挥重要作用,而且还调节巨噬细胞功能,包括在泡沫细胞形成和促炎性细胞因子表达中发挥作用[14]。Src家族的磷酸化和活化,可进一步激活丝裂原激活的蛋白激酶ERK1/2[15]。在本研究中,我们也发现干扰CD36表达,抑制THP-1细胞分化过程中磷酸化Src的上调,提示抑制CD36表达显著抑制Src通路的活性。
综上所述,CD36可以激活Src的磷酸化,进一步促进ERK的磷酸化和活化,最终促进单核细胞向巨噬细胞的分化。本研究为临床治疗及预防动脉粥样硬化提供了新的思路。
