基于核酸的分子生物学技术在食品过敏原检测中的应用进展
2020-07-06苏琰李融
苏琰,李融
1(合肥职业技术学院,安徽 合肥,238000)2(巢湖学院,安徽 合肥,238000)
变态反应(allergy)是PIRQUET于1906年基于其传染病学和免疫学领域的临床研究提出的[1],指机体免疫防御功能亢进引起的一种异常免疫应答。过敏原(allergen)即引起超敏反应的抗原。超敏反应的临床表现多种多样,其中食物过敏(food allergy)是由食物某些成分的诱导而产生以特异性IgE为主的病理性免疫应答,其症状不仅表现在消化道方面,也包括皮肤、神经系统及呼吸系统等。
2015年我国婴幼儿过敏流行病学调查结果表明,大约40.9%婴幼儿(2岁以下)家长报告婴幼儿有过敏性疾病发生[2]。食品中过敏原的体外检测主要包括蛋白质检测与核酸检测两方面[3]。其中基于蛋白质检测方法主要包括酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)和色谱分析(chromatography)等,传统的基于蛋白质的过敏原检测方法因食物在生产加工过程中蛋白质易变性和降解而导致假阴性结果;基于核酸水平检测包括针对过敏原基因的扩增技术和杂交技术等,近年来核酸检测技术尤其是PCR技术不断建立并推广应用。本文主要从食品过敏原的核酸扩增检测技术和核酸杂交检测技术两方面,综述了过敏原的核酸检验技术的研究进展。
1 常见过敏原
国际食品法典委员会是联合国粮食及农业组织和世界卫生组织于1963年共同设立的国际组织并制定了具有重要指导意义的食品国际标准,其公布的《预包装食品标签通用标准》中对食品中可能存在的致敏成分应予以说明。国家食品发典委员会中规定的八类过敏原有:谷类(含麸质蛋白);甲壳纲类动物及甲壳类制品,如蟹、虾等;蛋类及蛋类制品,如鸡蛋等;鱼类及其鱼类制品,如鲈鱼、鳕鱼等;花生、大豆及其制品;乳及乳制品(包括乳糖);坚果及其制品,如杏仁、腰果、核桃等;浓度大于等于10 mg/kg的亚硫酸盐[4]。
我国相关食品标签法规对八大类过敏原及其他过敏原种类做出了强制或推荐标识的相关规定[5]。日本自2015年发布了《食品标识基准》对相关食品标签作出规定[6],韩国也对须标注的一些食品过敏原作出强制标注的规定。欧盟除强制标注八大类过敏原以外,还增加了芹菜及其制品等,将强制性标注过敏原种类增加到14类[7-8]。
2 基于核酸的分子检验技术在食品过敏原检测中的应用
2.1 核酸扩增技术检测过敏原
1985年MULLIS[9]发明了聚合酶链式反应(polymerase chain reaction,PCR),最初的PCR技术采用的是大肠杆菌DNA聚合酶I的Klenow片段,缺点是不耐热,SAIKI等[10]于1988提取了水生嗜热杆菌的耐热的DNA聚合酶,提高了扩增特异性和灵敏度,极大推动分子生物学的发展。由普通PCR的定性或半定量检测逐步发展到实时荧光定量PCR和数字PCR的定量检测[11],检测准确度不断提高,可扩增目的基因片段逐渐增大,引物设计也多样化[12]。近年来衍生出RT-PCR、巢式-PCR、DPO-PCR、实时荧光定量PCR、多重PCR、数字PCR、PCR芯片和菌落PCR等,广泛应用于食品安全检测、基因分型、临床检验和环境监测等各领域。实时荧光定量PCR实时测定探针标记的靶基因的荧光信号,通过信号强度、Ct值和靶基因的起始浓度之间的关系计算其扩增拷贝数或表达水平。与第一代PCR相比,该技术实现了定量检测,然而其检测灵敏度也受到模板浓度等的影响。数字PCR是近几年来迅速发展的新型PCR检测技术,被称为第三代PCR技术,在克服了前两代PCR缺点的基础上,数字PCR具有对样本需求量低、灵敏度高和绝对定量等优点[13]。
2.1.1 普通PCR检测过敏原
与蛋白质检测方法相比,核酸检测的优势在于:热变性条件下DNA仍可有效提取且稳定性较好。普通PCR检测过敏原基因的方法建立较早,如YANO等[14]在2007年就针对核桃matK基因设计了WAL-F/WAL-R引物对,建立了普通PCR方法对食品中的微量核桃进行定性检测。然而最初的传统PCR检测技术仅能定性或半定量检测食品中某一种过敏原基因,随着分子生物学检验技术的不断发展,能够同时检测多种过敏原或者准确度更高的PCR方法被不断设计出。
2.1.2 多重PCR检测过敏原
多重PCR(multiplex polymerase chain reaction,MPCR)是1988年由CHAMBERLAIN等提出[15],与普通PCR相比,其原理及结果分析与普通PCR一致,不同点在于设计2对或多对引物在同一反应体系扩增出2个或多个相应基因片段。多重PCR既拥有传统PCR较高特异性和灵敏度等的特点,也体现出同时扩增多种目的基因的高效性。由于多对引物在同一体系内扩增,为了准确扩增出目的条带而不受其他因素干扰,对扩增条件要求较高,对引物设计、循环条件优化等方面要求较严格。目前该技术已广泛应用于食品安全检测,转基因检测及医学检验等领域[16-17]。加工食品中可能会同时含有多种过敏原,单一成分过敏原检测费时费力,可同时检测多种过敏原成分的多重PCR检测技术的高效性则显得尤为重要,食品过敏原的多重PCR检测应用见表1。
2.1.3 荧光定量PCR检测过敏原
1996年美国Applied Biosystems公司推出实时荧光定量PCR(quantitative real-time PCR),可分为两类:一类是DNA结合染料如SYBR Green Ⅰ等以提高荧光强度进行检测;另一类特异性检测方法是Taqman法,即在PCR体系中引入Taqman探针,DNA聚合酶延伸至于探针所在位置将其水解产生荧光信号进行检测。该技术的出现使分子检验技术领域发生重大的变化,目前已广泛地应用于临床医学检验、动植物病原体感染以及食品安全如过敏原检测等定量检验检测等领域[22-23]。实时荧光定量PCR较上述几种PCR技术灵敏度高,可定量检测分析。也可将实时荧光定量PCR与多重PCR相结合,建立更为快捷准确的检测体系。近年来建立多种食源性过敏原的qPCR检测方法,详见表2。

表1 基于多重PCR的食品过敏原检测方法Table 1 Multiplex PCR based methods for food allergens
2.1.4 数字PCR检测过敏原
数字PCR(digital PCR,dPCR)是将待检核酸样本分成多份,随机分布于大量的独立扩增体系中,尽可能使每扩增体系只包含单个拷贝模板,并对其反应信号进行检测和统计学分析,从而实现绝对定量检测。数字PCR于1999年由VOGELSTEIN等提出,并在96孔和384孔微量反应孔中进行致癌突变基因ras定量分析[34]。
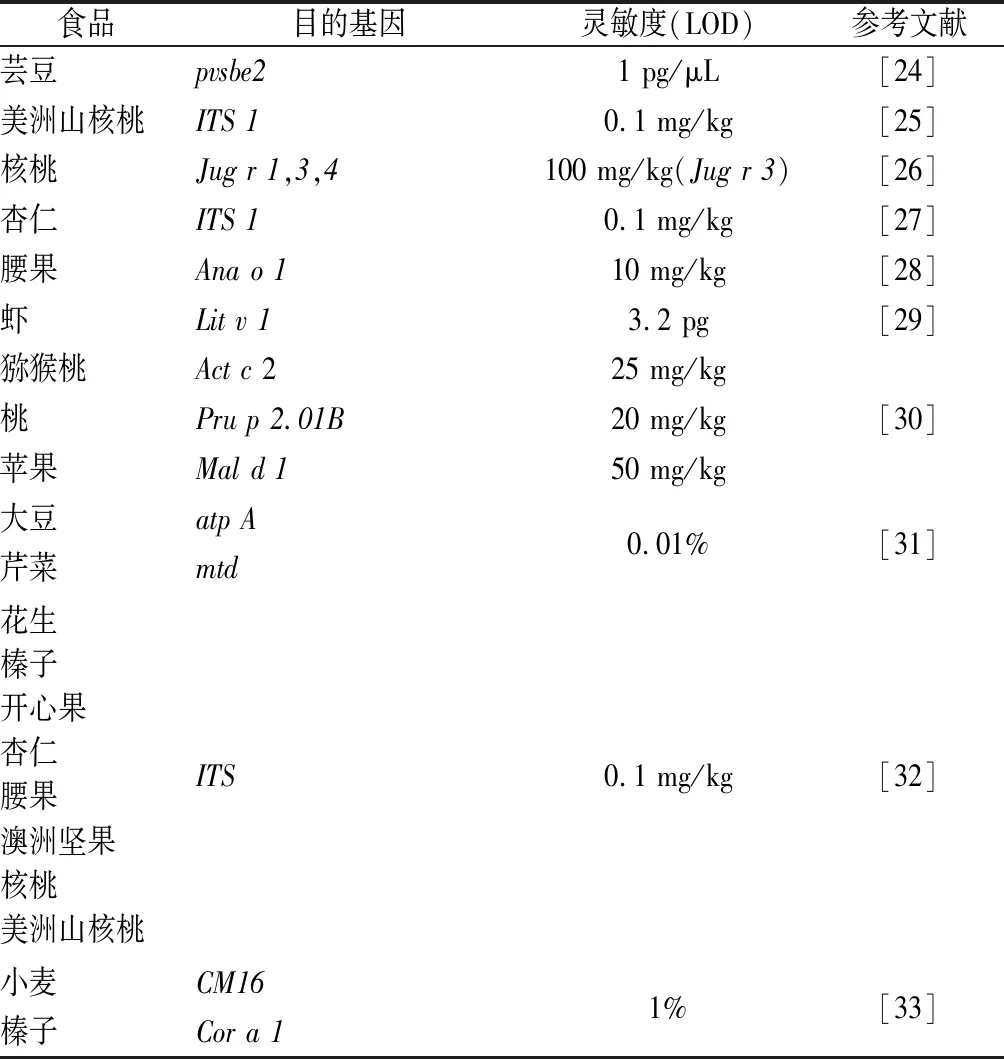
表2 基于实时荧光定量PCR的食品过敏原检测方法Table 2 Quantitative real-time PCR based methods for food allergens
与qPCR相比,数字PCR无需依赖标准品或建立标准曲线,检测结果不受扩增效率的影响,最终的检测结果通过对阳性和阴性反应单元数统计分析以及泊松分布修正,从而实现绝对定量分析。且随着微纳制造等相关技术和产业化的发展,实现了数以万计甚至更多的PCR独立反应单元的制备,全球各大生物仪器公司纷纷开发出各类商业化的数字PCR检测系统[11]。
根据反应单元的划分,目前商业化数字PCR平台主要分为芯片式和微液滴式。微孔芯片dPCR系统指的是样本分布在微容量固体反应单元中进行目的基因扩增并对每单元进行实时或终点荧光检测分析。如Life Technologies公司的Open Array dPCR系统、QuantStudioTM12K Flex dPCR系统和QuantStudioTM3D dPCR系统等。微液滴式dPCR系统指的是将样本分散在独立的“油包水”微小液滴反应单元中进行目的基因扩增,并对每单元扩增结果进行实时或终点荧光检测分析。如Bio-Rad公司开发的QX200TMdPCR系统和RainDance公司的RainDropTMdPCR系统[35]。目前,基于上述芯片式dPCR系统或微滴式dPCR系统商业检测平台已较多应用于转基因、食品安全检测以及临床医学检验等各领域[36-37]。
利用数字PCR系统检验食品过敏原的方法研究近年来也逐步开展和建立。PIERBONI等[38]建立了食品中大豆和花生的数字PCR检测方法,针对大豆的Glym30、Glym5、Lectin基因和花生的Arah1、Arah2基因设计引物,利用dPCR检测大豆和花生,并同时将dPCR与qPCR及ELISA等作对比研究。MAYER等[39]针对大豆的叶绿体DNA的ndhH基因设计数字PCR引物检测大豆成分,灵敏度达到0.16 mg/kg。
2.1.5 环介导的核酸等温扩增技术检测过敏原
NOTOMI等开发了环介导等温扩增(loop-mediated isothermal amplification,LAMP)[40],根据6对特异序列设计2对内外引物:2条较长的内引物和2条较短的外引物,通过链置换DNA聚合酶在约60~65 ℃等温下完成基因的循环扩增,最终形成不同的梯度结构[41]。LAMP的焦磷酸镁沉淀产物肉眼即可观察其浑浊变化程度从而判断来是否有目的基因扩增。除此以外,也可观察凝胶电泳是否为梯形条带;或将荧光染料掺入反应产物中,用紫外灯照射直接观察其颜色的变化以判断检验结果[42];或通过比浊法检测焦磷酸镁沉淀。LAMP与普通PCR相比,检测速度更快,不需要进行模板的变性、循环及电泳等过程,是一种新型的简单、快速、特异性强、检验成本较低且可以不需要依赖精密仪器设备的分子生物学检验技术。LAMP目前已经应用于动植物病毒、细菌、真菌毒素、医学检验以及食品安全监测等各领域[43-44],具有较为广阔的应用前景。环介导等温扩增与其他扩增技术相比,更为简单快捷,可不依靠精密仪器等优点,在食源性过敏原的快速检测领域也逐渐受到关注(表3)。

表3 基于环介导等温扩增技术的食品过敏原检测方法Table 3 Loop-mediated isothermal amplification based methods for food allergens
2.2 核酸分子杂交技术检测过敏原
基于核酸的分子杂交技术有固相、液相和原位杂交等。固相核酸杂交技术将待检DNA/RNA转移并固定在固相膜上,对应的互补探针在载体膜上与待检靶序列杂交反应,并检测杂交的探针信号。该技术的优点是高灵敏度、高效及高通量等,也已应用于动、植物等病毒检测、食品安全检测以及基因的鉴定及定性分析等[51]。液相反应系统如悬浮芯片技术(suspension array technology,SAT)是用特殊编码的微球颗粒作为载体来固定探针,是一种集编码、流式细胞技术和电子信息技术等于一体的检测技术。该技术在食品过敏原检测也有应用,CHRISTOPOULOU等人设计了探针微球同时检测加工食品中所含榛子、花生和核桃3种过敏原,最低检出限可达0.01%[52]。
2.2.1 基于DNA的芯片检测技术检测过敏原
基于核酸的生物芯片检测技术是利用核酸分子杂交的原理,将其中已知序列核酸链(探针)标记后固化于芯片基质表面,与待测样本核酸(靶序列)利用碱基互补配对原则进行分子杂交检测,通过杂交信号检测完成对靶序列的定性或定量检测,分析待测样本靶基因的有无或其表达的变化[53]。因此,与传统的核酸印迹杂交技术如DNA印迹(southern blotting)或RNA印迹(northern blotting)等不同,基因芯片技术采用的是一种反向杂交。其突出优点是能够大规模、高通量、准确快速地同步分析待检基因。
2.2.2 基于DNA的生物传感器检测技术检测过敏原
基于DNA的生物传感器是将核酸杂交信号通过转换器转换为光电等物理信号并对此进行定量检测,将高度特异性的核酸杂交与高度敏感性的物理信号转导相互协作[54],具有准确、高效、自动化、专一性强,可连续重复利用以及操作简便等优点。
核酸杂交检测技术在过敏原检测领域具有突出优势,通过开发精密检测仪器不断提高检测的准确度,多种过敏原的相关鉴定方法相继建立(表4)。
3 展望
随着食品加工技术的多元化发展,加工食品的功能和特性均得到了提升改善,但亦可能在生产过程中引入多种过敏原,从而增加了过敏风险,因此建立高效准确的食源性过敏原的检测方法具有重要意义。
目前过敏原检测仍然以蛋白质检测为主,其中应用较为广泛的是免疫学检验技术,如酶联免疫吸附试验和化学发光免疫分析等,具有特异性强和准确率高等优点,但检测耗时较长。市场上大部分商业化的试剂盒仍然是针对食品中单一过敏原成分进行检测,不能同时检测多种蛋白过敏原,且在痕量检测方面略显不足。近年来也相继建立起多种过敏原的质谱检测体系[60],需注意的是不同样本处理方法对结果影响较大且成本较高。
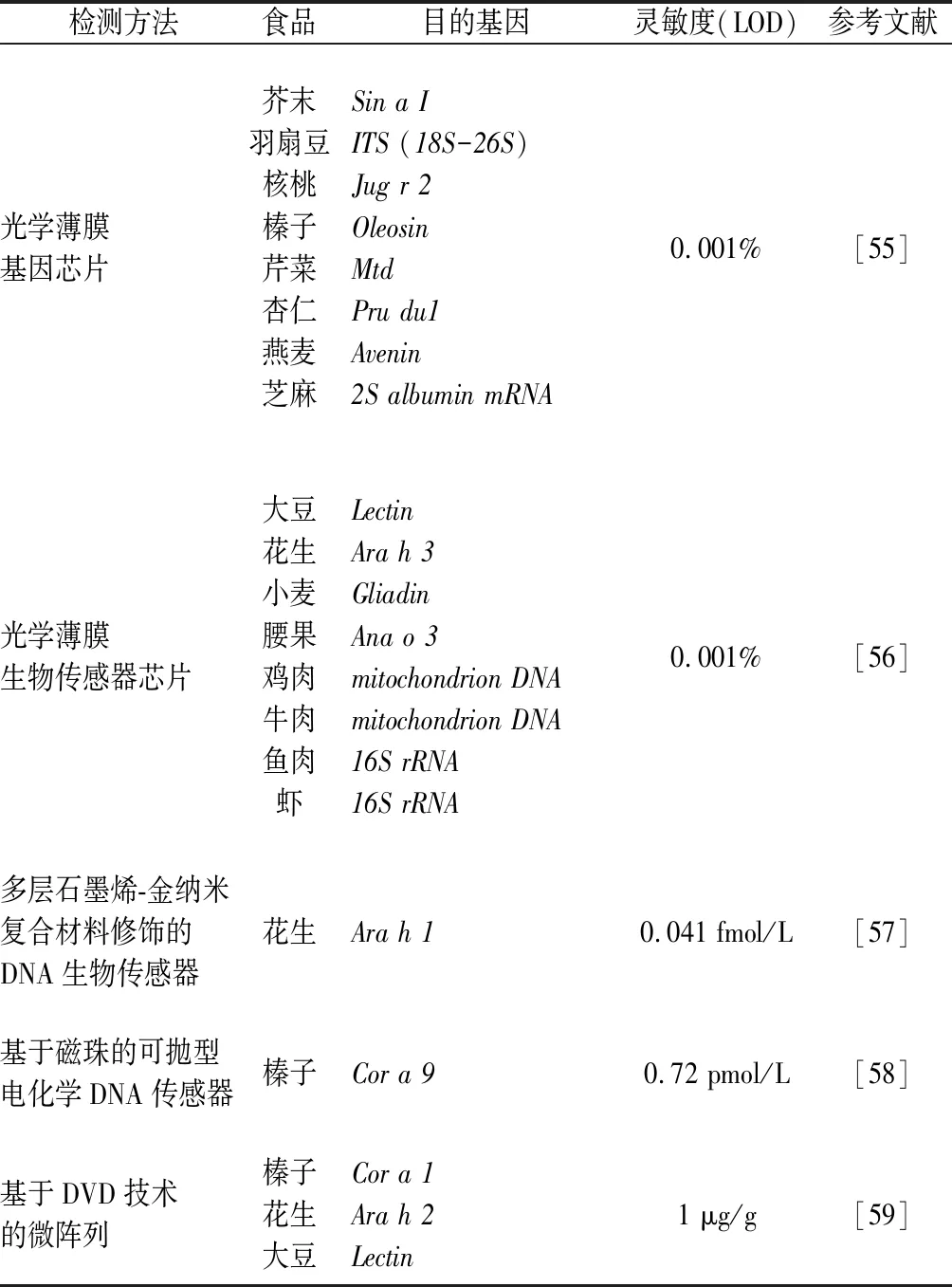
表4 基于核酸杂交技术的食品过敏原检测方法Table 4 Nucleic acid hybridization based methods for food allergens
与蛋白质检测相比,基于核酸的分子生物学检测技术能够更加简便、快捷、高灵敏度地检测食品中存在的过敏原基因。基于基因扩增的PCR技术从定性检测发展到定量检测,其检测精确度不断提高,引物设计越来越多样化,可检测范围逐渐扩大。核酸杂交技术可在同时、短时内分析多种过敏原基因,使得过敏原基因检测更加简便快速,实现了高通量和自动化检测。然而核酸检测技术也存在一些缺点,比如对仪器设备要求高,检测步骤较为繁琐以及检测时间较长,检测对象为核酸而非致敏蛋白等。
综上所述,现阶段的检测手段仍不能完全满足实际检测工作的需求。对于过敏原的核酸检测技术,今后一方面需对核酸检测技术的条件进行优化和改进,不断提高其特异性和灵敏度;另一方面则需要研发更为先进便携的检测设备,为实现快速高效的现场核酸检测提供方便。此外,蛋白质检测和核酸检测各具优点,可将多种检测技术相互结合以满足实际检测工作中的多元化要求。
