缫丝蚕蛹与黄豆的纳豆菌发酵上清液功能活性的比较
2020-07-06卢美杉朱蓓薇付云刘小玲
卢美杉,朱蓓薇,付云,刘小玲*
1(广西大学 轻工与食品工程学院,广西 南宁,530004) 2(国家海洋食品工程技术研究中心,辽宁 大连,116034)
我国缫丝蚕蛹资源丰富,年产量已达50万t以上,具有较高的营养价值。蚕蛹干燥后蛋白质含量在40%左右,并且还富含多种维生素以及Fe、Zn、Se等微量元素[1-2]。作为优质蛋白质替代来源,蚕蛹也是最符合人体需要的氨基酸来源代表之一[3]。2004年,蚕蛹被卫生部批准为“普通食品管理的食品新资源”,也是其中仅有的昆虫类原料。研究证实,蚕蛹具有抗肿瘤、抗氧化、降血压、抗疲劳、预防肝损伤、延缓衰老等作用[4-5]。已有研究表明,蚕蛹的纳豆菌发酵产物具有抗菌活性[6],但并没有对其抗凝血和降血脂活性进行研究。
纳豆菌是枯草芽孢杆菌的一个亚种,属于益生菌[7]。本实验发酵用纳豆菌菌株为北京川秀科技生产的纳豆菌冻干粉经活化后涂板得到,在其发酵过程中会生成纳豆激酶等酶。因此,本研究采用纳豆菌发酵蚕蛹粉,对发酵产物的纤维蛋白溶解率、ABTS自由基清除率、胆酸盐结合率、以及抗凝血活性的4项指标进行分析,并同黄豆发酵液进行比较。本研究探讨了蚕蛹替代黄豆进行纳豆菌发酵的可行性,并期望提高缫丝副产物-蚕蛹的附加值和利用度。
1 材料与方法
1.1 材料与试剂
缫丝蚕蛹,广西河池桑蚕基地;东北黄豆,南宁百货;新鲜牛血浆采于西大动科学院健康成年牛。
种子培养基(g/L):蛋白胨10、牛肉粉30、葡萄糖10,调节pH至7.0。
黄豆培养基(g/L):黄豆冻干粉30、蔗糖10、KH2PO41、K2HPO42.5、 MgSO40.5。
蚕蛹培养基(g/L):蚕蛹冻干粉30、蔗糖10、KH2PO41、K2HPO42.5、MgSO40.5。
纳豆菌,北京川秀科技;氨基酸标准品(优级纯),上海哈灵生物科技;N,N,N′N′-四甲基乙二胺(生化级);纳豆激酶标品(Nattokinase),和光纯药工业株式会社;纤维蛋白、凝血酶、水溶性VE、胃蛋白酶、胰蛋白酶、牛黄胆酸钠、甘氨胆酸钠、胆酸钠,上海麦克林生物化学有限公司;枸橼酸钠,国药集团化学试剂;其他试剂均为国产分析纯。
1.2 仪器与设备
真空冷冻干燥机,北京博医康实验仪器有限公司;RCT basic磁力搅拌器,德国IKA公司;RE-52旋转蒸发器,上海亚荣生化仪器厂;L-8900氨基酸分析仪,日本日立公司;Bio-Rad ChemiDoc XRS凝胶成像仪,美国伯乐公司;CR21N高速冷冻离心机,日立公司;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;UV6100紫外可见分光光度计,上海美谱达公司;SUNRISE酶标仪,帝肯(上海)贸易有限公司;T25高速分散均质机,德国IKA公司;CS-5100全自动凝血分析仪,日本Sysmex。
1.3 蚕蛹基础组成成分分析
分别将新鲜的缫丝蚕蛹与浸泡过夜的黄豆去皮匀浆,-50 ℃下采用真空冷冻干燥机处理48 h将其冻干成粉。
冷冻干燥后的蚕蛹粉分别参照GB5009.3—2016、GB5009.4—2016、GB5009.6—2016、GB5009.5—2016 对水分、灰分、脂肪、蛋白含量进行检测。
蛋白含量的计算参考国标中的计算公式,其中蛋白质折算系数定为6.25(其他食品)。
1.4 氨基酸组成与总氨基酸含量的测定
参考GB/T5009.124—2016氨基酸的检测方法进行测定。
1.5 蚕蛹蛋白聚丙烯酰胺凝胶电泳
前处理参考李健等与穆利霞等[8-10]的方法提取蛋白。得到的蛋白用蒸馏水清洗后,4 000 r/min离心5 min,至上清液澄清无味,经真空冷冻干燥获得淡褐色蚕蛹蛋白粉。对该蛋白进行SDS-PAGE分析(浓缩胶质量浓度50 g/L、分离胶质量浓度12 g/L,电压90 V),1.5 h后经考马斯亮蓝染色,置于凝胶成像系统中进行分析[11]。
1.6 纳豆菌的活化及生长曲线测定
将购得的纳豆菌粉活化后稀释涂板,挑单菌落37 ℃下在LB液体培养基中培养24 h,将菌液以体积比1∶1与40%的丙三醇混合,置于-80 ℃保存。
以1%的接种量将纳豆菌接种到种子培养基培养,37 ℃、160 r/min条件下培养24 h进行一次活化。分别取1 mL活化后的菌液,加入7瓶100 mL种子培养基中37 ℃、160 r/min条件下培养24 h(此过程即为二次活化),每隔4 h从培养箱中取出1瓶培养液,测定菌液的吸光度OD600, 并绘制纳豆菌在种子培养基中的生长曲线。
取二次活化后的菌液以1%的接种量接种到发酵培养基中,37 ℃、160 r/min条件下培养32 h,每隔8 h取出1瓶黄豆发酵液,1瓶蚕蛹发酵液,测定菌液的吸光度OD600,并绘制纳豆菌在不同发酵培养基中的生长曲线。
1.7 纳豆菌不同发酵液的活性分析
1.7.1 发酵液的制备
取二次活化生长稳定期的纳豆菌液以体积比1∶100 加入新鲜蚕蛹培养基、煮熟蚕蛹培养基、黄豆培养基中(新鲜蚕蛹培养基中蚕蛹粉进行紫外灭菌,剩余成分与其他2种培养基一同121 ℃、20 min灭菌),恒温摇床37 ℃、160 r/min发酵。发酵时间分别为8、16、24、32 h。将发酵液在4 ℃,9 000 r/min的条件下离心,得到上清液取部分直接测定纳豆激酶酶活,其余置于-20 ℃存放,用于其他指标测定。本文后面出现的CSC(cooked silkworm chrysalis)、FSC(fresh silkworm chrysalis)、CSB(cooked soybean)分别指煮熟蚕蛹纳豆菌发酵液、新鲜蚕蛹纳豆菌发酵液、黄豆纳豆菌发酵液。
1.7.2 纳豆激酶酶活的测定
采用纤维蛋白降解法测定纳豆激酶活[12-14]。将0.4 mL的纤维蛋白原溶液(7.2 g/L)和1.5 mL的Tris-HCl(0.050 mol/L,pH 7.8)混合并在37 ℃下温育5 min;再向其中加入0.2 mL凝血酶(10 U/mL),37 ℃下温育10 min,得到纤维底物溶液。加入0.1 mL发酵液在37 ℃下孵育60 min。每20 min摇动混合溶液。孵育后加入2 mL三氯乙酸(trichloroacetic acid,TCA)溶液(0.2 mol/L)终止反应。作为阴性对照,将纤维底物溶液37 ℃温育60 min后,将0.1 mL发酵液和2 mL TCA溶液(0.2 mol/L)加入其中。将样品以6 700 r/min离心15 min,并测量275 nm处的吸光度。1个单位的纳豆激酶活性(FU)定义为1 min吸光度增加0.01的量。阳性对照为用生理盐水溶解的不同浓度梯度的纳豆激酶标品(0.02、0.01、0.005、0.002 5 g/mL)。
1.7.3 ABTS自由基清除活性的测定
参考DAI等与王立博等的方法测定ABTS自由基的清除率[15-17]。将7.4 mmol/L ABTS 0.2 mL 与2.6 mmol/L K2S2O80.2 mL混合后置于室温黑暗处12 h,用pH 7.4的磷酸盐缓冲液稀释40~50倍,直至OD734达到0.7±0.02,得到ABTS工作液。取3 mL ABTS工作液加200 μL 10倍稀释后的发酵液充分摇匀,静置6 min,测定734 nm处的吸光值。空白对照为PBS缓冲液,阳性对照为20 mg/mL Trolox。ABTS自由基清除率的计算如公式(1)所示:
(1)
式中:A0为空白对照在734 nm处的OD值;A为发酵液在734 nm处的OD值。
1.7.4 降血脂活性的测定
1.7.4.1 三种胆酸盐标准曲线的绘制
用0.1 mol/L,pH 6.3的磷酸缓冲溶液配制0.3 mmol/L牛磺胆酸钠、甘氨胆酸钠、胆酸钠溶液定容至100 mL,参考刘山等、王静辉等的方法[18-19]绘制出3种胆酸盐的标准曲线,经处理得到牛黄胆酸钠、甘胆酸钠、胆酸钠的线性回归方程分别为:y=0.161 7x+0.074 2,R2=0.998 4;y=0.186x+0.074 6,R2=0.999 4;y=0.202 6x+0.077 6,R2=0.999。
1.7.4.2 发酵液体外胆酸盐结合率的测定
参考于美汇等的方法[20-21],用磷酸缓冲溶液配制10 mg/mL胃蛋白酶、胰蛋白酶。取2 mL发酵液,再向其中加入1 mL 0.01 mol/L的盐酸溶液和3 mL 10 mg/mL的胃蛋白酶,模拟胃环境,在37 ℃下恒温振荡1 h;取出后加入4 mL胰蛋白酶,并用0.1 mol/L的NaOH溶液调节pH至6.8~7.0,模拟肠道环境,在37 ℃下恒温振荡1 h;处理后的溶液分别加入4 mL 0.3 mmol/L牛磺胆酸钠、甘氨胆酸钠、胆酸钠溶液中,在37 ℃下恒温振荡1 h后转移至离心管,在4 000 r/min下离心15 min,收集上清液进行下一步比色实验,阳性对照为10 mg/mL考来烯胺。
向2.5 mL上清液中加入7.5 mL质量分数60%H2SO4溶液,将具塞试管置于70 ℃条件下水浴20 min,然后取出冰浴至冷却,在374 nm测吸光度OD值并通过标准曲线计算出样品溶液中各胆酸盐的浓度,从而计算出发酵液对3种胆酸盐的结合率。胆酸盐结合率的计算如公式(2)所示:
(2)
式中:b为3种胆酸盐标准曲线的截距;k为3种胆酸盐标准曲线的斜率;OD374为样品在374 nm处的吸光度。
1.7.5 抗凝血活性的测定
参考李岩等[22]、王城的方法[23],取健康牛新鲜血液与100 mmol/L枸橼酸钠按体积比9∶1混匀,3 000 r/min离心10 min,收集离心上层液体。将其分装于1 mL离心管中,冷冻保藏。实验时37 ℃预热,取发酵液分别与待测血浆按体积比1∶4混合,用全自动血凝仪进行抗凝血4项指标的检测,以肝素钠作为阳性对照。
1.8 数据统计与分析
所有实验均重复3次,实验所得数据运用SPSS进行差异显著性分析。
2 结果与分析
2.1 蚕蛹粉基础成分含量
蚕蛹冻干粉的基础成分如表1所示。蚕蛹主要成分为蛋白质和脂肪,质量分数分别为46.68%、35.74%。其蛋白质含量与黄豆中的蛋白质含量较为接近,脂肪含量明显高于黄豆[24]。这表明,蚕蛹作为一种蛋白和脂肪含量较高的低值副产物,具有潜在的替代纳豆加工制品原料的利用价值。

表1 蚕蛹冻干粉的主要成分Table 1 Basic ingredients of silkworm powder
注:*其他可能包含糖类和色素类等杂物质,其质量分数通过减量法计算
2.2 蚕蛹氨基酸组成与总氨基酸含量
蚕蛹冻干粉氨基酸组成如表2所示。由表2可知,其主要含有17种游离氨基酸,其中谷氨酸的质量分数最高4.98%、其次是天冬氨酸4.03%,质量分数最少的半胱氨酸,仅占0.28%。总氨基酸质量分数为36.23%,与含有43%蛋白的豆粕中的氨基酸分布几乎一致[25]。
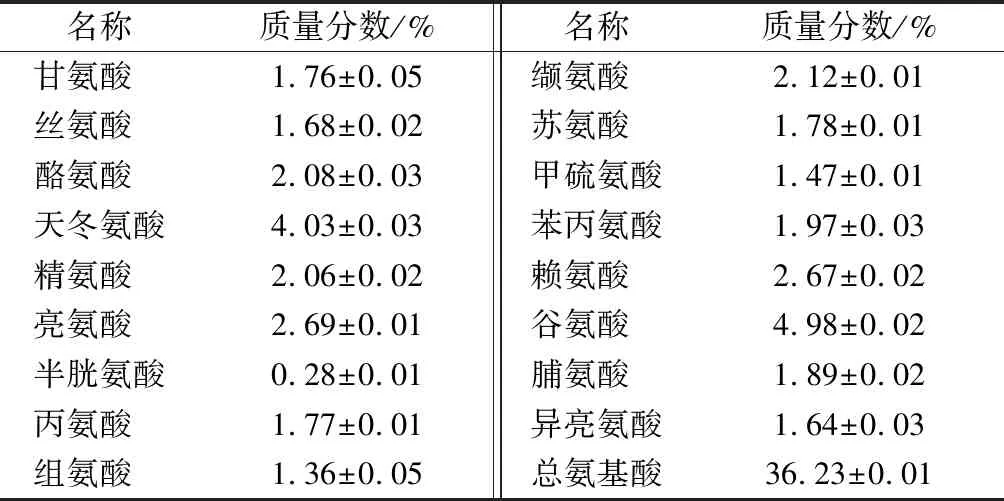
表2 蚕蛹冻干粉的氨基酸组成Table 2 Amino acid composition of silkworm powder
2.3 蚕蛹蛋白组分分子质量
蚕蛹冻干粉脱脂后,采用碱溶酸沉法进行蛋白质的提取。提取的蛋白质的聚丙烯酰胺凝胶电泳图如图1所示。根据Marker分子量Mr的lg值与迁移距离d可以得到线性回归方程为lgMr=-0.124 9d+2.071,根据此方程对分子质量进行计算。电泳显示,蚕蛹蛋白中,分子质量30~34 kDa的蛋白组分相对占比最多,此外,还含有74、66、52 kDa的组分,以及极少量14 kDa的蛋白组分。整体与黄豆的蛋白组分分子质量相比较小[26],更易被分解成小肽,在发酵过程中更容易产生具有功能活性的多肽。
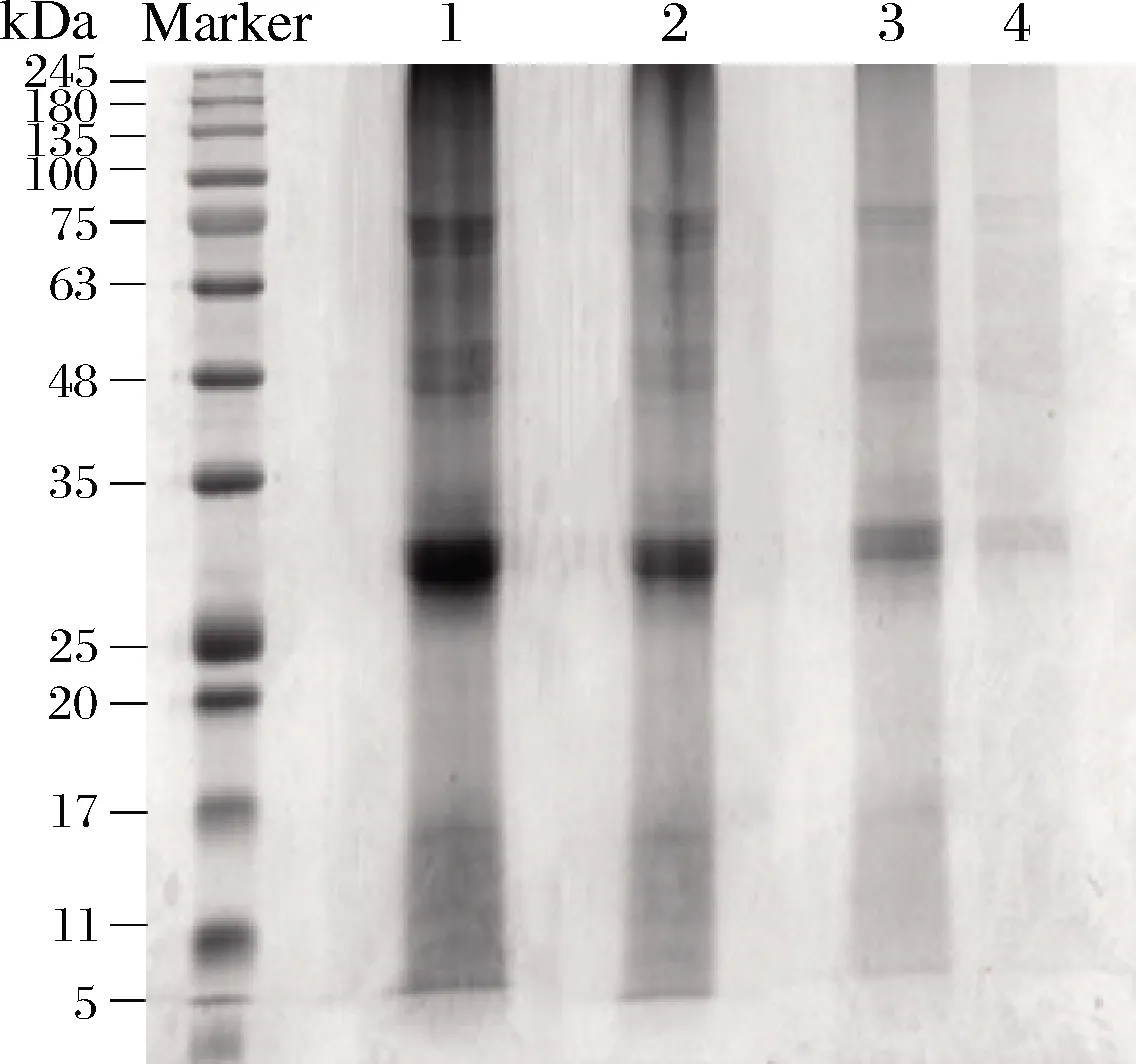
1~4分别表示蚕蛹总蛋白的上样质量浓度为10、5、2.5和1.25 mg/mL
图1 蚕蛹蛋白相对分子质量分布
Fig.1 Molecular weight of silkworm pupa protein
2.4 纳豆菌的发酵生长曲线
纳豆菌在种子培养基中生长曲线如图2所示,在黄豆和蚕蛹培养基中生长曲线如图3所示。由图2可知,纳豆菌在种子培养基中0~8 h为快速生长期,8~20 h趋于平稳即菌体活力稳定,24 h后开始下降,所以取20 h的菌液作为发酵用菌液。由图3可知,在2种发酵培养基中,0~8 h为纳豆菌生长旺盛期,8~32 h活菌数继续缓慢递增,趋于平稳。根据图3结果,后续实验将采用蚕蛹及大豆32 h的发酵液进一步比较他们的功能活性差异。

图2 纳豆菌在种子培养基中的生长曲线
Fig.2 Growth curve of natto bacteria in basic culture medium
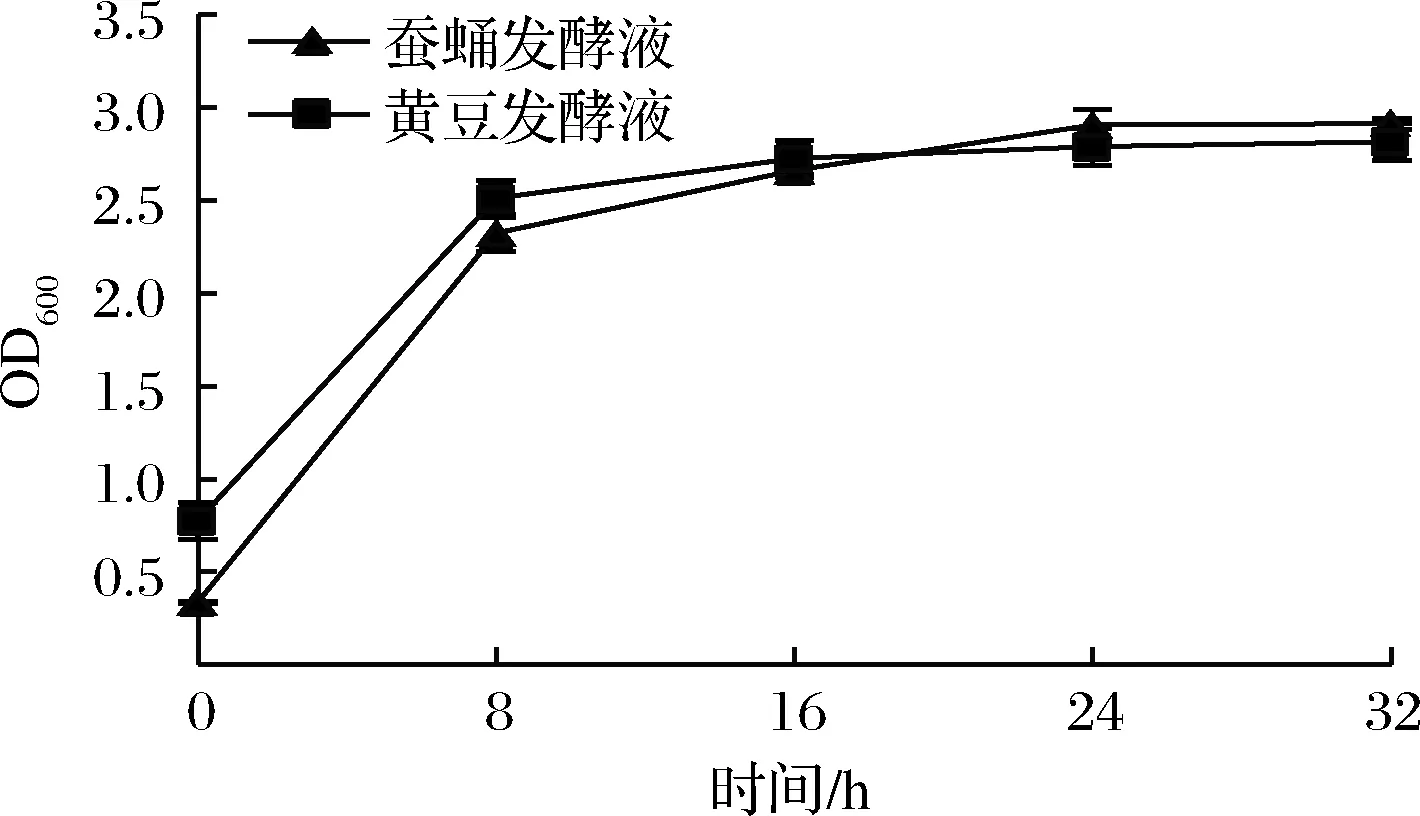
图3 纳豆菌在2种不同发酵培养基中的生长曲线
Fig.3 Growth curve of natto bacteria in two different fermentation mediums
2.5 不同发酵液纳豆激酶酶活的比较
不同发酵液的纳豆激酶酶活如图4所示。由图4可知,随发酵时间延长,3种发酵液的纳豆激酶活力均呈现提升,其中8~16 h时,纳豆激酶酶活变化不显著,处于平台期。发酵16 h后,发酵液纳豆激酶酶活进一步提高。3种发酵液中,FSC的纳豆激酶酶活始终最大,CSB纳豆激酶在发酵过程中呈现线性递增,而CSC增长缓慢。32 h时,3种发酵液中的纳豆激酶酶活均达到最大,FSC为4 140 FU/mL、CSB为3 720 FU/mL、CSC~3 060 FU/mL。

图4 不同发酵时间下3种发酵液的纳豆激酶酶活
Fig.4 Nattokinase enzyme activity of three kinds of fermentation broth at different fermentation time
2.6 不同发酵液ABTS自由基清除活性的比较
3种发酵液的ABTS自由基清除活性如图5所示。随发酵时间延长,不同发酵液的ABTS自由基清除能力均不断提高。其中,CSC始终高于其他2种,并在发酵32 h时清除率达到96.8%。8 h时,FSC与CSC基本一致,但16 h后则低于CSC。相比而言,CSB的ABTS自由基清除率最低。和阳性对照Trolox相比,2种蚕蛹发酵液始终显著高于阳性对照,而黄豆发酵液则在16 h后才超过阳性对照。由此可见,蚕蛹的纳豆菌发酵液的抗氧化活性显著高于黄豆,且蚕蛹发酵液抗氧化活性很大程度来自于纳豆菌对其的利用。

图5 不同发酵时间下3种发酵液的ABTS自由基清除率
Fig.5 ABTS free radical scavenging rate of three kinds of fermentation broth at different fermentation time
2.7 不同发酵液降血脂活性的比较
以3种不同胆酸盐的结合率为指标考察发酵液的降血脂活性,如图6所示。由图6可知,随着发酵时间的延长,3种发酵液对3种胆酸盐的结合率均有提高。与阳性对照(10 mg/mL考来烯胺)相比,3种发酵液的牛胆酸钠结合率低于阳性对照,而甘氨胆酸钠、胆酸钠3种胆酸盐结合率高于阳性对照。3种发酵液中,2种蚕蛹发酵液的3种胆酸盐结合率始终高于黄豆发酵液,且发酵32 h时,3种胆酸盐结合率都在75%以上,其中FSC的牛胆酸钠结合率和甘胆酸钠结合率略高于CSC,而胆酸钠结合率略低于CSC。由此可见,蚕蛹发酵液的降血脂活性优于黄豆发酵液,且其活性强度受发酵时间影响。当活性达到最大时蚕蛹熟化变性对其降血脂活性无显著影响。
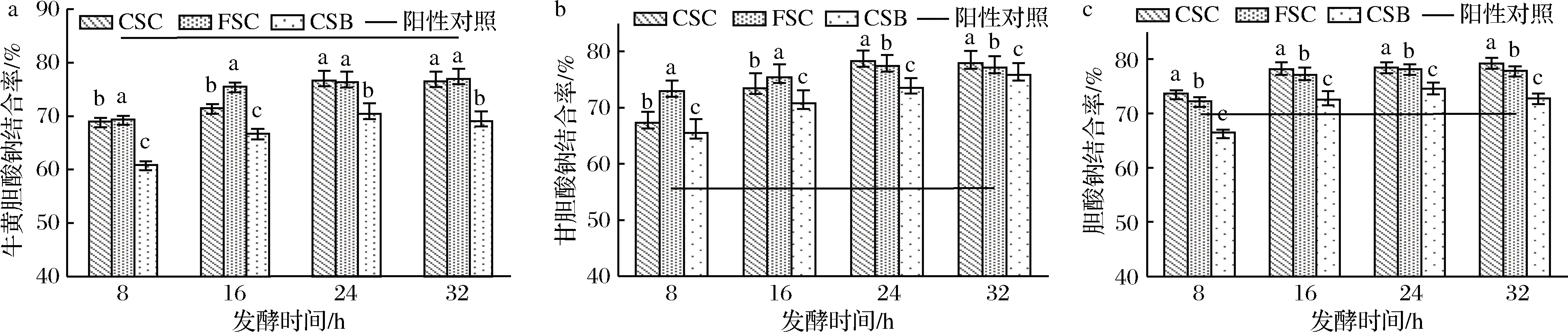
a-牛黄胆酸钠结合率;b-甘胆酸钠结合率;c-胆酸钠结合率
图6 三种发酵液对3种不同胆酸盐的结合率
Fig.6 The binding rate of three kinds of fermentation broth to three different cholate salts
2.8 不同发酵液抗凝血活性的比较
以80 mg/mL肝素钠作为阳性对照,使用全自动血凝仪对不同发酵液的抗凝血指标[活化部分凝血酶时间(active part thrombin time,APTT)、凝血酶原时间(protothrombin time,PT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinogen,FIB)]进行检测。随着发酵时间的增长FSC的APTT值呈上升趋势,在32 h时达到最大,且在8 h以后APTT值一直高于CSC、CSB(图7-a)。随着发酵时间的增长FSC的PT值呈上升趋势,CSC、CSB的PT值呈下降趋势,在发酵时间为32 h时,FSC的PT值达到最大为38.3(图7-b)。随着发酵时间的增长,FSC与CSC的TT值略有波动,都在32 h时达到最大17.2 s,CSB的TT值呈下降趋势,在发酵时间为32 h时,CSC、FSC、CSB的TT值分别为17.2、17.2、22.4 s(图7-c)。随着发酵时间的增长FSC、CSC、CSB的FIB值整体均呈下降趋势,在发酵时间为32 h时3种发酵液的FIB值均达到最小,CSC、FSC、CSB分别为1.17、1.22、1.26 g/L(图7-d)。APTT、PT、TT 3个指标值越大说明该机理下的抗凝血活性越高,FIB则相反[27]。由数据分析可知,APTT、PT指标下的抗凝血活性新鲜蚕蛹发酵液远高于其他2种发酵液,TT指标下的抗凝血活性黄豆发酵液略高于2种蚕蛹发酵液,FIB指标下的抗凝血活性为煮熟蚕蛹发酵液高于新鲜蚕蛹发酵液高于黄豆发酵液。综合4项指标在抗凝血方面的作用程度重要性,得出结论新鲜蚕蛹发酵液的抗凝血活性大于煮熟蚕蛹发酵液大于黄豆发酵液。
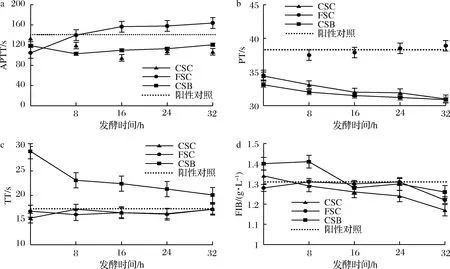
a-APTT值;b-PT值;c-TT值;d-FIB值
图7 三种发酵液在不同发酵时间的4项抗凝血指标
Fig.7 Four anticoagulation indicators of three fermentation broth at different fermentation time
3 结论
本文以煮熟蚕蛹粉、新鲜蚕蛹粉和黄豆粉3种不同的氮源进行纳豆菌的发酵,并对发酵液的纳豆激酶酶活、抗氧化活性、降血脂和抗凝血活性进行比较。研究表明,与常规以黄豆为基础的纳豆发酵制品相比,蚕蛹具有与黄豆相似的蛋白含量,但在相同发酵条件下,蚕蛹的纳豆激酶酶活、抗氧化活性、降血脂及抗凝血活性优于黄豆的纳豆菌发酵产物。而蚕蛹以鲜蛹状态发酵得到的活性略优于熟蛹状态发酵,可见蚕蛹发酵液的活性更大来源于发酵过程纳豆菌对蚕蛹的利用。综上,利用纳豆菌发酵缫丝蚕蛹是缫丝蚕蛹高值化利用的有效途径。
