微RNA⁃21调控的蛋白酪氨酸磷酸酶MEG2蛋白低表达促进肺癌发生发展的分子机制
2020-07-06饶钟鸣马慧关耀武
饶钟鸣,马慧,关耀武
作者单位:驻马店市中心医院胸外科,河南 驻马店463000
肺癌是全球发病率和死亡率最高的肿瘤,而非小细胞肺癌(NSCLC)占其75%~80%[1-2],因此,阐明肺癌发病的分子机制对于肺癌的治疗具有重要意义。
据报道,多种基因改变与肺癌发生和肿瘤进展有关,一些致癌基因如HER2、EGFR等被过表达[3-6]。相反,许多肿瘤抑制基因如P53等被灭活或下调[7-8]。
MEG2是蛋白酪氨酸磷酸酶(PTP)家族的成员[9]。PTPs在细胞酪氨酸磷酸化水平调节和多种生理过程的调控中发挥重要作用。最近的研究报道,MEG2能够通过促进EGFR和ErbB2的去磷酸化,从而抑制STAT3的激活,是乳腺癌的负调控因子。另外,MEG2在胃癌中也作为抑癌基因发挥功能,提示在恶性肿瘤中,MEG2可能充当着病理因子的角色[10-12]。虽然部分报道发现MEG2在肺癌中低表达[13],但是对于MEG2在肺癌发生发展过程中异常低表达及作用机制尚不完全清楚。
miRNAs是大小为20~22个核苷酸的非编码小RNA,它通过与靶mRNAs 3′-UTR结合,导致mRNA降解或翻译抑制,从而沉默靶基因的表达[14]。研究表明miRNAs参与各种细胞过程的调控,包括细胞增殖、分化、转移、凋亡、发育以及代谢[14-15]。
本研究于2015年6月至2018年6月间在体内外实验上探究了miR-21作为肿瘤抑制因子是否可通过靶向MEG2从而影响肺癌细胞的增殖、侵袭和凋亡及其中分子机制。
1 材料与方法
1.1 细胞系和人体组织 人肺癌细胞系,A549和H1975,均来自中国科学院上海细胞库,用10%胎牛血清的DMEM(Gibco,Carlsbad,CA,USA)培养基,在含5%二氧化碳的加湿空气中37℃培养。肺癌和癌旁组织从驻马店市中心医院病人的外科手术中获取,并同每个捐赠者都签署了一份签名同意的表格。本研究符合《世界医学协会赫尔辛基宣言》相关要求。7例肺癌病人的临床信息分别如下:①男,64岁,ⅡA型;②女,60岁,ⅠB型;③男,47岁,ⅡA型;④男,49岁,ⅡB型;⑤女,41岁,ⅠB型;⑥男,39岁,ⅢA型;⑦男,54岁,ⅢB型。
1.2 RNA提取和实时荧光定量PCR 总RNA提取、逆转录和TaqMan实时聚合酶链反应(PCR)均按照生产商的说明书进行操作,如前所述。为了定量MEG2的mRNA,1 μL的总RNA用oligo dT和Thermoscript(TaKaRa)进行逆转录,反应条件如下:42℃,60 min,85℃,5 min。SYBER Green染料(Invitrogen)、MEG2和GAPDH的特异引物用于qRTPCR。引物的序列如下:MEG2正向引物为5′-CCTGCCTTAGACTGGGACT-3′,MEG2 反向引物为 5′-TTCGCTTTGTTAGCTTCACT-3′。
GAPDH正向引物为5′-GATATTGTTGCCATCAATGAC-3′,GAPDH反向引物为5′-TTGATTTTGGAGGGATCTCG-3′。MEG2 mRNA的相对定量以GAPDH基因进行归一化处理。
1.3 miRNA的过表达或敲降 合成的RNA分子,包括前体miR-21、反义miR-21和无义对照RNA(miR前体对照和反义对照)购买于GenePharma(上海)。细胞接种在6孔板中,将细胞分为四组,24 h后细胞密度在70%时分别用Lipofectamine 2000(Invitrogen)进行转染。每孔中前体miR-21、反义miR-21和无义对照RNA的用量均为100 pmol。24 h后收集细胞进行qRT-PCR和蛋白质印迹法实验。
1.4 质粒的构建和siRNA干扰分析 MEG2过表达质粒(pReceiver-M02-MEG2)购买于GeneCopoeia(Germantown,MD,USA),空载质粒作为对照。2种靶 向 人 MEG2 基 因 的 siRNAs(siRNA-1:5′-ACAGUUUCAUAGAGCCAUGAAGUAU-3';siRNA-2:5′-ACUUUGCUGUAACCCUGUA-3′)购买于 GenePharma,无义的 siRNA(GenePharma)作为对照。总RNA或蛋白质在转染后24 h或48 h提取。MEG2蛋白表达水平用蛋白质印迹法进行检测。
1.5 荧光素酶报告实验 为了验证miR-21与MEG2的直接结合,我们进行了荧光素酶报告实验。由GenePharma直接合成MEG2的正常和突变的3′-UTR序列,然后插入PGL3质粒(Ambion)。293 T细胞在24孔板中培养,每孔均用Lipofectamine 2 000转染了β-半乳糖苷酶(β-gal)表达质粒(Ambion)和0.2 μg的萤火虫荧光素酶报告质粒,以及等量的前体miR-21和无义对照RNA,其中β-半乳糖苷酶质粒用作对照。24 h后,这些细胞通过荧光素酶分析试剂盒(Promega,Madison,WI,USA)进行分析。
1.6 蛋白质印迹法实验 蛋白质水平通过蛋白质印迹法检测,并且用GAPDH抗体进行归一化处理。所用抗体如下:MEG2抗体(Abcam ab32441,Cambridge,MA,USA)和GAPDH抗体(sc-365062;Santa Cruz Biotechnology,Santa Cruz,CA,USA)。运用Image J软件对蛋白条带进行灰度分析。
1.7 细胞增殖实验 将A549细胞以1×104的密度接种在96孔板中,并在12 h后转染。经转染后,每孔加入10 μLCCK-8试剂盒中的WST-8溶液(Beyotime,China)。孵育2 h,分别在3个时间点(0 h,12 h和60 h)读取在450 nm下的吸光度值。计算出的相对细胞数值即为60 h和12 h的吸光度之比。
1.8 细胞侵袭和凋亡分析实验 A549细胞的侵袭实验和凋亡分析分别用Transwell Boyden Chamber(6.5 mm,Costar,Corning,NY,USA)和 Annexin VFITC/PI staining试剂盒(BD Biosciences,San Diego,CA,USA)进行测试。总凋亡细胞是早期凋亡(PI-AV+)和晚期凋亡(PI+AV+)细胞的总和。
1.9 统计学方法 所有的蛋白质印迹图都代表了三次以上独立实验的结果。qRT-PCR、荧光素酶报告实验、细胞增殖和凋亡分析也均为重复3次的实验结果。所有结果均以表示,两组之间的检验方法为Student's t-test,两组以上的检验方法为one-way ANOVA,以P<0.05为差异有统计学意义。
2 结果
2.1 肺癌组织中蛋白酪氨酸磷酸酶MEG2蛋白和mRNA水平变化不一致 首先,我们检测了7对人肺癌组织的MEG2蛋白水平(图1A)。我们发现,在肺癌组织中MEG2蛋白水平均被下调(变化倍数依次为:0.19,0.83,0.21,0.05,0.42,0.37,0.09),随后,我们用qRT-PCR检测同样的7对癌和癌旁组织的MEG2 mRNA水平。结果显示MEG2 mRNA水平在癌和癌旁组织之间差异无统计学意义(变化倍数依次为:0.95,1.02,0.98,0.96,0.99,0.93,0.98)。在肺癌组织中,MEG2蛋白和mRNA水平之间的这种差异,提示了MEG2的调节机制存在转录后调控。
2.2 蛋白酪氨酸磷酸酶MEG2抑制肺癌细胞增殖,促进肺癌细胞凋亡 MEG2在肺癌组织中的异常表达提示MEG2可能发挥肿瘤抑制因子的作用,可能参与肺癌细胞增殖、凋亡或其他生理过程。因此,我们主要研究了MEG2对肺癌细胞增殖和凋亡的影响。首先,我们分别在A549细胞中改变MEG2的表达水平检测MEG2在肺癌细胞生长中的作用。通过构建过表达质粒和siRNA分别过表达或抑制MEG2,功能实验检测显示过表达MEG2能抑制肺癌细胞的增殖速率(P<0.001),促进肺癌细胞凋亡(细胞凋亡率:对照组5.16,质粒组17.82,P=0.000),而转染了MEG2 siRNA的肺癌细胞增殖速率加快(P=0.000),凋亡减少(细胞凋亡率:对照组5.88,质粒组3.28,P=0.000),见图1B~E。综上结果证明,MEG2能够影响肺癌细胞的增殖和凋亡。
2.3 miR⁃21作为靶向蛋白酪氨酸磷酸酶MEG2的预测microRNA miRNA抑制mRNA的翻译是一种常见的转录后调控方式。为了确定哪些miRNAs可以在肺癌细胞中靶向MEG2,我们运用了三种算法,TargetScan,miRanda和PicTar进行预测分析。在候选的miRNAs中,miR-21是一种在肺癌中普遍被上调的促癌因子[16-17]。
2.4 肺癌组织中miR⁃21和蛋白酪氨酸磷酸酶MEG2水平呈负相关 依据miRNAs与其目标基因的负相关表达模式,我们接着研究了miR-21在临床病人组织中是否与MEG2水平呈负相关。在检测了7对肺癌组织和癌旁组织中的miR-21水平后,发现miR-21在肺癌组织中显著升高(值:LN组为0.96 0.33 0.23 0.18 0.06 0.11 0.08;LC组为2.86 1.32 0.96 0.85 0.94 0.54 0.62;P=0.000)。基于生物信息学预测和人肺癌组织中miR-21和MEG2水平呈负相关的结果,提示了MEG2是miR-21的潜在靶基因。
2.5 验证蛋白酪氨酸磷酸酶MEG2是miR⁃21的直接靶基因 通过对人肺癌细胞系A549和H1975中miR-21的过表达或敲降,进一步证实miR-21和MEG2的直接相关性。如预期一样,A549细胞和H1975细胞中转染miR-21 mimic后,miR-21的水平显著提高,转染反义miR-21后miR-21水平急剧下降。对应的,在两种细胞中,miR-21的过表达显著抑制了MEG2蛋白的表达(变化倍数:A549 0.26;H1975 0.18),促进Vimentin表达(变化倍数:A549 2.04;H1975 3.22);而miR-21的下调显著增加了肺癌细胞中的MEG2蛋白水平(变化倍数:A549 2.48;H1975 2.18)并抑制Vimentin表达(变化倍数:A549 0.16;H1975 0.08),见图2。
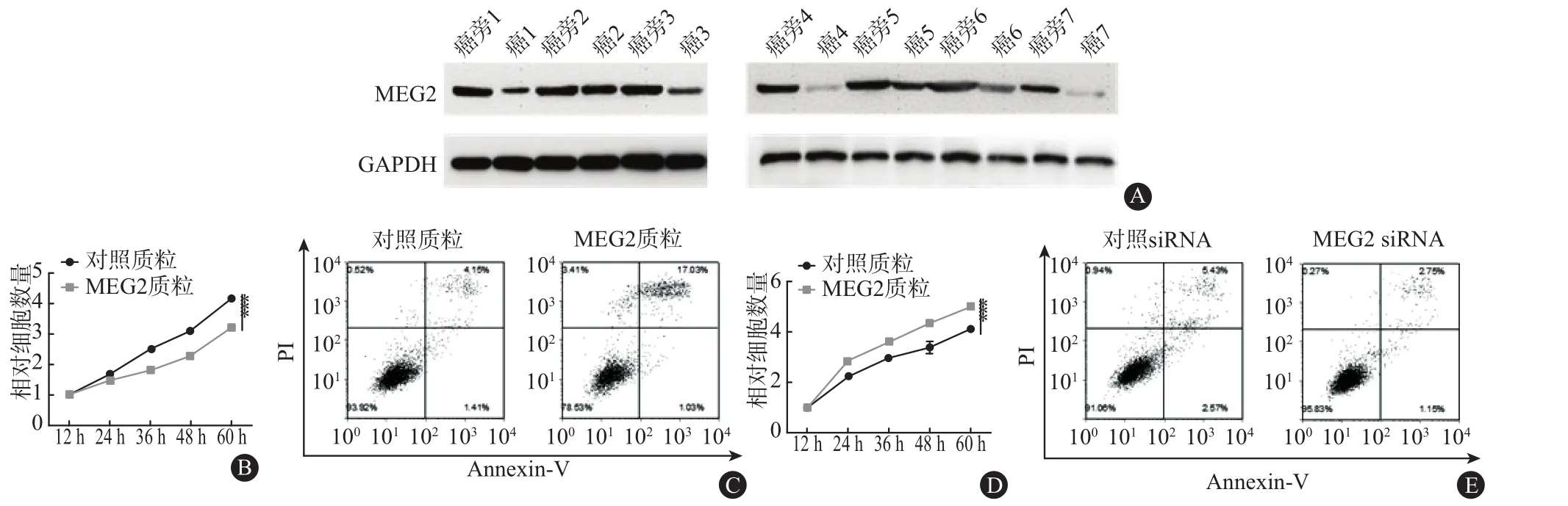
图1 肺癌组织中MEG2蛋白和mRNA表达水平及MEG2对肺癌细胞增殖和凋亡的影响:A为7对肺癌和癌旁组织MEG2的蛋白质印迹法代表图,B为在A549中过表达MEG2抑制细胞增殖(P=0.001),C为在A549中过表达MEG2促进细胞凋亡(P=0.000),D为在A549中敲降MEG2能促进细胞增殖(P=0.001),E为在A549中敲降MEG2能抑制细胞凋亡(P=0.000)

图2 miR-21直接转录后调控MEG2的表达:A为MEG2 3′UTR和miR-21形成双链的结合位点;B为A549细胞和H1975细胞转染了等量miR-21 mimics,反义miR-21(anti-miR-21)或无义对照RNA后蛋白质印迹法分析
为了证明miR-21对MEG2表达的负调控是通过miR-21与MEG2 mRNA 3′UTR预测位点的直接结合,我们进行了荧光素酶报告实验。在报告质粒中,我们把含有miR-21预测结合位点的全长3′UTR序列放置在萤火虫荧光素酶基因的下游。然后将重组质粒和miR-21 mimics共同转染进A549细胞。如预期一样,荧光素酶活性在共转入荧光素酶报告质粒和miR-21 mimics的细胞中显著减少(过表达:0.26,P=0.001;抑制:2.82,P=0.036)。然后我们引入点突变,以消除miR-21与MEG2 3'UTR预测位点的结合。突变后的荧光素酶活性无论是在miR-21过表达还是敲降后均不受其影响。这一结果表明,该结合位点对miR-21和MEG2 mRNA之间的结合有着强烈的影响。综上所述,该结果证实了miR-21直接识别并结合到MEG2转录本的3'UTR区域进而抑制MEG2的翻译。
2.6 肺癌细胞中miR⁃21对蛋白酪氨酸磷酸酶MEG2的调控作用 我们进一步分析了miR-21通过抑制MEG2表达对肺癌细胞功能的影响。鉴于MEG2已报道能抑制细胞增殖,并促进凋亡[18],我们猜测miR-21可能通过抑制MEG2表达,继而影响细胞的增殖和凋亡。如预期,A549细胞中miR-21过表达促进了细胞增殖(P=0.020)并抑制了细胞凋亡(细胞凋亡率:对照5.68,miR-21过表达3.28;P=0.000);而抑制miR-21对肺癌细胞增殖(P=0.004)和凋亡有相反的影响(细胞凋亡率:对照4.36,miR-21抑制13.08;P=0.000)。接着我们在A549细胞中进行了回复实验,蛋白分析结果显示,过表达miR-21能够减弱MEG2过表达质粒对MEG2的上调作用。更为重要的是,增殖和细胞凋亡分析显示,miR-21抵抗的MEG2过表达显著降低了miR-21对细胞增殖的促进(P=0.003)作用和对凋亡的抑制作用(细胞凋亡率:对照5.21,miR-21过表达3.66,MEG2过表达11.88,miR-21+MEG2过表达4.02;P=0.002)。综上所述,MEG2对肺癌细胞的增殖和凋亡至关重要,而miR-21可能通过沉默MEG2进而促进肺癌细胞增殖,并抑制其凋亡。见图3。
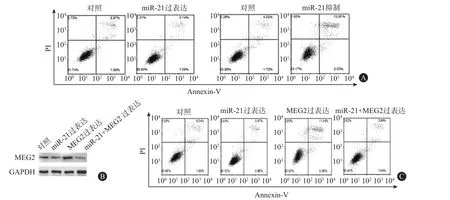
图3 miR-21和MEG2对肺癌细胞增殖和凋亡的影响:A为A549细胞转染了等量的miR-21 mimics或无义对照RNA、等量的反义miR-21或无义对照RNA后的24 h,分别进行了细胞凋亡检测(P=0.000,P=0.000);B为 A549细胞转染了等量的前体对照、miR-21 mimics、MEG2过表达质粒或miR-21 mimics和MEG2过表达质粒48 h,蛋白质印迹法分析MEG2蛋白表达变化;C为A549细胞转染了等量的前体对照、miR-21 mimics、MEG2过表达质粒或miR-21 mimics和MEG2过表达质粒后检测细胞的凋亡水平变化(P=0.002)
2.7 信号转换器和转录激活因子3在转录水平促进miR⁃21的表达 我们进一步探究了miR-21在肺癌细胞中异常上调的分子机制,通过检索文献发现,转录因子STAT3可直接与miR-21启动子区结合进而促进miR-21的表达,为了在肺癌中验证这一现象,我们在A549细胞中分别用过表达质粒和siRNA上调和下调STAT3蛋白,然后检测miR-21的表达水平,结果发现上调STAT3可显著促进miR-21表达(变化倍数:3.79;P=0.000),而下调STAT3则显著抑制miR-21表达(变化倍数:0.42;P=0.000),说明在肺癌细胞中STAT3同样可直接促进miR-21的表达。
3 讨论
肺癌是全球发病率和死亡率最高的肿瘤,NSCLC约占所有原发性肺癌的75%~80%[1-2]。新疗法的疗效目前仍然受到药物耐药性以及对肿瘤细胞信号通路缺乏了解的限制。许多基因,如癌症抑制因子(抑癌基因)和癌症诱导因子(致癌基因)影响着肺癌的发生。蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphatases,PTPs)是细胞功能的重要调控因子,PTPs失调是人类癌症的主要原因之一[19-20]。蛋白酪氨酸磷酸酶MEG2(MEG2)是属于PTP组的细胞质磷酸酶[21-22]。MEG2可以抑制STAT3(信号转换器和转录激活因子3)和ErbB家族[包括EGFR(表皮生长因子受体)和ErbB2]的去磷酸化,从而抑制受体酪氨酸激酶(RTK)的激活[10-11]。MEG2蛋白在乳腺癌、前列腺癌、胃癌和肝癌中表达减少[10,23-24]。然而,在肺癌的发展过程中,MEG2的作用和调节机制尚未见报道。
本研究中我们观察到过表达MEG2能抑制肺癌细胞的增殖以及促进凋亡,而siRNA去沉默MEG2的表达则导致相反的效果,这提示MEG2蛋白在肺癌的发展过程中扮演着重要的抑癌基因的角色。有趣的是,我们发现了人肺癌组织中MEG2蛋白和mRNA水平之间的不一致趋势。这表明了调节MEG2表达的机制中存在转录后调控。这种调控方式的一个重要模式是通过miRNAs抑制mRNA的转录。因此,我们预测了靶向MEG2的miRNAs,并将miR-21作为候选对象。机制研究表明,miR-21可以直接结合MEG2的3'UTR,并抑制其在肺癌细胞中的表达。此外,我们还发现miR-21抑制MEG2表达,促进肺癌细胞增殖并抑制其凋亡,且转录因子STAT3可在肺癌中上调miR-21的表达。上述结果阐明了一条新的调控轴,即STAT3-miR-21通过靶向MEG2调节肺癌细胞的增殖和凋亡。
在过去数十年中,miRNAs在肺癌的发生发展过程中扮演着一个重要的角色[15]。在目前的研究中,我们观察到,与邻近的癌旁组织相比,肺癌组织的miR-21水平更高。这表明,miR-21可能会作为肿瘤促进因子影响肿瘤发生。事实上,miR-21在多种癌症中都被上调,包括胃癌、乳腺癌和前列腺癌[25-27]。此外,miR-21通过对增殖、转移、上皮-间质的转换以及细胞黏附的调节,在癌症中发挥促肿瘤的作用[28-30]。图7中,我们发现过表达miR-21促进肺癌细胞增殖并抑制其凋亡,体内外的miR-21功能与沉默MEG2表达的效果类似。同时我们发现,恢复MEG2的表达减弱了miR-21对肺癌细胞的促增殖和抗凋亡的作用。尽管miR-21靶向多个目标,但上述结果表明其对MEG2的靶向调节是一种在肺癌中促进肿瘤的主要机制。
综上,本研究描述了一种新的调控轴,即miR-21作为促癌因子,在肺癌发生时抑制MEG2的表达。此研究可能为肺癌治疗开辟新的视野。
