铁酸铜尖晶石催化甲醛氧化的性能研究*
2020-07-06丁俊彦杨应举
丁俊彦,刘 晶,杨应举,王 震
(华中科技大学 能源与动力工程学院,煤燃烧国家重点实验室,武汉 430074)
0 引 言
甲醛作为室内主要污染物之一,主要从地板、木材、粘胶等建筑与装饰材料中持续释放[1]。此外,甲醛作为典型的挥发性有机污染物(volatile organic compounds,VOCs),室外主要来源于光化学反应过程、工业生产过程以及生物质燃烧过程[2],对人类健康和生态环境危害巨大[3]。催化氧化技术借助催化剂使甲醛在较低起燃温度下无焰燃烧并放出大量热量实现反应的自供热,具有净化效率高、无二次污染、能耗低、热力可回收、所需设备体积小等优点,在甲醛脱除技术中有广泛的应用前景。
尖晶石型混合过渡金属氧化物(AxB3−xO4)是一种良好的催化剂[4]。其中铁酸铜尖晶石具有特定反尖晶石结构[5],体系中多价态阳离子的存在为反应物的吸附和氧化提供了更多的表面活性位点。目前已有学者对铁酸铜尖晶石降解部分环境污染物进行了相关研究,如NOx脱除[6]、苯酚降解[7]、丙烷催化燃烧[8]和甲苯催化氧化[9]等。然而,关于铁酸铜尖晶石催化甲醛氧化的研究鲜有报道。
本文采用溶胶−凝胶燃烧合成法制备系列CuxFe3−xO4尖晶石催化剂。研究不同Cu/Fe 摩尔比例对甲醛脱除性能的影响。采用X 射线光电子能谱(X-ray photoelectron spectroscopy,XPS)、X 射线衍射(X ray diffraction,XRD)对CuxFe3−xO4的物理化学特性进行表征。采用密度泛函理论计算方法确定CuFe2O4表面吸附甲醛的最稳定构型,进一步探究甲醛与CuFe2O4表面的相互作用。
1 实验部分
1.1 催化剂制备与表征
采用溶胶−凝胶−自蔓延燃烧法,以柠檬酸做络合剂制备不同Cu/Fe摩尔比的铁酸铜尖晶石催化剂。具体制备步骤为:将一定量的Fe(NO3)3∙9H2O、Cu(NO3)2∙3H2O、柠檬酸溶解于去离子水中,使混合溶液中Cu2+/Fe3+的摩尔比为x∶3−x(x=0.2,0.5,0.8,1),(Cu2++Fe3+)/柠檬酸的摩尔比维持为1。在60℃下反应1 h 后置于90℃水浴中搅拌蒸发至凝胶状,将干凝胶置于100℃的干燥箱干燥12 h,再将样品置于马弗炉中以400℃焙烧4 h 得到尖晶石粉体,最后将粉体研磨筛分。得到的样品命名为CuxFe3−xO4(x=0.2,0.5,0.8,1)。
采用XRD 表征分析样品的晶相组成,激光光源为Cu Kα,扫描范围2θ=10º~80º,步长0.03º。采用XPS 检测样品材料的表面元素组成,通过分析结合能峰的位置判断特定元素的价态,激发源为Al Kα(hv=1 486.6 eV),工作电压为15 kV,电子结合能通过污染碳的 C ls 峰(284.6 eV)校正,采用XPSpeak41 软件分析得到催化剂表面的元素价态。
1.2 催化剂结构模拟计算
计算基于密度泛函理论(density functional theory,DFT)平面波赝势方法,在CASTEP 软件包中完成[10]。电子间的交换−关联作用采用PBE(Perdew,Burke,and Ernzerhof)泛函广义梯度近似(generalized gradient approximation)方法[11]。采用超软赝势描述周期性势场作用下的电子−离子之间的相互作用。电子波函数用平面基波组表示,截止能为340 eV。对于单点能及电子结构计算考虑自旋极化加U[12]。布里渊K 点取样采用Monkhorst-Pack 方法[13],原胞模型和平板模型K值分别设定为4×4×4和1×2×1。模型优化采用BFGS(Broyden Fletcher Goldfarb Shanno)几何优化算法,BFGS 收敛标准为:单原子自洽场迭代误差1.0×10−6eV/atom,能量误差1.0×10−5eV/atom,原子间相互作用力收敛标准0.03 eV/Å,应力收敛标准0.1 GPa,原子最大位移收敛标准0.001 Å。平板模型构建5 层原子的2×1 超晶胞,真空层设置为16 Å,固定底部3 层原子,保持表面2 层原子弛豫进行优化。吸附能由式(1)进行计算:
式中:Eads为吸附能;EHCHO-surface为甲醛吸附后分子与吸附表面的总能量;EHCHO为气相HCHO 的能量;Esurface为未吸附表面的总能量。通常,如果吸附能大小在0~30 kJ/mol 之间,说明吸附作用弱,属于物理吸附;如果吸附能大小超过50 kJ/mol,说明吸附作用强,属于化学吸附[14]。
1.3 实验台架
铁酸铜尖晶石催化甲醛氧化反应实验设备如图1 所示。反应在连续流固定床石英管反应器中进行。O2和N2通过质量流量计精确控制流量后通入混合瓶中进行预混合(O2和N2的体积分数分别为20%和80%),随后混合气体以100 mL/min 流量通入装有甲醛溶液的鼓泡瓶中。反应器进口气体中甲醛浓度为1.25×103mg/m3。反应的空塔气速为5×103h−1。石英管反应器内催化剂与石英砂的装填量分别为0.2 g和1.8 g。反应产生的CO2浓度由气相色谱仪(安捷伦GC-3000)检测。反应温度范围控制在100℃~350℃,以50℃为升温间隔进行反应。

图1 催化甲醛氧化实验台架Fig.1 Schematic diagram of HCHO catalytic oxidation experimental system
由于生成的含碳物种仅有CO2,因此甲醛转化率可由式(2)计算:

式中:ηHCHO为催化甲醛氧化效率;为出口二氧化碳浓度;CHCHO为进口甲醛浓度。
2 结果与讨论
2.1 表征结果分析
铁酸铜尖晶石的XRD 衍射图谱如图2 所示。从图中可知,CuxFe3−xO4尖晶石催化剂主要由Cu-Fe尖晶石相组成,同时存在部分CuO 和Fe2O3晶相。随着Cu 摩尔比例的增加,位于2θ=35º的尖晶石晶相峰呈先增强后减弱的趋势,且在Cu/Fe 摩尔比为0.5∶2.5 时峰强度最强。四种催化剂的CuO 和Fe2O3晶相峰强度变化不大。在相同制备条件下,CuxFe3−xO4催化剂的尖晶石晶相峰强度有差异,说明在催化剂制备过程中,Cu/Fe 摩尔比对催化剂的结晶度有影响,适量Cu 的加入可以促进尖晶石相的形成。
对Cu0.5Fe2.5O4尖晶石进行XPS 表征分析,XPS光谱用XPSPEAK41 软件处理,并采用非线性最小二乘曲线拟合方法对数据进行分析,结果如图3 所示。Fe 2p 光谱在710 eV 和724 eV 附近存在两个不对称峰,分别对应Fe 2p1/2和2p3/2。其中,710.35 eV、711.43 eV 和713.12 eV 特征峰对应尖晶石结构中的Fe3+;709.45 eV 特征峰对应于尖晶石结构中的Fe2+[15];724.06 eV 特征峰对应与羟基成键的Fe3+[16]。因此,催化剂表面的Fe 主要以Fe2+、Fe3+形式存在。Cu 2p 光谱在932.14 eV 和932.71 eV 出现两个特征峰,分别对应尖晶石中Cu+和Cu2+,位于952.43 eV的特征峰对应CuO 中的Cu2+[15]。催化剂表面的Cu主要以Cu+和Cu2+形式存在。O 1s光谱在529.71 eV和530.86 eV 处出现两个特征峰,分别表示与金属成键的表面氧原子和化学吸附氧[17]。

图2 CuxFe3−xO4 催化剂的XRD 图谱Fig.2 XRD spectra of CuxFe3−xO4 catalysts

图3 Cu0.5Fe2.5O4 的XPS 谱图:(a)Cu 2p;(b)Fe 2p;(c)O 1sFig.3 XPS spectra of Cu0.5Fe2.5O4:(a) Cu 2p;(b) Fe 2p;(c) O 1s
基于XPS 数据进一步分析了CuxFe3−xO4催化剂表面与金属成键的氧原子(Oα)和化学吸附氧(Oβ)浓度占比,结果如表1 所示。

表1 CuxFe3−xO4 催化剂表面氧原子浓度比Table 1 Surface oxygen atomic proportion of CuxFe3−xO4
随着Cu 掺杂量的增加,与金属成键的氧原子占比(Oα/Oα+β)逐渐减少,说明Cu 的掺杂利于催化剂表面氧缺陷的形成。
2.2 实验结果
图4 显示了反应温度和Cu/Fe 摩尔比例对CuxFe3−xO4尖晶石催化甲醛氧化效率的影响。反应温度从100℃上升至 150℃时,Cu0.2Fe2.8O4、Cu0.8Fe2.2O4、CuFe2O4催化剂的催化效率无明显变化。当温度从150℃上升至250℃时,四种催化剂的催化效率均呈上升趋势。当温度高于250℃时,CuFe2O4的催化效率趋于稳定,其他三种催化剂的催化效率有轻微下降。在四种不同Cu 摩尔比例的催化剂中,Cu0.5Fe2.5O4催化甲醛氧化效率最高,并在反应温度高于250℃时,效率达到90%以上。

图4 尖晶石催化甲醛氧化效率Fig.4 Oxidation efficiency of HCHO catalyzed by CuxFe3−xO4
由XRD 表征结果分析可知,催化剂主要由尖晶石相组成,CuO 和Fe2O3晶相对应的衍射峰非常弱,说明催化剂表面CuO 和Fe2O3的含量极少。同时CuO 和Fe2O3在四种CuxFe3−xO4催化剂中对应的峰强度近乎相同,说明四种催化剂中CuO 和Fe2O3的含量相近,可见导致CuxFe3−xO4催化剂活性差异的物质为Cu-Fe 尖晶石。当Cu/Fe 摩尔比为0.5∶2.5时,催化剂的尖晶石含量最高,催化甲醛氧化效率最高,说明Cu-Fe 尖晶石的存在有利于甲醛催化氧化。此外,CHENG 等[18]研究发现,表面分散的CuO 对催化剂的催化活性有一定提高作用,且Fe2O3和CuO 的协同作用可以使CuO 进一步处于分散状态,进而提高催化活性。由XPS 表征结果分析可知,Cu0.5Fe2.5O4中Fe 的存在形式为Fe2+和Fe3+;Cu 的存在形式为 Cu+和 Cu2+。由于晶体的Jahn-Teller 效应,Fe2+-Fe3+和Cu+-Cu2+之间发生的电子转移使催化剂处于亚稳定状态,易产生晶格缺陷,从而产生低配位数的氧原子,有利于反应物的吸附和反应。因此,Cu0.5Fe2.5O4催化剂中尖晶石相、Fe2O3和 CuO 的协同作用,以及晶体的Jahn-Teller 效应使催化剂具备良好的催化活性。
2.3 甲醛与CuFe2O4 表面的相互作用
由上述分析可知,CuFe2O4尖晶石是催化剂的主要成分,且该组分的存在是催化剂表现优异催化活性的原因,因此选择CuFe2O4表面研究甲醛吸附机理。基于密度泛函理论分析了甲醛在CuFe2O4表面最稳定的吸附构型,从而进一步研究甲醛与CuFe2O4表面的相互作用。首先建立了CuFe2O4(100)模型,如图5 所示。Cu 位于CuFe2O4晶胞的八面体空隙位,Fe 位于晶体的八面体和四面体空隙位,晶胞为典型反向尖晶石结构。在计算甲醛吸附构型时考虑了所有可能的吸附位点:配位数为5 的Fe 和Cu 位点(分别表示为Fe5c和Cu5c),以及配位数为3 的O 位点(表示为O3c)。
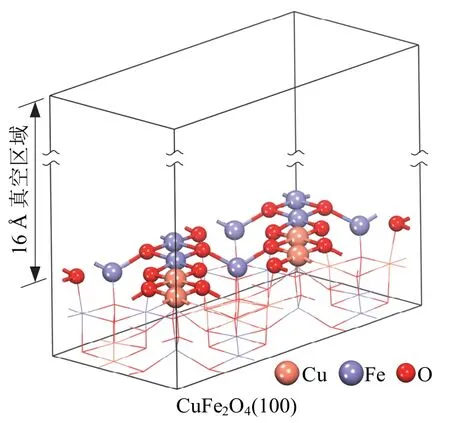
图5 优化后的CuFe2O4(100)表面模型Fig.5 The optimized structure of CuFe2O4(100)
通过比较甲醛在不同吸附位点的吸附能,获得吸附能最低的稳定结构,如图6 所示。甲醛在CuFe2O4(100)表面的吸附位点为Fe5c和O3c。其中C与催化剂表面的O3c相连,C—O3c键长为1.425 Å;O 与催化剂表面的Fe5c相连,O—Fe5c键长1.945 Å。吸附能为 −107.15 kJ/mol,表明甲醛在CuFe2O4(100)表面主要是化学吸附。

图6 甲醛在CuFe2O4(100)表面最稳定的吸附构型Fig.6 The optimized structure of HCHO adsorption on CuFe2O4(100) surface
为进一步了解甲醛与CuFe2O4(100)表面的相互作用,图7 给出了最稳定吸附构型中成键原子Fe5c—O 和O3c—C 的分态密度。Fe 的d 轨道与O的p 轨道电子存在相互作用,并且在 −20.34 eV、−7.01 eV、−1.70 eV 处观察到Fe d 轨道与O p 轨道重叠,发生杂化,说明形成了Fe—O 键。O(2s,2p)轨道与甲醛分子的C(2s,2p)轨道存在强烈的相互作用,在 −20.26 eV、−18.21 eV、−10.10 eV、−6.74 eV观察到O 2s、O 2p、C 2s、C 2p 轨道重叠,并且在费米能级右侧的9.2 eV 和11.93 eV 出现强峰,说明C 和O 之间形成了共价键,即C—O 键。

图7 甲醛吸附在CuFe2O4(100) 表面后成键原子的分态密度Fig.7 PDOS of Fe5c,O3c,C and O atoms after HCHO adsorption on CuFe2O4(100) surface
3 结 论
对铁酸铜尖晶石催化甲醛氧化进行了实验与密度泛函理论研究,得到以下结论:
(1)采用溶胶−凝胶−自蔓延燃烧法制备系列CuxFe3−xO4尖晶石催化剂,催化剂主要由Cu-Fe 尖晶石相和少量Fe2O3、CuO 相组成。
(2)催化剂表面Fe、Cu 元素以多价态形式存在。
(3)x=0.5 时,CuxFe3−xO4尖晶石催化剂催化甲醛氧化效率最佳。
(4)采用密度泛函理论研究了甲醛在催化剂CuFe2O4表面的吸附机理。甲醛在CuFe2O4(100)表面的吸附属于化学吸附,吸附能为 −107.15 kJ/mol,吸附位点为Fe5c和O3c。
