苏云金芽孢杆菌Cry2Aa型杀虫晶体蛋白的分类与构效
2020-07-04施茹玲郭幼红
施茹玲 郭幼红


摘 要:通过同源建模法构建Cry2Aa型杀虫晶体蛋白16种成员的活性区空间结构,基于空間结构将其分为4类,并比较分析。结果表明,Cry2Aa的DomainⅠ非常保守,几乎完全重叠;Cry2AaⅡ、Cry2AaⅣ与其他成员的DomainⅡ存在差异;Cry2AaⅡ、Cry2AaⅢ与其他成员的DomainⅢ存在较大差异。研究确定了影响Cry2Aa型杀虫晶体蛋白结构差异的关键氨基酸及其关键结构片段。
关键词:苏云金芽孢菌;Cry2Aa型杀虫晶体蛋白;空间构象;构效
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种革兰氏阳性孢子细菌,在孢子形成过程中会产生杀虫晶体(Crystal,Cry)蛋白[1]。Cry2Aa是Cry蛋白中罕见的一种,具有广泛的特异性,不仅对鳞翅目害虫产生高毒性,还对双翅目害虫具有显著的杀灭作用,如黑翅伊蚊、尖音库蚊、稻纵卷叶螟和水稻二化螟[2]。在实验室条件下,陆续有Bt产生抗药性的报道[3]。在许多Cry基因中,Cry2Aa基因具有杀虫谱广、杀虫效率高的特点。经Cry2Aa蛋白与BBMV的结合试验发现,昆虫对Cry2Aa蛋白不容易产生抗性,因此,Cry2Aa应用于缓减昆虫出现抗性是很有价值的[4]。
Cry2Aa类蛋白原毒素被水解后,形成3个有活性的结构域。结构域Ⅰ由1~272个残基组成,螺旋束包含7个螺旋,参与昆虫中肠细胞膜表面孔洞的形成;结构域Ⅱ由273~473个残基组成,由3个反向平行的β-折叠组成的β-棱柱结构,参与了昆虫中肠受体的结合;结构域Ⅲ由474~633个残基组成,具有类似凝集素的三明治结构,经测定与幼虫受体结合和孔的功能有关[5]。Cry2A蛋白与Cry1A相比,结构和杀虫机制不同,很有可能成为控制昆虫产生抗药性的首选蛋白[6]。
本研究构建了Cry2Aa蛋白中16种成员的活性区空间结构。基于活性区空间结构差异,对Cry2Aa型伴孢晶体蛋白进行分类,并结合已有的活性信息探讨其构效关系,为今后各种突变体设计和克隆提供理论基础,对扩大Cry2Aa型伴孢晶体蛋白的杀虫谱、增强其杀虫毒力、延缓害虫产生抗药性等具有重要意义。
1 材料与方法
1.1 数据库、服务器与软件
美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)(http://www.ncbi. nlm.nih.gov/GenBank)蛋白质与基因序列检索比对数据库;Protein Data Bank(http://www.rcsbi.org/pbd/home/home.do)蛋白质结构数据库;Swiss-Model(http://swissmodel. expasy.org/)预测三级结构模型;序列比对服务器(http:/www. ebi.ac.uk/Tools/msa/muscle/);蛋白质分子三维结构显示分析软件PyMOL。
1.2 分析方法
1.2.1 Cry2Aa类蛋白活性区空间结构预测结果
从NCBI数据库获取Cry2Aa类蛋白的序列后,在Swiss-Model数据库分别提交Cry2Aa类蛋白序列,以已知结构的Cry2Aa(PDB登录号为1i5p)为模板进行同源建模,模拟出Cry2Aa类蛋白的三维结构模型。
1.2.2 基于二级结构组成特征的Cry2Aa分类
在蛋白质分子三维结构显示分析软件PyMOL中分别打开16个Cry2Aa类杀虫晶体蛋白成员的三级结构,读取其二级结构,基于二级结构特征进行分类。
1.2.3 不同类型Cry2Aa的结构差异和构效关系
分别选取Cry2Aa1、Cry2Aa3、Cry2Aa7、Cry2Aa14作为Cry2AaⅠ、Cry2AaⅡ、Cry2AaⅢ、Cry2AaⅣ的代表,比较其一级结构、二级结构及三级结构上的差异。
2 结果与分析
2.1 基于二级结构组成特征的Cry2Aa分类
Cry2Aa类蛋白共有16个成员,对各个蛋白质进行二级结构特征描述。在此基础上,将其分为Cry2AaⅠ、Cry2AaⅡ、Cry2AaⅢ、Cry2AaⅣ 4类。
Cry2AaⅠ类包括10个成员:Cry2Aa1、Cry2Aa2、Cry2Aa4、Cry2Aa5、Cry2Aa6、Cry2Aa8、Cry2Aa9、Cry2Aa10、Cry2Aa12、Cry2Aa13。
Cry2AaⅡ类包括2个成员:Cry2Aa3、Cry2Aa11。
Cry2AaⅢ类只有1个成员:Cry2Aa7。
Cry2AaⅣ类包括3个成员:Cry2Aa14、Cry2Aa15、Cry2Aa16。
2.2 不同类型Cry2Aa的二级结构分析
比较Cry2AaⅠ、Cry2AaⅡ、Cry2AaⅢ和Cry2AaⅣ 4种蛋白,对各蛋白的二级结构特征进行描述,结果发现,DomainⅠ保守性较高,4种蛋白均由α0、α0a、α1、α2、α3、α4、α5、α6及α7螺旋组成。通过与Cry1Aa活性蛋白比较,发现去除由49个氨基酸残基组成的N端、α0及α0a,不影响其发挥穿孔作用[4]。DomainⅡ差异较小,仅Cry2AaⅡ与其他成员在连接β8—β9的Loop上存在差异,Cry2AaⅠ、Cry2AaⅡ和Cry2AaⅣ的二级结构元件完全一致。DomainⅢ也存在差异,Cry2AaⅢ与其他成员存在较大差异,仅存在β12a、β12、β15、β16和β17二级结构元件,且β17比其他成员短,而Cry2AaⅠ、Cry2AaⅡ和Cry2AaⅣ的二级结构元件完全一致。
2.3 不同类型Cry2Aa的活性区空间结构比较分析
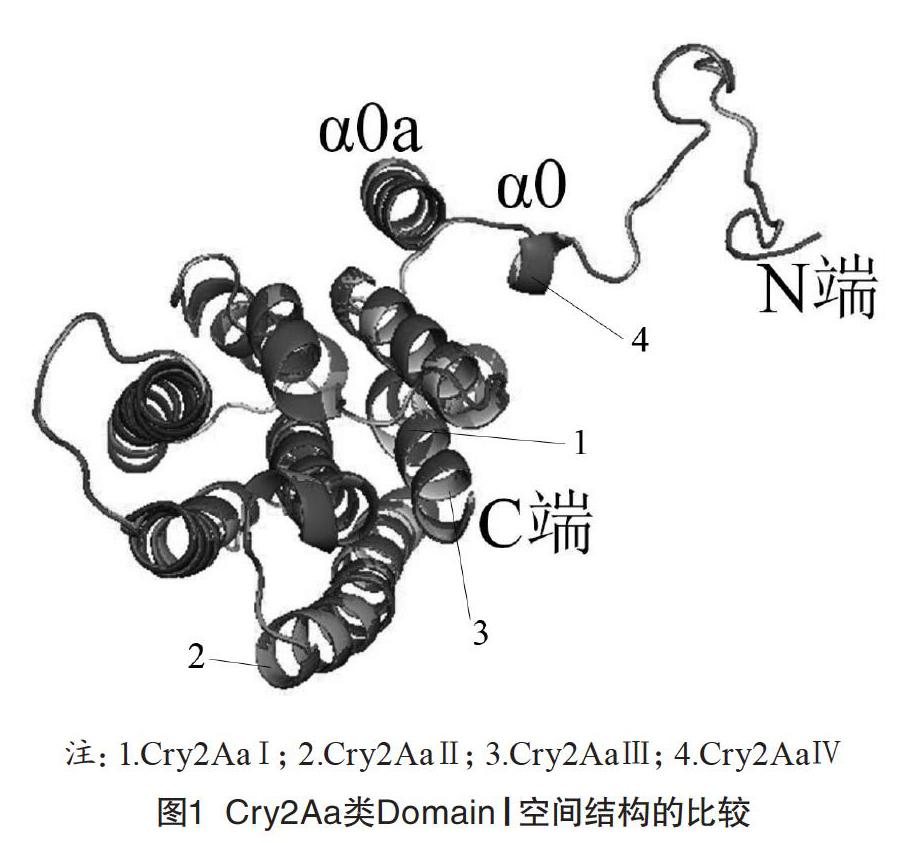
2.3.1 DomainⅠ的结构比对
比较各类Cry2Aa的DomainⅠ,所有的α螺旋与Loop几乎完全重叠,如图1所示。
2.3.2 DomainⅡ的结构比对
比较各类Cry2Aa的DomainⅡ,其比对结果如图2所示。由图2可知,Cry2AaⅠ与Cry2AaⅢ完全重合;Cry2AaⅡ与其他成员的差异主要体现在Loopβ8—β9,表现为卷曲方式不同、长度更长,其原因是Cry2AaⅡ在第408—423位的氨基酸比其他成员多了一个F(苯丙氨酸)和P(脯氨酸)。而Cry2AaⅣ与其他成员的差异主要体现在β3和β7,其走向相同,但构象不同,原因是Cry2AaⅣ在第293位的氨基酸存在差异。
2.3.3 DomainⅢ的结构比对
比较各类Cry2Aa的DomainⅢ,其比对结果如图3所示。由图3可知,Cry2AaⅠ与Cry2AaⅣ完全重合;Cry2AaⅡ与其他成员的差异主要体现在β12a,其走向相同,但构象不同,原因是Cry2AaⅡ在第480位的氨基酸存在差异。而Cry2AaⅢ与其他成员的差异较大,原因是仅存在β12a、β12、β15、β16和β17二级结构元件。
2.4 Cry2Aa型杀虫晶体蛋白构效关系分析
杀虫晶体蛋白的毒性水平与毒素的活性浓度有关,而毒素的活性浓度又取决于蛋白质的构象和溶解度。
Cry蛋白的DomainⅠ主要负责受体结合后的中肠刷状缘膜的穿膜以及离子通道的形成;邱林等[7]研究发现,甜菜夜蛾V-ATPase subunit B为Cry2Aa杀虫蛋白的功能受体。MONGKON AUDTHO等[8]利用舞毒蛾中肠酶快速将Cry2Aa1结构域Ⅰ切断,发现该片段对害虫不产生毒性。本研究发现,Cry2Aa的DomainⅠ非常保守,几乎完全重叠。由此可推断,Cry2Aa类各蛋白的离子通道的形成作用及与钙粘蛋白的结合能力相当。
DomainⅡ是一个具有典型的“希腊钥匙”的结构。研究表明与受体的结合有关[9]。Bt蛋白对昆虫的作用与昆虫中肠上的受体有关,不同的蛋白在昆虫中肠细胞膜上的结合位点和作用机制不同。Cry2Aa14蛋白(Cry2AaⅣ类)与Cry2Aa1和Cry2Aa2蛋白(Cry2AaⅠ类)的DomainⅡ序列存在氨基酸残基差异,即W293G,且其结构差异体现在β3和β7,其走向相同,但构象不同。RAMESH S HIRE等[10-11]研究发现,Cry2Aa1、Cry2Aa2与Cry2Aa14对斜纹夜蛾和棉铃虫均具有殺虫活性,然而Cry2Aa14对斜纹夜蛾和棉铃虫表现出更高的毒性,且对致倦库蚊具有杀虫活性。由此可推测,其β3和β7的构象差异可能导致毒性差异。现有的活性信息显示,Cry2Aa3(Cry2AaⅡ类)对家蚕和舞毒蛾具有杀虫活性,而其他成员未显示此活性信息[10]。Cry2Aa3与其他成员的结构差异主要体现在Loopβ8—β9,表现在卷曲方式不同、长度更长,这可能是由于它能识别不同的受体,对不同的害虫产生不同的毒效。
DomainⅢ可能参与受体之间的相互作用,同时,也与蛋白毒性的大小具有紧密联系。Cry2Aa14蛋白(Cry2AaⅣ类)与Cry2Aa1和Cry2Aa2蛋白(Cry2AaⅠ类)相比,虽然DomainⅢ的构象完全一致,但是Cry2Aa14蛋白的DomainⅢ序列在V625A存在差异。活性信息显示,Cry2Aa14对斜纹夜蛾和棉铃虫表现出更高的毒性[10],因此,DomainⅢ单个氨基酸的差异会显著地影响Cry蛋白的毒性水平。
[参考文献]
[1]吴洪福,郭淑元,李海涛,等.苏云金芽孢杆菌杀虫晶体蛋白结构和功能研究进展[J].东北农业大学学报,2009,40(2):118-122.
[2]翁绿水,陈 芬,肖国樱.Cry2Aa基因优化设计及功能验证[J].农业生物技术学报,2013,21(11):1 261-1 269.
[3]ROH J Y,CHOI J Y,LI M S,et al.Bacillus thuringiensis as a specific, safe, and effective tool for insect pest control[J].Journal of Microbiology and Biotechnology,2007,17(4):547-559.
[4]朱延明,郜 庭,张 凤,等.Cry2Aa9m抗虫基因植物表达载体构建及对大豆的遗传转化[J].东北农业大学学报,2013,44(1):1-6.
[5]MORSE R J,YAMAMOTO T,STROUD R M.Structure of Cry2Aa suggests an unexpected receptor binding epitope[J].Structure,2001,9(5):409-417.
[6]MANIKANDAN R,RAMALAKSHMI A,BALASUBRAMANI V,et al.Characterization and cloning of the Cry2Aa gene from indigenous isolates of Bacillus thuringiensis[J].Molekuliarnaia Biologiia,2015,49(4):520-526.
[7]邱 林.甜菜夜蛾中肠Cry1Ac/Cry2Aa结合蛋白的鉴定及功能分析[D].武汉:华中农业大学,2017.
[8]AUDTHO M,VALAITIS A P,ALZATE O,et al.Production of chymotrypsin-resistant Bacillus thuringiensis Cry2Aa1 delta-endotoxin by protein engineering[J].Applied Environmental Microbiology,1999,65(10):4 601-4 605.
[9]PANADDA B.Crystal structure of the mosquito-larvicidal toxin cry4Ba and its biological implications[J].Molecular Biology,2005(348):363-382.
[10]HIRE RAMESH S,MAKDE RAVINDRA D,DONGRE TANAJI K,et al.Expression, purification and characterization of the Cry2Aa14 toxin from Bacillus thuringiensis subsp kenyae[J].Toxicon,2009,54(4):24-519.
[11]MANIKANDAN R,RAMALAKSHMI A,BALASUBRA-MANI V,et al.Characterization and cloning of the Cry2Aa gene from indigenous isolates of Bacillus thuringiensis[J].Molekuliarnaia Biologiia,2015,49(4):520-526.
