老年高血压病人原发性醛固酮增多症的临床特点
2020-07-04车金娜李雪丽曹彩霞杨学成李丹钟丽娜
车金娜 李雪丽 曹彩霞 杨学成 李丹 钟丽娜
[摘要] 目的 探讨老年高血压病人原发性醛固酮增多症(PA)的临床特点。
方法 收集2000年1月—2018年12月我院收治并确诊的329例PA病人的临床资料,根据年龄分为老年组(年龄≥65岁,n=149)和非老年组(年龄<65岁,n=180),比较两组病人临床表现及生化指标的差异。
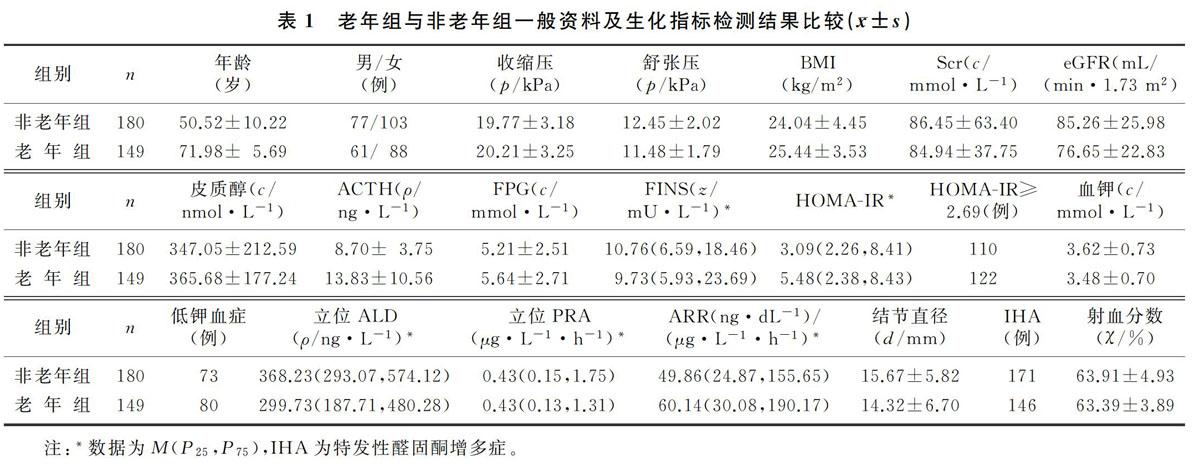
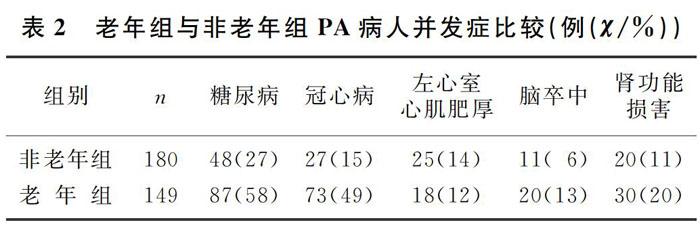
结果 与非老年组相比较,老年组PA病人体质量指数偏高,肾小球滤过率(eGFR)及舒张压偏低,胰岛素抵抗指数≥2.69及发生低钾血症的例数均高于非老年组,差异有显著性(t=-1.989~4.505,χ2=5.654~16.912,P<0.05);老年组糖尿病、冠心病、脑卒中、肾功能损害发生率较非老年组增高,差异有显著意义(χ2=5.105~44.525,P<0.05)。相关性分析显示,老年组舒张压(r=-0.211,P<0.05)、eGFR(r=-0.203,P<0.05)均与年龄呈负相关,血钾与胰岛素水平(r=-0.361,P<0.01)、eGFR(r=-0.212,P<0.05)呈负相关。
结论 老年高血压PA病人易发生胰岛素抵抗和低钾血症,且易合并糖尿病、冠心病、脑卒中及肾功能损害等。
[关键詞] 醛固酮增多症;高血压;老年人;胰岛素抗药性;低钾血症;肾脏损害
[中图分类号] R586.24
[文献标志码] A
[文章编号] 2096-5532(2020)03-0305-04
doi:10.11712/jms.2096-5532.2020.56.110
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200610.2131.013.html;2020-06-12 15:46
CLINICAL FEATURES OF ELDERLY HYPERTENSIVE PATIENTS WITH PRIMARY ALDOSTERONISM
CHE Jinna, LI Xueli, CAO Caixia, YANG Xuecheng, LI Dan, ZHONG Lina
(Department of Endocrinology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]ObjectiveTo investigate the clinical features of elderly hypertensive patients with primary aldosteronism (PA).
MethodsA retrospective analysis was performed for the clinical data of 329 patients who were diagnosed with PA and were admitted to our hospital from January 2000 to December 2018, and according to their age, they were divided into elderly group (149 patients aged ≥65 years) and non-elderly group (180 patients aged<65 years). Clinical manifestations and biochemical parameters were compared between the two groups.
ResultsCompared with the non-elderly group, the elderly group had a significantly higher body mass index and significantly lower estimated glomerular filtration rate (eGFR) and diastolic pressure, as well as a significantly higher number of patients with insulin resistance index ≥2.69 or hypokalemia (t=-1.989 to 4.505,χ2=5.654-16.912,P<0.05). The elderly group had significantly higher incidence rates of diabetes, coronary heart disease, stroke, and renal impairment than the non-elderly group (χ2=5.105-44.525,P<0.05). The correlation analysis showed that in the elderly group, diastolic pressure and eGFR were negatively correlated with age (r=-0.211, -0.203; both P<0.05), and serum potassium was negatively correlated with insulin (r=-0.361,P<0.01) and eGFR (r=-0.212,P<0.05).
ConclusionElderly patients with PA tend to develop hypokalemia and insulin resistance and are susceptible to the diseases such as diabetes, coronary heart disease, stroke, and renal impairment.
[KEY WORDS]hyperaldosteronism; hypertension; aged; insulin resistance; hypokalemia; kidney impairment
最新统计数据显示,我国65岁以上老年人占总人口的11.4%,其中50%以上的老年人患有高血压[1]。高血压是我国最常见的慢性病之一,同时是脑卒中、心肌梗死等心脑血管疾病死亡的主要危险因素。原发性醛固酮增多症(PA)是继发性高血压的常见病因,其在高血压病人中的发病率达10%,而在难治性高血压中的发病率高达17%~23%[2-3]。
PA病人心脏、肾脏等靶器官损害较为严重,极大影响了人们的健康[4-5]。目前关于老年高血压人群中PA的研究较少。本研究分析老年高血压人群PA的临床特点,以提高对其认识和重视。
1 资料与方法
1.1 一般资料
收集2000年1月—2018年12月我院收治并确诊的PA病人329例的临床资料, PA的诊断及
分型诊断均采用2016年《原发性醛固酮增多症诊断治疗的专家共识》的标准[4]。所有病人入院前均已停用对血浆醛固酮与肾素活性比值(ARR)影响较大的药物,包括醛固酮受体拮抗剂、保钾利尿剂、排钾利尿剂及甘草提炼物等至少4周;停用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、钙离子拮抗剂等药物至少2周。
1.2 研究方法
所有病人均行PA筛查,用化学发光法检测血浆立位醛固酮(ALD)、立位肾素活性(PRA);并于入院时进行病史采集,测量身高、体质量、血压,计算体质量指数(BMI)。所有病人均于入院次日清晨采集空腹静脉血,检测空腹血糖(FPG)、空腹胰岛素(FINS)、血钾、血钠、血肌酐(Scr)、皮质醇以及促肾上腺皮质激素(ACTH),并计算胰岛素抵抗指数(HOMA-IR)。HOMA-IR=FINS(mU/L)×FPG(mmol/L)/22.5,以HOMA-IR≥2.69作为胰岛素抵抗(IR)诊断标准[6]。肾小球滤过率(eGFR)=175×Scr-1.234×年龄-0.179(女性×0.79)[7]。左心室心肌肥厚的诊断依据心电图及超声心动图。肾脏损害的诊断参照美国肾脏协会轻度肾损害的诊断标准[8],eGFR<60 mL/(min·1.73 m2)。根据年龄分为老年组(年龄≥65岁)和非老年组(年龄<65岁),回顾性分析并比较两组病人临床表现及生化指标的差异。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析,正态分布资料结果以±s表示,数据间比较采用t检验;非正态分布资料结果以M(P25,P75)表示,数据间比较采用秩和检验。计数资料比较用卡方检验。相关性分析中两变量呈正态分布者采用Pearson相关分析,若不符合正态分布则采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床特点比较
与非老年组比较,老年组PA病人BMI偏高,eGFR及舒张压偏低,HOMA-IR≥2.69及发生低钾血症(血钾<3.5 mmol/L)的例数均高于非老年组,差异有显著性(t=-1.989~4.505,χ2=5.654~16.912,P<0.05);老年组中糖尿病、冠心病、脑卒中及肾功能损害发生率较非老年组增高,差异有显著性(χ2=5.105~44.525,P<0.05),两组間性别、收缩压、Scr、皮质醇、ACTH、FPG、FINS、HOMA-IR、血钾、立位ALD、立位PRA、ARR、结节直径、射血分数等指标比较差异无统计学意义(P>0.05)。见表1、2。
2.2 老年组与非老年组各临床指标之间的相关性
非老年组年龄与舒张压呈负相关(r=-0.245,P<0.05),胰岛素与eGFR呈负相关(r=-0.363,P<0.05),胰岛素与Scr水平呈正相关(r=0.411,P<0.05),而血钾水平与结节直径呈负相关(r=-0.312,P<0.05)。老年组舒张压(r=-0.211,P<0.05)、eGFR(r=-0.203,P<0.05)均与年龄呈负相关,血钾与胰岛素水平(r=-0.361,P<0.01)、eGFR(r=-0.212,P<0.05)呈负相关。
3 讨论
既往研究发现,ALD过多是导致心肌肥厚、心力衰竭和肾功能受损的重要危险因素[4]。相比原发性高血压,PA病人发生脑卒中及心血管疾病等并发症的风险更高,糖尿病及代谢综合征(MS)易感性明显增强[9-10]。然而,目前针对老年人群中PA病人的研究相对较少,在我国及亚洲人群的研究更为少见。国外有研究发现在老年PA病人中持续性高血压常见,对心脏、颅脑、肾脏等高血压靶器官损害更为严重,因此对老年PA病人的早期诊断及治疗至关重要[11]。本研究旨在探讨我国老年PA病人的临床特点及生化指标,为老年PA病人的早期筛查及诊治提供依据。
TAKEDA等[11]研究发现,老年PA病人易发生心脑血管疾病,预后较差。本研究也显示,老年组PA病人冠心病及脑卒中的发生率明显高于非老年组,与TAKEDA等[11]的结果相一致。由于ALD和盐皮质激素受体的过度活化,对血管壁产生氧化应激、炎症刺激、纤维化和重构等有害影响,因此与原发性高血压相比较,PA病人易发生脑卒中及心血管疾病[9,12-13]。此外,有研究发现PA病人易出现左心室肥大,心肌收缩力下降,冠心病的发生率增加[14]。有Meta分析显示,PA病人发生充血性心力衰竭的概率是原发性高血压病人的2倍[15-17]。除了对心血管系统有影响外,大量研究也证实ALD可导致肾脏损害,并且肾脏损害与ALD的浓度密切相关[18]。相比原发性高血压,PA病人肾脏损害的发生率更高[19]。国外研究显示,老年PA病人低钾血症及肾功能损害的发生率要明显高于非老年病人[11,20]。本研究也显示,与非老年组比较,老年组PA病人血钾偏低,eGFR明显降低,肾功能损害的发生率增高;相关分析显示,老年组PA病人血钾与eGFR呈负相关,提示除了ALD影响肾功能外,低钾血症也可加重肾功能损害,这可能与低钾血症引起肾小管间质损伤有关[21]。但老年PA病人肾功能损害的具体机制需要进一步研究。
[24]龚艳春,郭瑞敏,陈绍行,等. 原发性醛固酮增多症与原发性高血压代谢异常的比较[J]. 中华心血管病杂志, 2008,36(2):128-131.
[25]KAWARAZAKI W, FUJITA T. The role of aldosterone in obesity-related hypertension[J]. American Journal of Hypertension, 2016,29(4):415-423.
[26]ADOLF C, ANTON K, FRANKE A, et al. Cortisol excess in patients with primary aldosteronism impacts on left ventricular hypertrophy[J]. The Journal of Clinical Endocrinology and Metabolism, 2018,103(12):4543-4552.
[27]郭瑞敏. 原发性醛固酮增多症代谢异常及基因分型研究[D]. 上海:上海交通大学, 2007.
[28]OHNO Y, SONE M, INAGAKI N, et al. Obesity as a key factor underlying idiopathic hyperaldosteronism[J]. The Journal of Clinical Endocrinology and Metabolism, 2018,103(12):4456-4464.
[29]唐发宽,林乐健. 老年难治性高血压研究进展[J]. 中华老年心脑血管病杂志, 2016,18(1):2-4.
[30]CAO C X, YANG X C, GAO Y X, et al. Expression of aldosterone synthase and adrenocorticotropic hormone receptor in adrenal incidentalomas from normotensive and hypertensive patients: distinguishing subclinical or atypical primary aldosteronism from adrenal incidentaloma[J]. International Journal of Molecular Medicine, 2012,30(6):1396-1402.
(本文編辑 黄建乡)
[收稿日期]2019-11-04; [修订日期]2020-04-09
[基金项目]北京市科技重大专项(D181100000118005);“临床医学+X”工程项目(41217010003);山东省医药卫生科技发展计划项目(2018WS380)
[第一作者]车金娜(1994-),女,硕士研究生。
[通信作者]曹彩霞(1975-),女,博士,副主任医师,硕士生导师。E-mail:caocaixiaqd@ 163.com
