Six1对支气管上皮细胞间质转化及纤维化的影响
2020-07-04王文鑫杨召川曲政海王冲徐雷张梦雪
王文鑫 杨召川 曲政海 王冲 徐雷 张梦雪

[摘要]目的 探讨Six1对人支气管上皮细胞(16HBE)間质转化(EMT)及纤维化的影响。方法 体外培养16HBE细胞株并分成3组,实验组转染Six1(NM_005982)-GV146质粒,阴性对照组转染GV146对照质粒,空白对照组仅给予LipofectamineTM2000转染试剂。转染48 h后用倒置显微镜观察各组细胞形态的变化;采用RT-PCR及Western blot技术检测Six1、E-钙黏蛋白、α肌动蛋白、波形蛋白、纤维粘连蛋白、角蛋白的mRNA和蛋白表达。结果 与阴性对照组及空白对照组比较,实验组细胞间隙增大、形态发生梭形改变;Six1、α肌动蛋白、波形蛋白、纤维粘连蛋白的mRNA及蛋白表达增高,差异有显著性(F=11.40~881.42,P<0.05);E-钙黏蛋白、角蛋白mRNA及蛋白表达明显降低,差异有显著性(F=10.71~20.37,P<0.05)。阴性对照组与空白对照组以上各mRNA及蛋白的表达比较差异均无统计学意义(P>0.05)。结论 Six1过表达可使16HBE细胞发生EMT和纤维化改变。
[关键词] Six1;上皮-间质转化;支气管;上皮细胞;气道重塑;哮喘
[中图分类号] R562.26[文献标志码] A[文章编号] 2096-5532(2020)04-0399-05
doi:10.11712/jms.2096-5532.2020.56.083[HT]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200417.1000.017.html;2020-04-18 09:38
EFFECT OF SIX1 ON EPITHELIAL-MESENCHYMAL TRANSITION AND FIBROSIS IN HUMAN BRONCHIAL EPITHELIAL CELL LINE 16HBE
WANG Wenxin, YANG Zhaochuan, QU Zhenghai, WANG Chong, XU Lei, ZHANG Mengxue
(Depart-ment of Pediatrics, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]Objective To investigate the effect of Six1 on epithelial-mesenchymal transition (EMT) and fibrosis in human bronchial epithelial cells (16HBE).
Methods 16HBE cells were cultured in vitro and then they were divided into experimental group transfected with Six1 (NM_005982)-GV146 plasmid, negative control group transfected with GV146 control plasmid, and blank control group treated with the LipofectamineTM 2000 transfection reagent. At 48 hours after transfection, an inverted microscope was used to observe the morphological changes of cells, and RT-PCR and Western blot were used to measure the mRNA and protein expression of Six1, E-cadherin, α-smooth muscle actin (α-SMA), vimentin, fibronectin, and keratin.ResultsCompared with the negative control group and the blank group, the experimental group showed a significant increase in intercellular space and had a spindle shape, as well as significant increases in the mRNA and protein expression of Six1, α-SMA, vimentin, and fibronectin (F=11.40-881.42,P<0.05) and significant reductions in the mRNA and protein expression of E-cadherin and keratin (F=10.71-20.37,P<0.05). There were no significant differences in mRNA and protein expression between the negative control group and the blank control group (P>0.05).Conclusion Six1 overexpression may induce EMT and fibrosis of 16HBE cells.
[KEY WORDS] Six1; epithelial-mesenchymal transition; bronchi; epithelial cells; airway remodeling; asthma
支气管上皮细胞间质转化(EMT)是氣道重塑中最重要的改变之一,而气道重塑是支气管哮喘过程中最为特征性的病理变化之一。目前,针对支气管哮喘的治疗仍然是以吸入糖皮质激素为主的对症治疗,虽然改善了大部分哮喘病人的临床症状,但不能完全阻止气道重塑的发生和发展[1]。因此,探讨支气管哮喘病人气道重塑的机制、探寻针对EMT发生和发展的治疗方法,对有效治疗支气管哮喘具有重要意义。Six1是同源盒基因家族的成员,可特异性地调节基因表达,在正常成年人组织中不表达或者表达量很低[2],在多种疾病中表达量增高,包括肺癌和肺纤维化[3-5],但Six1对支气管哮喘及EMT的作用机制尚不清晰。本实验探讨Six1对支气管上皮细胞及气道重塑的影响,为今后更有效地防治哮喘气道重塑提供新的分子靶点和理论基础。现将结果报告如下。
1 材料与方法
1.1 主要试剂及来源
人支气管上皮细胞(16HBE,中国医学科学院肿瘤细胞库);Six1(NM_005982)-GV146过表达质粒甘油菌(吉凯公司);质粒抽提试剂盒(TIANGEN公司);GAPDH、Six1、E-钙黏蛋白、波形蛋白、α-肌动蛋白、纤维粘连蛋白、角蛋白引物(北京睿博兴科生物技术有限公司);角蛋白、E-钙黏蛋白、纤维粘连蛋白、α-肌动蛋白、GAPDH一抗(CST公司),Six1抗体(Affinity公司),波形蛋白一抗(Elabscience公司);抗兔二抗、抗鼠二抗(Elabscience公司);胎牛血清(FBS)、RPMI 1640培养基、胰蛋白酶EDTA消化液、二甲基亚砜(美国Sigma公司);TB GreenPremix Ex TaqTMⅡ(RR820A)以及RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser (RR047A)(Takara公司)。SDS-PAGE凝胶配制试剂盒(碧云天生物公司)。
1.2 研究方法
1.2.1 质粒扩增及抽提 将携带绿色荧光蛋白的Six1(NM_005982)-GV146过表达质粒及GV146对照质粒甘油菌以1∶300接种至含卡那霉素的LB培养基溶液中,置于培养箱中以37 ℃、250 r/min振荡过夜培养12 h。按照质粒抽提试剂盒说明书进行质粒的抽提。对抽提后的质粒测定纯度并保存于-20 ℃的冰箱中备用。
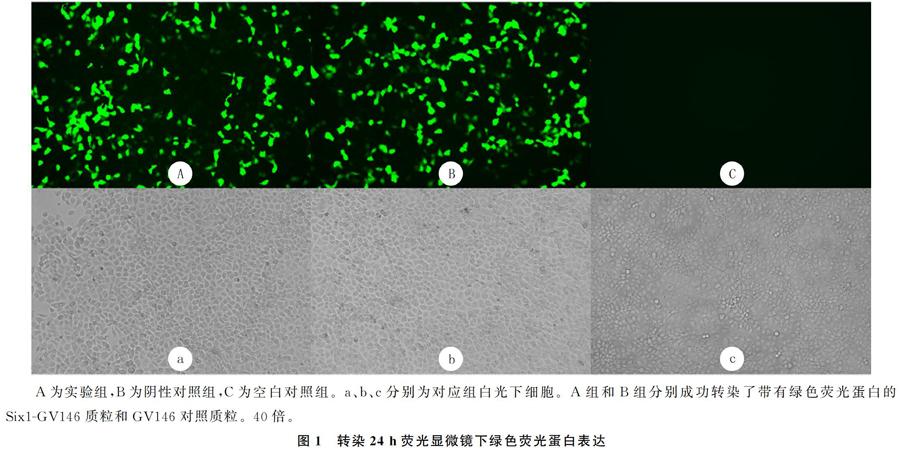
1.2.2 分组及转染 转染前1 d取生长至对数期的16HBE细胞,接种于12孔板,待细胞融合至90%时,将细胞分为以下3组。①实验组(A组):转染重组的Six1-GV146质粒;②阴性对照组(B组):转染GV146对照质粒;③空白对照组(C组):仅给予LipofectamineTM2000转染试剂。转染24 h后荧光显微镜观察细胞形态及转染效率。选取转染效率达50%以上的细胞株进行后续实验。
1.2.3 RT-PCR检测 将3组细胞培养48 h后,用RNAiso Plus提取细胞总RNA,并测定RNA浓度和纯度。然后按照反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser说明书将RNA反转录获得相应的cDNA,并用RT-PCR方法检测细胞内的Six1及E-钙黏蛋白、纤维粘连蛋白、波形蛋白、α-肌动蛋白、角蛋白的mRNA表达水平,其内参为GAPDH,扩增引物及其序列见表1。使用TB GreenPremix Ex TaqTMⅡ试剂盒进行RT-PCR扩增。记录各组样本扩增CT值,采用2-ΔΔCT的方法计算各基因的相对表达量。
1.2.4 Western blot检测 将各组细胞培养48 h后,用预冷的RIPA细胞裂解液进行裂解(RIPA∶PMSF=100∶1),离心后取上清。使用BCA法检测蛋白浓度。将蛋白转印至PVDF膜,50 g/L奶粉封闭1 h,将封闭后的PVDF膜分别置于相应的一抗孵育液中,4 ℃摇床孵育过夜。加入二抗,室温孵育60 min后,滴加ECL显影剂于显影仪中曝光显影。用Image J软件计算各组蛋白条带的灰度值,以GAPDH为对照分析各蛋白相对表达量。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析,计量资料数据以[AKx-D]±s表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 16HBE细胞中Six1转染情况
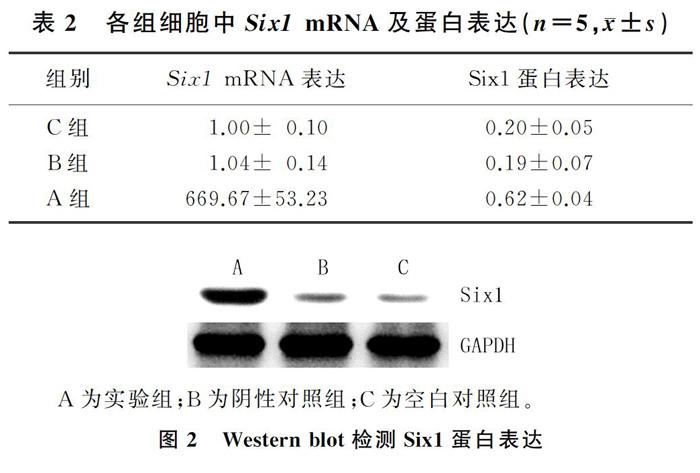
转染24 h后,荧光倒置显微镜下观察到带有绿色荧光蛋白的质粒成功转至细胞中。见图1。转染48 h后,RT-PCR及Western blot检测显示,与空白对照组和阴性对照组比较,实验组16HBE细胞中Six1 mRNA及蛋白表达水平明显增高,差异有显著意义(F=881.42、78.38,P<0.01),而阴性对照组与空白对照组比较差异无统计学意义(t=0.53、0.05,P>0.05)。结果表明,Six1转染至16HBE细胞并表达。见表2和图2。
2.2 Six1对16HBE细胞形态的影响
倒置显微镜观察显示,阴性对照组与空白对照组16HBE细胞为鹅卵石样单层细胞,细胞间连接紧密,且两组间细胞形态无明显差异;与空白对照组和阴性对照组比较,实验组细胞拉长呈梭形改变,细胞间连接不紧密,细胞间隙增大。提示上调Six1的表达可使16HBE上皮细胞出现间质细胞形态改变。见图3。
2.3 Six1对16HBE细胞EMT相关蛋白mRNA及蛋白表达的影响
与阴性对照组及空白对照组比较,实验组E-钙黏蛋白、角蛋白的mRNA和蛋白表达明显降低,差异有显著性(F=10.71~20.37,P<0.05);而α肌动蛋白、波形蛋白的mRNA及蛋白表达明显增高,差异有显著性(F=11.40~73.97,P<0.05)。阴性对照组与空白对照组的E-钙黏蛋白、角蛋白、α肌动蛋白、波形蛋白的mRNA及蛋白表达差异均无统计学意义(t=0.01~0.89,P>0.05)。见表3和图4。
2.4 Six1對16HBE细胞中纤维粘连蛋白mRNA和蛋白表达的影响
与空白对照组和阴性对照组相比,实验组纤维粘连蛋白的mRNA和蛋白表达明显增高,差异有显著性(F=230.00、23.26,P<0.01),阴性对照组与空白对照组的mRNA及蛋白表达差异均无统计学意义(t=0.38、1.15,P>0.05)。见表4和图5。
3 讨论
气道重塑是发生在支气管哮喘、慢性阻塞性肺疾病(COPD)、肺纤维化等疾病中最重要的病理改变之一,也是导致哮喘病人对常规治疗药物反应性降低的主要原因之一[6]。在支气管哮喘反复发作的过程中,呼吸道上皮细胞反复发生损伤和修复,导致气道壁结构和功能持续改变,造成气道重塑[7-9]。支气管上皮细胞是呼吸系统最主要的防御屏障,除了与物理屏障、局部免疫的发生发展有关外,在某些慢性气道疾病的病程中发挥至关重要的作用,包括支气管哮喘的气道重塑过程[10]。相关的研究发现,经OVA致敏的哮喘小鼠支气管肺组织出现明显增厚和广泛的纤维化,且在支气管肺泡灌洗液及支气管肺组织中均发现Six1表达的增高,进一步抑制Six1表达后小鼠气道炎症和纤维化得到缓解[11],初步证实Six1参与支气管哮喘纤维化过程,但其对气道重塑和纤维化作用机制尚不清楚。
Six1是近年发现的同源盒基因中的一种类型,定位于人染色体14q23上,涉及多种组织器官发育,在成年后的多种组织中无表达或表达量低于检测限度,却在多种疾病中过度表达[12-13]。已有大量的研究证实,Six1可以增强肿瘤细胞的增殖、侵袭和转移能力,且伴随着EMT的现象[14-16]。近年来关于Six1与呼吸道疾病的相关性研究也逐渐得到更多人的关注,结果显示Six1的异常表达与肺癌的增殖和迁移密切相关,在肺癌组织中Six1促进了癌周及癌内的淋巴管形成、淋巴入侵以及肺癌细胞的远处转移[17]。我们前期研究结果显示,Six1在哮喘模型小鼠中高表达[11],推测Six1可能在哮喘气道重塑中参与了EMT和纤维化的过程,干预Six1的表达可能会影响EMT及气道重塑。
EMT是近年来人们提出的关于纤维化机制的新思路。在EMT过程中上皮细胞通过转化为间充质细胞,使细胞具有了更强的侵袭性、运动性和抵抗性。上皮细胞形态从鹅卵石样单层细胞转变为可运动纺锤状细胞,细胞间及细胞基质间连接的紧密程度下降,伴有上皮细胞表型标志物如ZO-1、E-钙黏蛋白等表达下调,而间充质细胞标志物如α-肌动蛋白、波形蛋白等表达增加,基膜发生降解,细胞获得迁移和侵袭能力,从而发生了分子重塑和表型的改变[18-20]。相关研究分别从肺纤维化病人及哮喘小鼠也检测到肺上皮细胞可同时表达上皮细胞和间质细胞标记物,初步证实了哮喘的过程中存在EMT现象[21]。越来越多的研究表明,上皮细胞EMT在纤维化中扮演重要的角色[22],纤维粘连蛋白是成纤维细胞的标志蛋白,气道成纤维细胞在气道纤维化和气道重塑的过程具有重要作用[23]。研究发现,支气管哮喘发生的早期就已经开始气道重塑的过程,并伴随着上皮细胞表现出间质细胞的特征[24],表明支气管EMT可能是哮喘气道重塑发生早期的一种病理改变。本文研究探讨Six1与EMT、纤维化和气道重塑的关系。结果显示,正常16HBE细胞中仅有少量的Six1表达,而上调Six1表达后16HBE细胞则发生了形态的改变,由鹅卵石样向梭形转变,细胞间隙增加,出现了间质细胞的形态。进一步进行mRNA和蛋白检测表明,实验组细胞中上皮细胞标
志物E-钙黏蛋白、角蛋白显著降低,而间质细胞标志物α-肌动蛋白、波形蛋白的表达均有不同程度的增加,并且在此过程中成纤维细胞标志物纤维粘连蛋白的表达也明显升高,说明上调Six1表达可使16HBE细胞发生EMT,同时发生纤维化的改变。
综上所述,Six1可能是造成呼吸道上皮细胞EMT、气道壁纤维化并发生气道重塑的原因之一,抑制Six1的表达对正常的支气管上皮不会产生影响,但对抑制气道重塑有一定的作用。本文结果为未来哮喘的控制和靶向治疗提供了新的方向。
[参考文献]
[1]FEHRENBACH H, WAGNER C, WEGMANN M. Airway remodeling in asthma: what really matters[J]. Cell and Tissue Research, 2017,367(3):551-569.
[2]XIN Xiaochuan, LI Yue, YANG Xianghong. SIX1 is overexpressed in endometrial carcinoma and promotes the malignant behavior of cancer cells through ERK and AKT signaling[J]. Oncology Letters, 2016,12(5):3435-3440.
[3]HOSSEINIPOUR M, WAN F, ALTOMARE D, et al. HPV16-transformed human keratinocytes depend on SIX1 expression for proliferation and HPV E6/E7 gene expression[J]. Virology, 2019,537:20-30.
[4]LIU Z, MAR K B, HANNERS N W, et al. A NIK-SIX signalling axis controls inflammation by targeted silencing of non-canonical NF-κB[J]. Nature, 2019,568(7751):249-253.
[5]DU Peizhun, ZHAO Jing, WANG Jing, et al. Sine oculis homeobox homolog 1 regulates mitochondrial apoptosis pathway via caspase-7 in gastric cancer cells[J]. Journal of Cancer, 2017,8(4):636-645.
[6]甘辉,刘光辉,喻明霞. 支气管哮喘的靶向药物治疗[J]. 中华临床免疫和变态反应杂志, 2019,2(2):157-162.
[7]HOLT P G, STRICKLAND D H, HALES B J. Defective respiratory tract immune surveillance in asthma a primary causal factor in disease onset and progression[J]. CHEST, 2014,145(2):370-378.
[8]AL M S, JOHNSON J R, HAMID Q. Remodeling in asthma[J]. The Journal of Allergy and Clinical Immunology, 2011,128(3):451-462.
[9]HIROTA N, MARTIN J G. Mechanisms of airway remodeling[J]. CHEST, 2013,144(3):1026-1032.
[10]MOHEIMANI F, HSU A C, REID A T, et al. The genetic and epigenetic landscapes of the epithelium in asthma[J]. Respiratory Research, 2016,17(1):119-123.
[11]YANG Zhaochuan, YI Mingji, SHAN Yanchun, et al. Targeted inhibition of Six1 attenuates allergic airway inflammation and remodeling in asthmatic mice[J]. Biomedicine & Pharmacotherapy, 2016,84:1820-1825.
[12]WANG Lili, LIU Hongchen. microRNA-188 is downregulated in oral squamous cell carcinoma and inhibits proliferation and invasion by targeting SIX1[J]. Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine, 2016,37(3):4105-4113.
[13]TRISTAN L, SAVITA B, SEBASTIAN S, et al. Inhibition of six1 affects tumour invasion and the expression of cancer stem cell markers in pancreatic cancer[J]. BMC Cancer, 2017,17(1):249.
[14]马晓峰,马莉,魏小果. Six1在结肠癌组织高表达并增强结肠癌细胞侵袭能力[J]. 临床荟萃, 2019,34(5):426-430.
[15]YU Chao, ZHANG Bo, LI Yali, et al. SIX1 reduces the expression of PTEN via activating PI3K/AKT signal to promote cell proliferation and tumorigenesis in osteosarcoma[J]. Biomedicine & Pharmacotherapy, 2018,105:10-17.
[16]XU H W, ZHANG Y, PEA M M, et al. Six1 promotes colorectal cancer growth and metastasis by stimulating angiogenesis and recruiting tumor-associated macrophages[J]. Carcinogenesis, 2017,38(3):281-292.
[17]劉志广,韩江红,李宁. Six1基因在肺癌组织表达水平及RNA干扰抑制其表达后对肺癌细胞生物学特性的影响[J]. 中国老年学杂志, 2019,3(3):618-621.
[18]DU Qing, ZHANG Xuezhi, ZHANG Xin, et al. Propofol inhibits proliferation and epithelial-mesenchymal transition of MCF-7 cells by suppressing miR-21 expression[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019,47(1):1265-1271.
[19]HADDAD A, GAUDET M, PLESA M, et al. Neutrophils from severe asthmatic patients induce epithelial to mesenchymal transition in healthy bronchial epithelial cells[J]. Respiratory Research, 2019,20(1):234-240.
[20]NANTAJIT D, LIN D, LI J J. The network of epithelial-mesenchymal transition: potential new targets for tumor resis-tance[J]. Journal of Cancer Research and Clinical Oncology, 2015,141(10):1697-1713.
[21]JOHNSON J R, ROOS A, BERG T, et al. Chronic respiratory aeroallergen exposure in mice induces epithelial-mesenchymal transition in the large airways[J]. PLoS One, 2011,6(1): e16175.
[22]MA Jifang, ZHANG Lei, HAO Jianbing, et al. Up-regulation of microRNA-93 inhibits TGF-β1-induced EMT and renal fibrogenesis by down-regulation of orai1[J]. Journal of Pharmacological Sciences, 2018,136(4):218-227.
[23]LI Binbin, CHEN Yunlong, PANG Fuzhen. MicroRNA-30a targets ATG5 and attenuates airway fibrosis in asthma by suppressing autophagy[J]. Inflammation,2020,43(1):44-53.
[24]BALLESTER B, MILARA J, CORTIJO J. Idiopathic pulmonary fibrosis and lung cancer: mechanisms and molecular targets[J]. International Journal of Molecular Sciences, 2019,20(3):593.
(本文編辑 黄建乡)
[收稿日期]2019-11-13; [修订日期]2020-03-13
[基金项目]国家自然科学基金青年科学基金项目(81700029);山东省自然科学基金项目(ZR2017MH017);青岛市民生科技计划项目(19-6-32-nsh)
[第一作者]王文鑫(1992-),女,硕士研究生。
[通信作者]曲政海(1963-),男,硕士,教授,博士生导师。E-mail:quzhenghai@163.com。
