巨细胞胶质母细胞瘤5例临床病理学分析
2020-07-04王珏吴景何杰
王珏 吴景 何杰
[摘要] 目的 探讨巨细胞胶质母细胞瘤(Giant cell glioblastoma,GCG)的临床病理学特征、免疫表型和鉴别诊断。 方法 回顾性分析安徽省肿瘤医院、安徽省立医院南区病理科2013年6月~2018年5月的住院手术病例5例GCG的临床资料、病理学形态和免疫组织化学标记结果。 结果 5例患者中2例男性,3例女性。年龄11~61岁,平均49岁。发生于顶叶3例,发生于颞叶1例,发生于枕部1例。肿块直径3.0~8.0 cm,平均5.8 cm。组织学特征为瘤细胞多形性,以巨怪形瘤巨细胞为主,病理性核分裂像和坏死多见,网状纤维沿血管周围分布。瘤细胞GFAP表达差异较大,弥漫表达Vimentin,Ki-67约为20%~35%。 结论 GCG是一种罕见的具有特殊临床病理特征、预后差的中枢神经系统肿瘤。病理组织学上需与伴有间变特征的多形性黄色瘤型星形细胞瘤、胶质肉瘤等鉴别。
[关键词] 胶质母细胞瘤;巨细胞型;临床病理学;免疫表型
[中图分类号] R739.4 [文献标识码] B [文章编号] 1673-9701(2020)12-0150-04
[Abstract] Objective To investigate clinicopathological characteristics, immunophenotype and differential diagnosis of giant cell glioblastoma(GCG). Methods The clinical data, pathological morphology, and immunohistochemical results of 5 cases of hospitalized patients with GCG in the Department of Pathology, Anhui Provincial Cancer Hospital and Anhui Provincial Hospital from June 2013 to May 2018 were retrospectively analyzed. Results 2 of the 5 patients were male and 3 were female. They were aged 11 to 61 years, with an average of 49 years. 3 cases occurred in the parietal lobe, 1 in the temporal lobe, and 1 in the occipital region. Mass diameters ranged from 3.0 cm to 8.0 cm, with an average of 5.8 cm. Histological features were tumor cell pleomorphism, which is dominated by giant monstrous tumor giant cells. Pathological mitotic figures and necrosis were common, and reticular fibers were distributed around blood vessels. The expression of glial fibrillary acidic protein(GFAP) was significantly different in tumor cells. The diffuse expression of Vimentin, and Ki-67 was about 20% to 35%. Conclusion GCG is a rare central nervous system tumor with special clinicopathological characteristics and poor prognosis. Histopathologically needs to be distinguished from pleomorphic xanthocytoma astrocytoma and gliosarcoma with anaplastic features.
[Key words] Glioblastoma; Giant cell type; Clinicopathology; Immunophenotype
巨細胞胶质母细胞瘤(Giant cell glioblastoma,GCG)是一种临床较为罕见的中枢神经系统肿瘤,属于WHO Ⅳ级的恶性肿瘤,其不足胶质母细胞瘤的1%[1]。镜下以巨怪形巨细胞占优势为病理学形态特征。国内报道较少见,本文收集报道5例GCG,通过分析GCG的临床病理特征及免疫组化表型,讨论其鉴别诊断,以提高对该瘤的认识,现报道如下。
1 资料与方法
1.1 一般资料
5例均为安徽省肿瘤医院、安徽省立医院南区病理科2013年6月~2018年5月的住院手术病例。
1.2 方法
10%中性福尔马林固定5例病理标本,经常规组织脱水及石蜡包埋、常规HE染色和免疫组化标记,采用Ventana Bench Maker XT 全自动免疫组化仪进行染色。所用抗体分别为波形蛋白(Vimentin)、胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)、P53蛋白(Protein 53,P53)、分化抗原决定簇-34(Clusters of differentiation-34,CD34)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)、广谱细胞角蛋白(Pan cytokeratin,CK-pan)、上皮膜抗原(Epithelial membrane antigen,EMA)、Ki-67,所有抗体均购自北京中杉金桥生物技术有限公司。所有标记均设阴性和阳性对照。
2 结果
2.1 临床基本资料
5例患者中2例男性,3例女性。年龄11~61岁,平均49岁。发生于顶叶3例,占总数的60%;发生于颞叶1例,占总数的20%;发生于枕部1例,占总数的20%。临床上均表现为逐渐增大的肿块,肿块直径3.0~8.0 cm,平均5.8 cm。见表1。
2.2 影像学资料
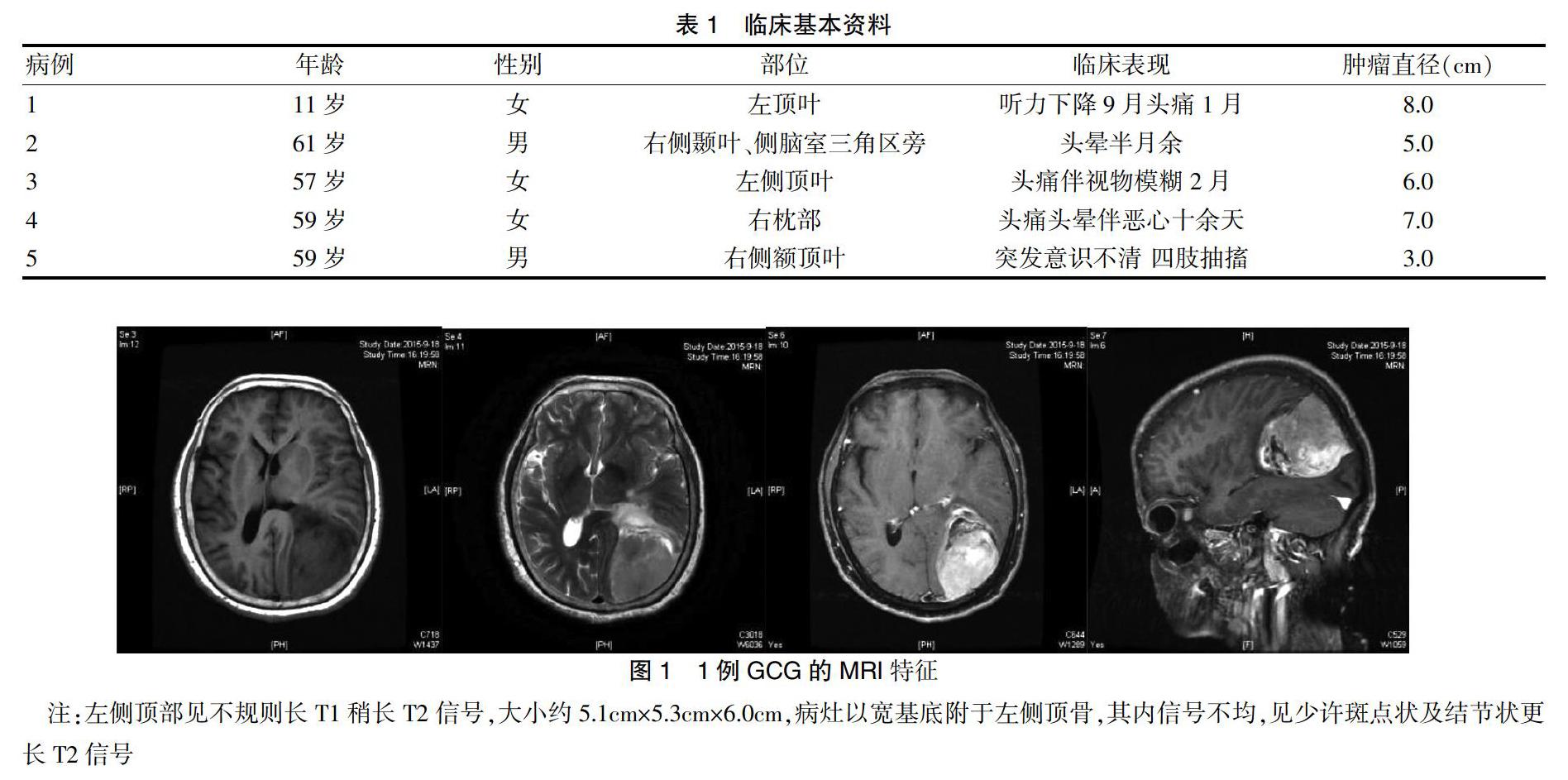
5例中2例病灶MRI表现为长T1长T2,为主不均匀信号,增强后呈明显“花环样”强化;但其余3例影像表现缺乏特异性。见图1。
2.3 病理特点
镜下见肿瘤细胞的异型性显著,见多量巨怪形的多核巨细胞(封三图2A~2B)及一些小的“纺锤”状合体细胞;网染可显示肿瘤组织网状纤维丰富(封三图2K),奇异的巨细胞胞浆丰富且体积巨大,单核或者多核,多核者最多可达20余个核,核染色质深,大小形态不一,呈角状,核仁明显,胞质内包涵体可见(封三图2C),病理性核分裂象易见,除巨细胞外尚见小圆形和梭形瘤细胞(封三图2D)。部分病例可以见到假“栅状”状的坏死(封三图2E~2F)及大片缺血性的坏死(封三图2G),血管周围淋巴细胞“袖套”样结构浸润有时可见(封三图2J),瘤内可见灶性的小血管增生,但血管内皮细胞增生并不明显(封三图2H),可见肿瘤细胞围绕血管分布(封三2I)有时形成不典型的假菊形团状结构。
2.4 免疫组织化学
免疫组化标记所有病例均阳性表达 Vimentin、GFAP、EGFR和p53,Vimentin均弥漫性表达,GFAP表达差异较大,所有病例CD34、CK-pan、EMA均阴性,Ki-67增殖指数较高,约20%~35%。见封三图3。
3 讨论
GCG为胶质母细胞瘤的亚型,1914年Schmincke等[2]首先报道,提出神经节胶质瘤这个命名,因为常有丰富的网状基质,曾被称巨怪细胞肉瘤,后因其瘤细胞表达GFAP而提示肿瘤细胞的本质为星形细胞分化,在新的WHO分类中采用巨细胞型胶质母细胞瘤这一名称。
GCG女性较多见,男女之比为1:1.6[3]。发病年龄跨度大,平均42岁,虽然GCG儿童可发病,但更易发生于中老年人,本文5例患者,平均年龄49岁,除1例为11岁儿童外,其余4例均为老年患者。GCG好发部位在大脑半球皮质下的白质,其中颞、顶叶皮质最为多见,本文5例中3例发生于顶叶,1例于颞叶,部分病例的病灶也可累及基底核与对侧的大脑半球。临床上患者常表现为非特异性的神经功能障碍症状,如头痛、呕吐、癫痫、视力或听力的减退以及偏瘫等症状,还有性格改变等,最为危险的症状是颅内压迅速增高,常常病史短(常<3个月),本文5例以头晕、头痛表现为主,病史均<2个月。
GCG的MRI表现常缺乏特异性,术前正确的影像学诊断较困难,最为典型的MRI表现为长T1及长T2为主的不均一信号,增强以后在GCG病灶的周边会呈现出环状的强化影,而中央部分则会呈现出低密度的坏死区域,肿瘤可见清楚边界的原因可能为瘤组织明显增生的间质[4],也是因此,有时GCG影像会误诊为脑外肿瘤或靠近脑表的低级别胶质瘤。但其实多数的GCG影像学表现缺乏特异性,很难与其他类型胶质母细胞瘤相鉴别。
GCG瘤细胞镜下组织形态差异较大,最为常见的是体积巨大且形态怪异的巨细胞,其次为小圆形瘤细胞及梭形瘤细胞,可伴有其它种形态的胶质瘤成分及间质成分,其中非退变瘤巨细胞>50%。大多数瘤细胞的胞浆较丰富,嗜伊红,细胞核合体状,核膜、核仁清晰,核内假包涵体可见,核分裂像易见。肿瘤间质见增生显著的血管,但没有明显的血管内皮细胞增生,一些不典型的假菊形团通常是由瘤细胞围绕血管而形成,瘤内常见缺血性及假栅栏状坏死。网状纤维染色显示网状纤维丰富,多沿着血管分布。瘤细胞间可见多少不等的淋巴细胞浸润,有文献报道淋巴细胞的浸润可能与预后有相关性。
免疫组织化学标记物GFAP在GCG中表达差异较大,多数病例阳性细胞灶性分布,Fletcher CDM[5]报道肿瘤分化越低,阳性细胞越少。约80%的GCG病例存在p53基因突变,可见胞核内p53蛋白聚集[6]。GCG中核分裂像多见,细胞增殖活性较高,GCG中Ki-67的表达指数为10%~30%,肿瘤不同区域的Ki-67指数不一致,高的Ki-67表达指数常集中于肿瘤组织内小瘤细胞及一些未分化梭形瘤细胞区域,相反的,大且肥胖的瘤细胞区域Ki-67增殖指数则相对比较低。表达CD34的瘤细胞较为罕见,有文献表示,如若肿瘤的分化越好,则CD34表达区域会越多[7]。
分子遗传学显示,GCG是罕见的胶质母细胞瘤异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)野生型,均不存在IDH1和IDH2的突变[6],提示GCG可能为原发性胶质母细胞瘤的组织学亚型。50%的GCG病例存在10q杂合性缺失,42%的GCG病例存在19q杂合性缺失,EGFR基因扩增罕见,在19%的GCG中检测到α-地中海贫血/精神发育迟滞综合征X染色体相关基因(A lpha thalassemia mental retardation syndrome X,ATRX)丢失,这些和以前的研究结果表明[6],GCG位于原发性和继发性胶质母细胞瘤之间的杂交位置。
GCG有复杂的组织学形态,因此诊断时需与几种肿瘤鉴别:(1)多形性黄色星形细胞瘤(Pleomorphic xanthoastrocytoma,PXA),两者都是较罕见的星形胶质细胞瘤。虽然具有一定的组织学和免疫组化特征,均由混杂着瘤巨细胞的梭形细胞组成,均表达GFAP,但临床表现及预后不同,PXA常发生于儿童和青少年,好发较浅表部位,多为紧贴脑膜及大脑表面,一般肿块周围无水肿。PXA镜下可见泡沫样瘤细胞,核分裂象无或少,缺乏坏死,Ki-67增殖指数较低,大部分病例预后相对较好。但是仍然有少数病例是难以鉴别两者的,因为它们的组织形态学特征和免疫表型可能不符合典型的GCG和PXA。间变型的PXA形态学常为巨怪瘤细胞和高密度的梭形细胞混杂[8],Kleihue P等[3]认为这一特征可用于在鉴别困难时识别PXA。另外Martinez H等[9]的研究发现,间变型的PXA中神经丝蛋白(Neurofilament protein,NFP)、突触素(Synaptophysin,Syn)、神经元特异核蛋白(Neuronal nuclei,NeuN)的表達可能更广泛。在遗传学研究中,GCG会出现p53突变(75%~90%)及10号染色体缺失的磷酸酶及张力蛋白同源物(Phosphate and tension homology deleted on chromsome ten,PTEN)的突变(33%),而PXA的p53突变率只有5%左右[10],PXA重要遗传学特征为9q的杂合性缺失。还有文献报道[11],O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)启动子甲基化的研究,特别是鼠类肉瘤病毒癌基因同源物B1(V-raf murine sarcoma viral oncogene homolog B1,BRAF)基因V600E突变,代表了在分子基础上维持GCG与PXA分化的可靠工具,研究表明,在50%的PXA中检测到BRAF的V600E突变,而在任何GCG中都没有检测到。(2)胶质肉瘤具有胶质及间叶组织双向分化,与GCG都属于胶质母细胞瘤的一种亚型,约占胶质母细胞瘤的2%。其中的胶质成分往往来自星形细胞瘤或间变型星形细胞瘤,大多数为胶质母细胞瘤,偶尔也可是室管膜瘤或少突胶质细胞瘤,胶质成分也可出现上皮样分化。肉瘤区域通常为梭形细胞密集束状排列,组织形态学似纤维肉瘤,偶尔肉瘤的多形性显著。肉瘤成分也可以出现多向分化,如血管肉瘤、横纹肌肉瘤、恶性纤维组织细胞瘤等[12]。胶质肉瘤的诊断必须为胶质母细胞瘤组织中出现了肿瘤性的间叶组织成分及网状纤维,胶质瘤成分中免疫标记GFAP阳性非常重要[13]。(3)多形性胶质母细胞瘤,肿瘤细胞多形性明显,组织结构变异大,可见凝固性坏死灶,且周围排列典型的“栅栏状”肿瘤细胞,预后较差。(4)软组织肉瘤。因GCG肿瘤细胞异型性较大,依据瘤细胞免疫组化的表型可与一些软组织肉瘤相鉴别,如纤维肉瘤、横纹肌肉瘤等。(5)恶性神经节细胞胶质瘤。因该瘤的胶质成分中可出现数量不等的瘤巨细胞,因此需与GCG鉴别,但恶性神经节细胞胶质瘤显示NF和NSE阳性,GCG瘤细胞GFAP阳性,故免疫标记可以鉴别。
GCG虽属于WHO Ⅳ级的恶性肿瘤,但临床预后可能较普通的胶质母细胞瘤稍好,原因可能是其境界相对清楚、浸润性稍低[14]。Kozak R等[14]曾对16 430例胶质母细胞瘤患者的研究统计显示,GCG中位生存期(11个月)比一般的胶质母细胞瘤中位生存期(8个月)长,其中5年生存率与一般的胶质母细胞瘤生存率分别为10%、3.4%。
GCG的治疗目前仍然为临床手术最大限度切除瘤体,术后尽早联合放化疗,总的治疗原则为采取综合治疗措施,可能提高生存率[16]。已经有研究证实,对于放疗联合替莫唑胺治疗可延长患者生存期[17],另外也需进一步对GCG的分子遗传学进行深入研究,為该瘤的诊断及治疗寻找新的思路。
[参考文献]
[1] Ortega A,Nuno M,Walia S,et al. Treatment and survival of patients Harboring histological variants of glioblastoma[J]. J Clin Neurosci,2014,21(10):1709-1713.
[2] 刘彤华. 诊断病理学[M]. 北京:人民卫生出版社,2006:914-916.
[3] Kleihues P,Cavenne WK. Pathology and genetics of tumors of the nervous system[M]. Lyon:IARC Press,2000:41-43,52-54.
[4] 李文富,曾珍,王亚男,等. 儿童巨细胞型胶质母细胞瘤1例[J]. 中国临床医学影像杂志,2019,30(7):520-521.
[5] Fletcher CDM.肿瘤组织病理诊断[M].济南:山东科学技术出版社,2002:969-971.
[6] Oh JE,Ohta T,Nonoguchi N,et al. Genetic alterations in gliosarcoma and giant cell glionblastoma[J]. Brain Pathol,2016,26(4):517-522.
[7] Reifenberger G,Kaulich K,Wiestler OD,et al. Expression of the CD34 antigen in pleomorphic xanthoastrocytomas[J]. Acta Neuropathol,2003,105(4):358-364
[8] 邵立伟,宋欣,曹晨,等. 多形性黄色瘤型星形细胞瘤20例临床病理分析[J]. 诊断病理学杂志,2019,26(2):86-90,95.
[9] Martinez H,Kleinschmidt BK,Powell SZ,et al. Giant cell glioblastoma and pleomorphic xanthoastrocytoma show different immunohistochemical profiles for neuronal antigens and p53 but share reactivity for class Ⅲ β-tubulin[J].Arch Pathol Lab Med,2003,127(9):1187-1191.
[10] 梅开勇,叶子茵,林汉良,等. 多形性黄色星形细胞瘤临床病理特点及免疫表型分析[J]. 重庆医学,2010,39(18):2424-2426.
[11] Lohkamp Laura-Nanna,Schinz Maren,Gehlhaar Claire,et al. MGMT promoter Methylation and BRAF V600E mutations are helpful markers to discriminate pleomorphic xanthoastrocytoma from giant cell glioblastoma[J]. PloS One,2016,11(6).
[12] 林敏,宋璐,秦书明,等. 胶质肉瘤五例临床病理分析及文献复习[J]. 中华临床医师杂志(电子版),2019,13(6):473-477.
[13] 李静,杨光之. 胶质肉瘤5例临床病理分析[J]. 诊断病理学杂志,2017,24(9):647-650.
[14] Kozak R,Moody JS. Giant cell glioblastoma:A glioblastoma subtype with distinct epidemioloy and superior prognosis[J]. Neuro Oncol,2009,11(6):833-841.
[15] Michael C Jin,Adela Wu,Michael Xiang,et al. Prognostic factors and treatment patterns in the management of giant cell glioblastoma[J]. World Neurosurgery,2019,128:e217-e224.
[16] Kevin R,Kozak,John S,et al. Giant cell glioblastoma:A glioblastoma subtype with distinct epidemiology and superior prognosis[J]. Neuro-oncology,2009,11(6):833-841.
[17] Franceschi E,Tosoni A,Bartolini S,et al. Treatment options for recurrent glioblastoma:Pitfalls and future trends[J].Expert Rev Anticancer Ther,2009,9(5):613.
(收稿日期:2020-02-21)
