番茄内生枝孢霉Wx103对根结线虫毒性的研究
2020-07-04姚玉荣霍建飞郝永娟刘春艳王万立
姚玉荣 霍建飞 郝永娟 刘春艳 王万立


摘要:本研究从番茄根结中分离得到一株根结线虫的内生生防真菌Wx103,经鉴定为Acremonium sclerotigenum。该菌株发酵液对南方根结线虫2龄幼虫具有较强的毒杀活性,发酵液处理24 h后的校正死亡率为90.25%,处理7 d对卵孵化抑制率为41.04%;盆栽试验中孢子液处理线虫防效为68.72%,与3%阿维菌素微囊悬浮剂处理无显著差异。本研究丰富了根结线虫生物防治的微生物资源,可为该菌株的开发利用提供一定的理论基础。
关键词:内生真菌;根结线虫;Wx103;防效
中图分类号:S476.1 文献标识号:A 文章编号:1001-4942(2020)02-0101-05
Abstract A strain of endophytic fungus Wx103 was screened from tomato with high efficacy against root knot nematode and was identified as Acremonium sclerotigenum. Its fermentation solution had stronger lethal activity against the two-instar larva, and the corrected mortality was 90.25% after treated for 24 hours. Furthermore, the Wx103 strain exhibited higher ovicidal efficacy of 41.04% after treated for 7 days. In the pot experiment, the root galls caused by Meloidogyne incognita decreased by 68.72%, which was not significantly different from 3% abamection micro-capsule SC. The finding of the study enriched the microbial resources against root-knot nematode, and provided references for development and utilization of this strain.
Keywords Endophytic fungus; Root-knot nematode; Wx103; Control effect
根結线虫(Meloidogyne spp.)是一类主要侵染植物的病原微生物,也是世界各国对外检疫的重要对象,它给全球农业生产带来了极大危害[1]。自1932年首次报道番茄根结线虫病害发生以来,我国发生省区已超过十个。近年来保护地蔬菜的迅猛发展加速了该病害的发生,致使该病害成为限制保护地蔬菜发展的主要因素,防控形势相当严峻[2]。
植物内生真菌是指生活史的某一阶段或者全部阶段生活在健康植物组织内部,但并不引起宿主植物病害症状的一类真菌[3]。内生真菌能够通过提高寄主植物抗性、改变寄主植物对病虫害的应答反应来提高寄主植物对逆境及病虫害的抵抗。内生真菌防治植物寄生线虫具有明显优势,其存活于植物体内,可避免与土壤微生物竞争,并与寄生线虫处于相似的生态位,能够更充分地发挥作用,从而提高生物防治微生物的靶向性和高效性。 West等[4]研究表明,内生尖孢镰刀菌Fosurium oxysporum能够显著降低南方根结线虫(Meloidogyne incognita)对番茄的侵染率,与对照相比线虫数量减少36.0%~55.9%。根部内生真菌印度梨形孢(Piriformospora indica)不仅能够显著降低大豆胞囊线虫的种群密度,还能提高寄主植物生物和非生物抗性[5]。目前已经报道的防治线虫的内生真菌主要从属于枝孢霉属(Acremonium)[4,6]、毛壳菌属(Chaetomium)[7]、镰刀菌属(Fusarium)[8-10]、黑盘孢属(Melanconium)[11]、青霉菌属(Penicillium)[12]、拟茎点霉属(Phomopsis)[11]等。生产中根结线虫的防治通常采用化学农药防治、生物防治及抗病品种利用等,化学农药主要包括阿维菌素、噻唑膦等。
本研究拟从番茄根结中分离根结线虫生防菌,继而对筛选得到的生防菌株进行形态学和分子生物学鉴定,再分别利用菌株发酵液浸泡和盆栽试验测定其对根结线虫的防治效果,以期为根结线虫病的防治提供新的生防资源。
1 材料与方法
1.1 样品采集
番茄根结样品采集地点为天津市武清区下伍旗温室大棚。该棚种植番茄多年,根结线虫病发病严重。
1.2 真菌菌株Wx103的分离鉴定
采用常规组织分离法。将新鲜的番茄根结清洗干净,用无菌刀片削除根结表皮,0.5%次氯酸钠浸泡30 s,无菌水清洗3次,灭菌纸吸干水分后切成小块,再置于含有0.1 g/L氨苄青霉素的PDA培养基上。之后于培养箱中培养3~4 d,待长出菌丝后进行单孢纯化,并将分离得到的菌株保存备用。其中,一株真菌命名为Wx103。
依据形态学和分子生物学方法分别对菌株 Wx103进行鉴定。参考《中国真菌志》进行形态学鉴定,分子生物学鉴定则采用ITS序列分析。将分离得到的菌株接种到PDA培养基上,置于25℃培养,收集菌丝,后用CTAB法提取总DNA。利用真菌ITS序列通用引物ITS1(ITS1: 5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (ITS4: 5′-TCCTCCGCTTATTGATATGC-3′)[13]进行PCR扩增。扩增体系:2×EsTaq Master Mix(Dye)25 μL,上下游引物各2 μL,DNA模板2 μL,ddH2O 19 μL。扩增程序:94℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 50 s,共35个循环;72℃ 10 min。PCR扩增产物经1.2%琼脂糖凝胶电泳检测后送天津金唯智生物科技有限公司测序。测序结果用BLAST进行同源性分析,并通过MEGA 5.0软件用邻接法构建系统发育树,在分子水平上鉴定菌株种类。
1.3 Wx103发酵液的制备
挑选PDA平板上生长良好的菌落,取直径0.5 cm的菌饼接种于含PDB的三角瓶中,28℃、120 r/min培养5 d得到真菌发酵液,再经5 000 r/min离心15 min,得发酵上清液(以下称发酵原液)。
1.4 南方根结线虫卵及其二龄幼虫J2的制备
南方根结线虫来源于天津市植物保护研究所蔬菜病害室。将感染南方根结线虫的辣椒苗病根洗净,解剖镜下挑取新鲜卵块,用0.5% NaClO表面消毒,清水洗净。一部分卵块经0.5% NaClO振荡解离后,收集游离卵制备卵悬浮液(每毫升卵量约1 000个),另一部分卵在28℃孵化出南方根结线虫二龄幼虫J2。
1.5 Wx103发酵液对根结线虫毒力测定
1.5.1 对根结线虫卵的生物活性 试验设置3个处理,分别为:Wx103发酵原液、阳性对照(3%阿维菌素微囊悬浮液稀释2 000倍)、对照(无菌水)。取100 μL滤液于96孔板的小孔中,每处理加入約100个南方根结线虫卵,重复3次。置25℃孵化,于3、5、7 d统计根结线虫孵化量,计算卵孵化抑制率:
抑制率(%)=(对照线虫孵化量-处理线虫孵化量)/对照线虫孵化量×100 。
1.5.2 对根结线虫二龄幼虫的生物活性 处理设置同1.5.1,采用触杀法进行杀线虫活性测定。取100 μL滤液于96孔板的小孔中,每处理加入约100条南方根结线虫,重复5次,置25℃培养,分别于24、48 h后统计死亡线虫数量(将线虫在清水中恢复2 h,线虫僵直,针刺不动视为死亡),计算校正死亡率:
校正死亡率(%)=(处理死亡率-对照死亡率) /(1-对照死亡率) ×100 。
1.6 Wx103孢子液对根结线虫防效的盆栽鉴定
将菌株Wx103接种于200 mL PDB溶液(含有100 mg/mL氨苄青霉素钠)中,28℃、150 r/min恒温培养3 d后,过滤菌丝,收集孢子,统计孢子浓度并将其调至107 cfu/mL。每千克土加入100 mL菌液,混匀。待番茄幼苗两片真叶完全展开后移栽到拌好孢子液的土壤中,14 d后每株接线虫1 000条,每处理15株,重复3次。接种线虫45 d后清洗番茄根部,根据蔬菜根结线虫分级标准统计根结情况,计算菌株对根结线虫的防效[14]:
防效=(空白对照根结数-处理根结数)/空白对照根结数×100% 。
1.7 数据分析
使用Microsoft Excel 2010软件进行数据统计, SAS 9.1软件进行方差分析。
2 结果与分析
2.1 菌株鉴定
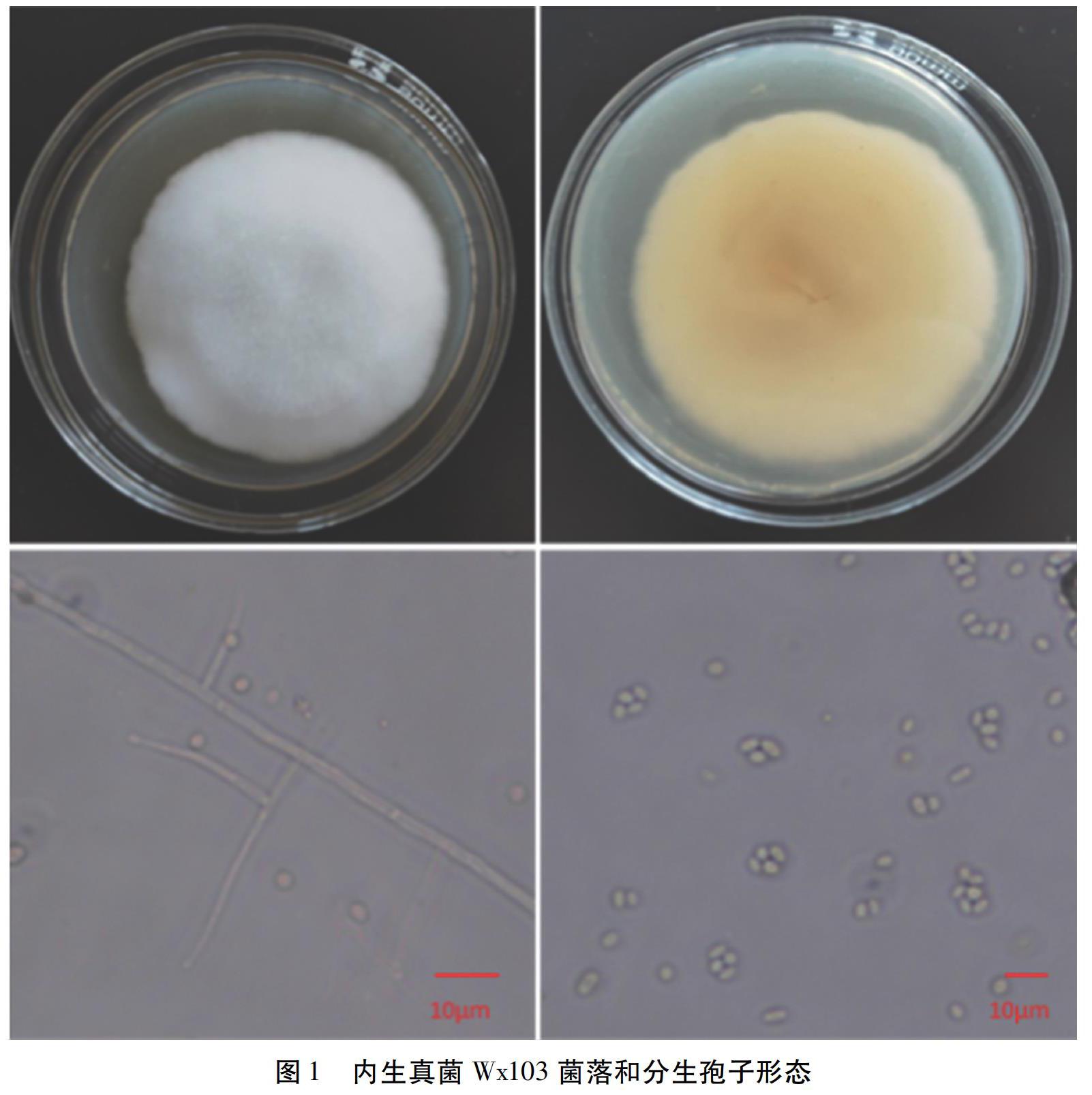
试验用菌株Wx103在PDA培养基上培养5 d后,菌落呈现白色(图1)。
通过对测序结果进行BLAST序列比对发现,分离菌株在进化树上与枝孢霉Acremonium sclerotigenum isolate HB2同源性达到99.8%(图2),结合菌株形态特征,将菌株鉴定为Acremonium sclerotigenum strain Wx103。
2.2 Wx103发酵原液对南方根结线虫卵的生物活性
由图3可以看出,与对照(抑制率为零)相比,发酵原液对南方根结线虫卵囊孵化具有抑制作用。发酵原液处理3 d对南方根结线虫卵囊孵化的抑制率达到70.06%,但显著低于3%阿维菌素微囊悬浮剂处理的抑制率92.09%;处理5、7 d时,发酵液对卵孵化的抑制率分别为57.02%和41.04%,均显著低于同期的3%阿维菌素微囊悬浮剂处理。
2.3 Wx103发酵原液对南方根结线虫二龄幼虫J2的生物活性
由图4可以看出,菌株Wx103发酵原液处理根结线虫J2,其24 h的校正死亡率达到90%以上,与3%阿维菌素微囊悬浮剂处理的致死活性相当。发酵原液稀释2、4、10倍后,杀线虫活性并未显著降低,表明真菌Wx103发酵原液中含有高效杀线虫活性物质。
2.4 Wx103孢子液对根结线虫防效的盆栽试验
由图5可以看出,Wx103孢子液处理的番茄根结平均数量为28.55个,3%阿维菌素微囊悬浮剂处理的为23.71个,对照则高达91.29个。孢子液和3%阿维菌素微囊悬浮剂处理对根结线虫的防效分别为68.72%和74.09%,两者并无显著差异(图6)。观察发现,孢子液处理的番茄根结数量少、根系发达、植株健壮,而对照根结较多、须根少,这表明菌株Wx103不仅能够降低根结线虫的侵染,同时能够促进番茄生长。
3 讨论与结论
大多数内生真菌对根结线虫的影响是通过产生次级代谢产物作用于线虫体内的酶系或代谢反应抑制或者杀死线虫[15]。内生尖孢镰刀菌Fusarium oxysporum FO162发酵液处理线虫60 min后,90%的线虫丧失活力,处理24 h后的线虫死亡率高达100%[8]。Schwarz等[11]报道了内生真菌代谢产生的3-Hydroxypropionic acid物质对南方根结线虫的毒杀活性。Tian等[16]利用从番茄根结上分离的内生真菌交枝顶孢Acremonium implicatum处理南方根结线虫48 h后,线虫死亡率可达96%以上,盆栽试验中该菌株对根结线虫的防效达到66.7%。Kpcke等[17]证实内生子囊菌代谢产生的次级代谢物内酯类化合物对南方根结线虫具有良好的致死活性。
本研究从番茄根结中分离得到一株内生真菌,经鉴定为Acremonium sclerotigenum,其发酵液对南方根结线虫J2具有较强毒性,能够抑制根结线虫卵囊孵化。盆栽试验结果显示该菌株孢子液显著降低了根结数量,对南方根结线虫的防治效果与3%阿维菌素微囊悬浮剂相当。可以推测在菌株孢子液中存在对南方根结线虫具有较强毒性的代谢产物,这种物质多为次级代谢产物。因此,番茄内生真菌Acremonium sclerotigenum strain Wx103对根结线虫具有生防作用,在后续的研究中应深入挖掘发酵液中活性的物质成分,为该菌株生防菌剂的开发提供理论依据。
参 考 文 献:
[1] Abad P, Gouzy J, Aury J M, et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita[J]. Nature Biotechnology, 2008, 26(8):909-915.
[2] 张桂娟, 何立月, 许淑红, 等.大兴区蔬菜根结线虫(Meloidogyne incognita)病的发生特点、防治现状与治理对策[M]//廖金铃,彭德良,段玉玺.中国线虫学研究(第3卷). 北京:中国农业科学技术出版社,2010:157-160.
[3] 田雪亮,郎剑锋,陆宁海,等.一株番茄根结内生真菌对根结线虫的防效鉴定[J].河南科技学院学报(自然科学版),2012,40(2):27-30.
[4] West C P, Izekor E, Oosterhuis D M, et al. The effect of Acremonium coenophialum on the growth and nematode infestation of tall fescue[J]. Plant and Soil, 1988, 112(1): 3-6.
[5] Daneshkhah R, Cabello S, Rozanska E, et al. Piriformospora indica antagonizes cyst nematode infection and development in Arabidopsis roots[J]. Journal of Experimental Botany, 2013, 64(12): 3763-3774.
[6] Elmi A A, West C P, Robbins R T, et al. Endophyte effects on reproduction of a root-knot nematode (Meloidogyne marylandi) and osmotic adjustment in tall fescue[J]. Grass and Forage Science, 2000, 55(2): 166-172.
[7] Hu Y, Zhang W, Zhang P, et al. Nematicidal activity of chaetoglobosin A poduced by Chaetomium globosum NK102 against Meloidogyne incognita[J]. Journal of Agricultural and Food Chemistry, 2013, 61(1): 41-46.
[8] Hallmann J, Sikora R A. Toxicity of fungal endophyte secondary metabolites to plant parasitic nematodes and soil-borne plant pathogenic fungi[J]. European Journal of Plant Pathology, 1996, 102(2): 155-162.
[9] Dababat A E A, Sikora R A. Induced resistance by the mutualistic endophyte, Fusarium oxysporum strain 162, toward Meloidoyne incognita on tomato[J]. Biocontrol Science and Technology, 2007, 17(9):969-975.
[10] Vu T, Sikora R, Hauschild R. Fusarium oxysporum endophytes induced systemic resistance against Radopholus similis on banana[J]. Nematology, 2006, 8:847-852.
[11] Schwarz M, Kpcke B, Weber R W S, et al. 3-Hydroxypropionic acid as a nematicidal principle in endophytic fungi[J]. Phytochemistry, 2004, 65(15): 2239-2245.
[12] 鄭喜, 李国红,王芯, 等. 昆明山海棠内生真菌ThF-11化学成分抗菌杀线虫作用的研究[J]. 中国药理学通报, 2014, 30(12):1709-1713.
[13] Van Nguyen N, Kim Y J, Oh K T, et al. The role of chitinase from Lecanicillium antillanum B-3 in parasitism to root-knot nematode Meloidogyne incognita eggs[J]. Biocontrol Science and Technology, 2007, 17(10): 1047-1058.
[14] Moosavi M R, Zare R, Zamanizadeh H R, et al. Pathogenicity of Pochonia species on eggs of Meloidogyne javanica[J]. Journal of Invertebrate Pathology, 2010, 104(2): 125-133.
[15] Schouten A. Mechanisms involved in nematode control by endophytic fungi[J]. Annu. Rev. Phytopathol., 2016.54:121-142.
[16] Tian X, Yao Y, Chen G, et al. Suppression of Meloidogyne incognita by the endophytic fungus Acremonium implicatum from tomato root galls[J]. International Journal of Pest Management, 2014, 60(4): 239-245.
[17] Kpcke B, Johansson M, Sterner O, et al. Biologically active secondary metabolites from the Ascomycete A111-95.1 production, isolation and biological activities[J]. The Journal of Antibiotics, 2002, 55(1):36-40.
