黄曲霉毒素B1降解菌的筛选与鉴定
2020-07-04刘宝臣齐闯孙英旗
刘宝臣 齐闯 孙英旗

摘要:
黄曲霉毒素B1主要由黄曲霉和寄生曲霉产生,其具有极高的致突变性、毒性和致癌性。黄曲霉毒素污染广泛存在于奶制品、饲料等行业中。本研究以香豆素为碳源,筛选出1株降解率为8277%的黄曲霉毒素B1降解菌,经生理生化试验初步鉴定属于芽孢杆菌属。
关键词:
黄曲霉毒素B1;降解菌;筛选;鉴定
中图分类号:S-3
文献标识码:A
DOI:1019754/jnyyjs20200630006
黄曲霉毒素(Aflatoxin)主要由黄曲霉和寄生曲霉产生,其具有极高的致突变性、毒性和致癌性[1]。在所有黄曲霉毒素中,黄曲霉毒素B1(AFB1)的毒性最强。AFB1具有二呋喃香豆素衍生物一组相关结构,其结构与香豆素十分相似。
黄曲霉毒素污染广泛存在于奶制品、饲料等行业中,玉米饲料原料中的AFB1不仅影响牲畜健康[2],还会在奶牛体内转变为AFM1,从而污染奶制品。2011年12月24日,国家质检总局抽查发现蒙牛乳业(眉山)的盒装鲜奶黄曲霉毒素M1超标达140%[3]。目前去除AFB1的物理方法包括烘烤、吸附剂、紫外线照射、电离辐射等,化学方法主要有碱法、氧化法等[4]。但这些方法存在营养损失、质量下降、设备成本高等缺点,限制了其实际应用效果。利用微生物或其代谢物将AFB1降解和解毒,具有诸多优点。目前已经发现有几种微生物能够将AFB1转化为毒性较小的代谢物,如平菇、花叶菌、根霉、毛霉、酿酒酵母、木霉、乳酸杆菌、丙酸杆菌[5,6],但尚无实际应用报道。
本研究以香豆素为唯一碳源对AFB1降解菌进行初筛,复筛使用HPLC法测定降解菌的AFB1降解率,并进行初步的生理生化鉴定,以期为今后AFB1的降解研究及其在饲料业与奶制品业中的应用奠定基础。
1材料与方法
11材料
111土壤样品
土壤样品取自吉林市猴石山与吉林农业科技学院。
112培养基
种子培养基:NaCl05%、蛋白胨1%、牛肉膏03%,pH70。
初筛培养基:KH2PO40025%、香豆素05%、CaCl201%、NH4NO301%、FeSO401%、MgSO40025%、琼脂15%,pH70。
发酵培养基:蛋白胨1%、牛肉膏03%、葡萄糖02%、KH2PO401%、NaCl0085%,pH70。
NB培养基:蛋白胨1%、酵母膏5%、NaCl1%、琼脂2%、水1000mL,pH70。
113试剂
牛肉膏、蛋白胨、葡萄糖、琼脂、龙胆紫、氯霉素、香豆素等为国产分析纯;AFB1标准品,美国Sigma生产;生理生化鉴定试剂盒,青岛海博生物生产。
12仪器与设备
YM50AI全自动灭菌锅(诸诚市中耀机械有限公司);SW-CJ-1FD超净工作台(苏洁医疗器械(苏州)有限公司);恒温培养箱Termaks series KB8000(常州首创仪器设备有限公司);SC-15A恒温水浴锅(杰瑞安仪器设备有限公司)。
13实验方法
131降解菌初筛
称量1g土样,置于50mL生理盐水中,160r/min、30℃下,摇床培养72h。培养结束后静置20min,吸取1mL上清液用无菌蒸馏水稀释置10-1、10-2、10-3、10-4、10-5倍。稀释后的样品吸取03mL均匀涂布于初筛培养基上,在37℃中培养3~7d后,挑取单菌落于NB培养基平板中培养。
132降解菌复筛
初筛得到的菌株在NB液体培养基中37℃培养1d。以5%接种量接种于发酵培养基,37℃下,培养2d。取980μL发酵液和20μLAFB1标准品(100g/mL)混匀,20μLAFB1标准产品为空白对照,同时设置2组平行实验,37℃,150r/min培养3d后,12000r/min,5min离心,取上清液待测。
133HPLC检测AFB1降解率
AFB1的提取和含量检测方法参照GB 500922—2016。涡流振荡30s,共3次。移取二氯甲烷层,在36℃氮吹仪下干燥后,溶于1mL的乙腈,使用022μm微孔滤膜过滤。
色谱柱为ZORBAX SB-C18柱(150mm×46mm,5μm);流动相为甲醇∶水=1∶1(V∶V),流速09mL/min;柱温30℃,运行时间30min,检测波长为365nm。AFB1的降解率用以下公式进行计算。
AFB1降解率(%)=(1-实验组AFB1含量/对照组AFB1含量)×100%
134形态学鉴定
肉眼观察菌落形态并使用革兰氏染色法[7]进行鉴定。
135生理生化鉴定
使用生理生化鉴定试剂盒分别进行V-P测定试验、明胶液化试验、O/F试验、硝酸盐还原实验、柠檬酸盐利用试验、甲基红试验、硫化氢试验与糖酵解试验[8]。
2结果与分析
21菌种的初筛结果
将香豆素作为唯一碳源的培养基,通过初步筛选,得到10株能够稳定降解的菌株。对采集得到的不同土樣分析得知,其中6株来自于猴石山采取的土样,4株来自于吉林农业科技学院校园里采取的土样。
22菌种的复筛结果
将初筛得到的10株菌株进行复筛,进行降解率测定。如表1所示,有3株降解菌(LQ-HT1、LQ-HT3、LQ-HT4)的降解率达到70%以上,其中1株降解菌(LQ-HT3)的降解率最高为8277%,分析菌种的来源可知,野生环境下的土壤更容易筛选得到降解率较高的菌株。
23AFB1降解菌株的鉴定
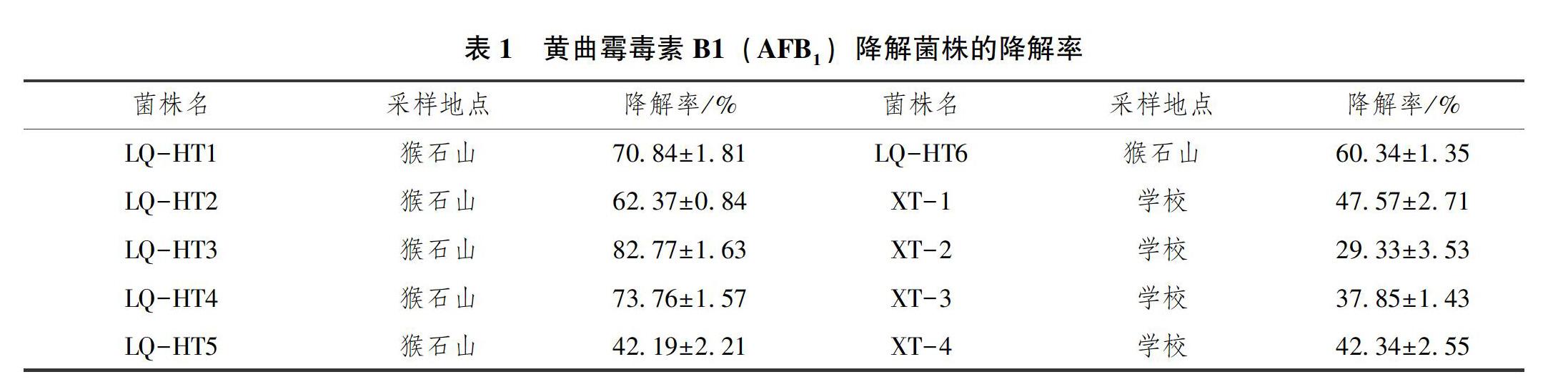
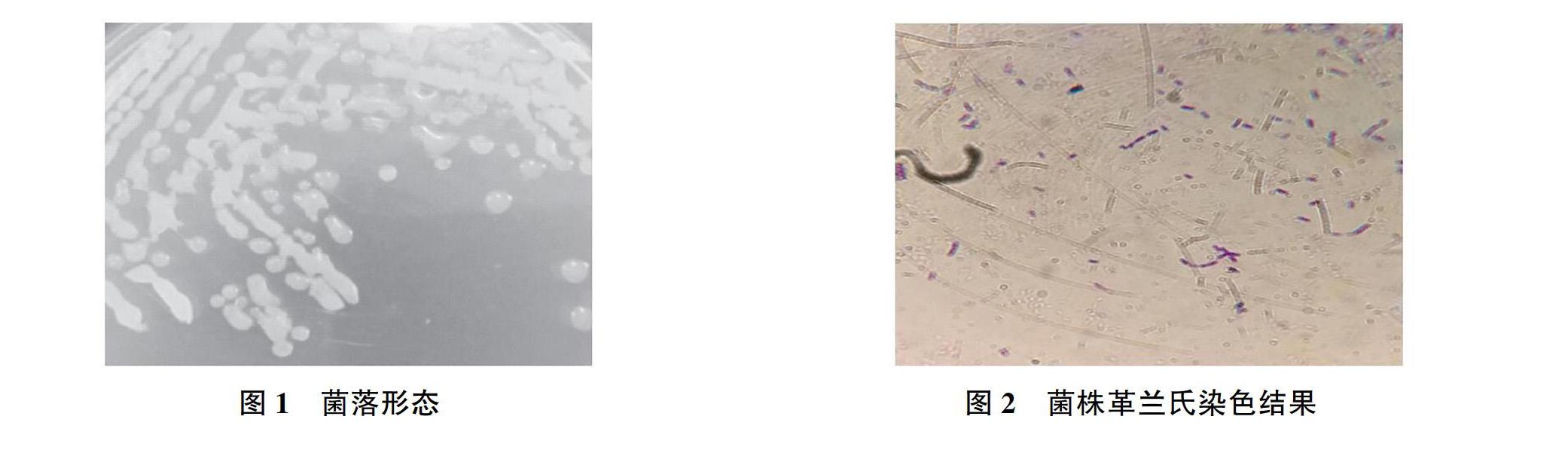
菌落形态如图1所示,该降解菌在LB培养基上的形态呈圆形、潮湿,具有粘性,带有光泽;如图2所示,细胞形态为杆状,有芽孢,革兰氏阳性菌。
24AFB1降解菌的生理生化鉴定
生理生化鉴定试验结果表明,细菌革兰氏染色结果为阳性菌,可以利用柠檬酸和丙酸,符合大多数芽孢杆菌的特征[9],结合其它生理生化指标(表2),判断LQ-HT3属于芽孢杆菌属。
3结论
本研究筛选得到1株可降解AFB1的菌株LQ-HT3,降解率为8277%。形态学与生理生化鉴定试验结果表明其属于芽孢杆菌属。应用本研究成果,可以对AFB1降解菌进行分子生物学鉴定,优化发酵条件,提高其AFB1降解能力,以期早日应用于奶制品与饲料行业中。
参考文献
[1]
Diaz, D.E. The mycotoxin blue book[M]. England:Nottingham University, 2005.
[2] Motomura M , Toyomasu T , Mizuno K , et al. Purification and characterization of an aflatoxin degradation enzyme from Pleurotus ostreatus[J]. International Journal of Food Microbiology, 2003(158):237-242.
[3]郭立場.黄曲霉毒素会不会成为压垮蒙牛的最后一根稻草[J].广西质量监督导报,2012(01):14.
[4] Zjalic S , Reverberi M ,Ricelli A , et al. Trametes versicolor: A possible tool for aflatoxin control[J]. international journal of food microbiology, 2006, 107(03):243-249.
[5] János Varga, Zsanett Péteri, Katalin Tábori, et al. Degradation of ochratoxin A and other mycotoxins by Rhizopus isolates[J]. International Journal of Food Microbiology, 2005, 99(03):321-328.
[6] Molnar O , Schatzmayr G ,Fuchs E , et al. Trichosporon mycotoxinivorans sp. nov. A New Yeast Species Useful in Biological Detoxification of Various Mycotoxins[J]. Systematic & Applied Microbiology, 2004, 27(06):661-671.
[7] Shetty P H , Jespersen L . Saccharomyces cerevisiae and lactic acid bacteria as potential mycotoxin decontaminating agents[J]. Trends in Food Science & Technology, 2005, 17(02):48-55.
[8]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[9]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984.
(责任编辑李媛媛)
