基于Fe3O4-PGA@Au 构建无酶电化学生物传感器检测葡萄糖
2020-07-04关桦楠龚德状韩博林崔琳琳
关桦楠,龚德状,宋 岩,刘 博,韩博林,杨 帆,崔琳琳,张 娜
(哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
目前,用于葡萄糖检测的电化学生物传感器多依赖于其核心元件葡萄糖氧化酶的活性[1-3]。葡萄糖氧化酶为天然蛋白质酶,可特异性催化底物葡萄糖产生葡萄糖酸和过氧化氢。通过测定催化反应过程中电子迁移所产生的电信号构建葡萄糖检测的电化学生物传感器[1]。但是葡萄糖氧化酶成本较高,稳定性较差且固载技术复杂,使得此类型的生物传感器应用时受到一定的限制[4]。
近年来,伴随着纳米模拟酶研究的发展,模拟酶已成为催化领域的研究热点[5-8]。相比于天然酶,纳米模拟酶具有成本低、稳定性高、可循环使用和催化活性强等诸多优点。在新兴的葡萄糖氧化酶纳米模拟酶中,金属硫化物(MoS2)[9]、金属氧化物(Co3O4、V2O5、CeO2和Mn3O4)[5]、碳纳米材料(石墨烯、富勒烯和碳纳米管)[7]、磁性粒子(Fe3O4)[10-12]和贵金属粒子(Au、Ag和Pt)[12-14]吸引了诸多学者的关注;其中,磁性纳米材料以其易回收和可循环利用的特点与具有良好催化活性的贵金属纳米材料相结合,已成为该领域的研究热点[12-15]。
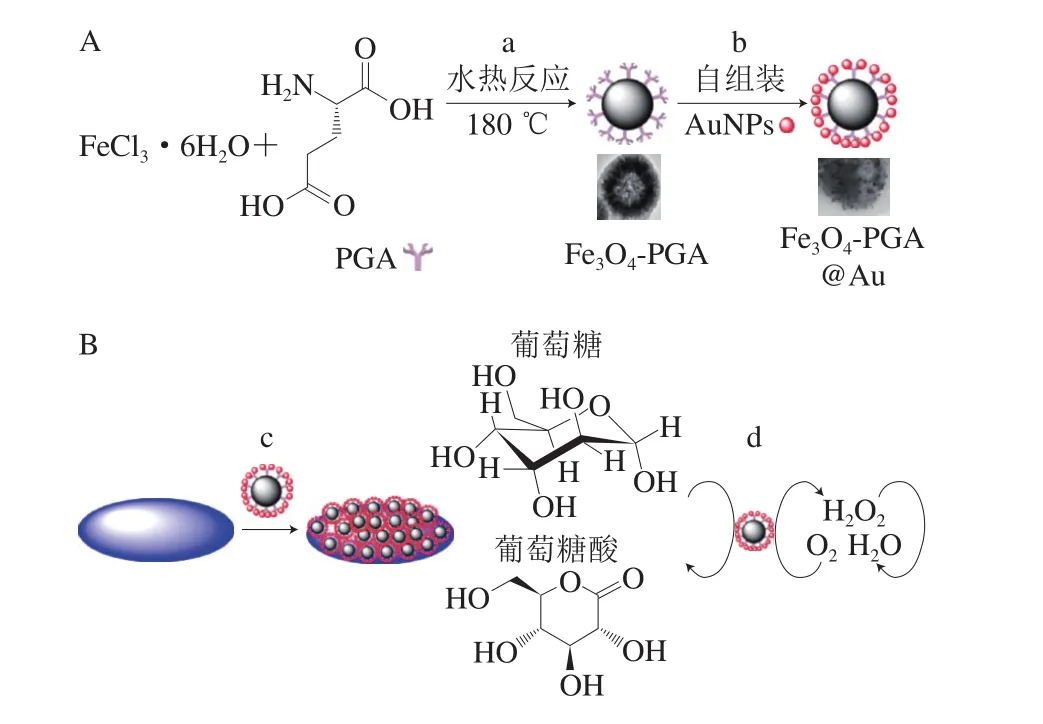
图1 Fe3O4-PGA@Au 纳米材料的制备过程(A)和电极修饰及检测葡萄糖原理示意图(B)Fig. 1 Schematic illustration of Fe3O4-PGA@Au nanocomposite fabrication process (A), electrode modi fication and electrooxidation of glucose (B)
本研究中,采用聚谷氨酸(poly-(γ-glutamic acid),PGA)作为还原剂和交联剂,一步法自组装制备具有核壳结构的新型金磁微粒(Fe3O4-PGA@Au),具体过程如下:采用天然PGA绿色还原法制备Fe3O4-PGA微粒(图1A-a),利用柑橘提取液绿色制备金纳米粒子,并通过自组装技术制备Fe3O4-PGA@Au纳米粒子(图1A-b)。PGA是一种水溶性多聚氨基酸,其结构为谷氨酸单元通过α-氨基和γ-羧基形成肽键的高分子聚合物,具有很强的生物相容性[16-18]。通过PGA的交联作用,此粒子结合了磁性粒子和贵金属纳米粒子的优势,具有良好的模拟酶催化活性、高稳定性和易回收的特点,可催化底物葡萄糖发生氧化还原反应。采用新型金磁微粒修饰玻碳电极,构建了葡萄糖检测的无酶型电化学生物传感器(图1B-c),所获得的传感器针对葡萄糖表现出良好的电催化性能,在催化葡萄糖生成葡萄糖酸和过氧化氢的过程中形成明显的电化学氧化峰(图1B-d)。该类型无酶传感器表现出良好的灵敏度,具有潜在的应用价值。本研究结果将为食品、药品和环境成分检测与分析技术的改良提供新的思路。
1 材料与方法
1.1 材料与试剂
六水氯化铁、三水乙酸钠、PEG-4000、葡萄糖天津市科密欧化学试剂有限公司;PGA、氯金酸 美国Sigma公司;葡萄糖检测试剂盒 上海市德赛诊断系统有限公司;实验中所用试剂均为分析纯。
1.2 仪器与设备
MAGNA-IR560E.S.P傅里叶变换红外光谱仪 美国ULVCA-PHI公司;BT-9300H激光粒度分布仪 美国惠普公司;9600振动磁强计 美国LDJ Electronics公司;CHI660E电化学工作站 上海辰华仪器有限公司;R-201旋转蒸发仪 中国上海申顺生物科技有限公司。
1.3 方法
1.3.1 Fe3O4-PGA@Au的制备与表征
金纳米粒子的制备参考本课题组前期工作[19],采用橘皮提取液快速合成。Fe3O4-PGA微粒采用一步绿色水热还原法制备,具体流程如下:称量0.8 g的FeCl3·6H2O粉末和0.1 g的PGA粉末,分散于60 mL的去离子水中,磁力搅拌30 min;将整个体系移至水热反应釜中,在180 ℃条件下反应6 h;将反应得到的黑色悬浮液分别用乙醇和去离子水清洗2 次,70 ℃条件下真空干燥5 h,获得的黑色粉末即为Fe3O4-PGA。采用去离子水配制Fe3O4-PGA粒子悬浮溶液(100 mg/mL),向20 mL悬浮溶液中加入20 mL金纳米粒子溶胶,涡旋振荡2 min;用磁铁在侧壁吸附固定体系中的固体,弃去上清液,采用去离子水清洗固体2 次,冷冻干燥,即获得Fe3O4-PGA@Au;4 ℃保存,备用。采用振动磁强计测定Fe3O4-PGA@Au的磁学性质,采用X射线衍射图谱和傅里叶变换红外光谱对合成的复合微粒结构进行分析。
1.3.2 无酶葡萄糖生物传感器的构建
采用金相砂纸抛光玻碳电极(GCE,直径3 mm),在去离子水中超声清洗20 min,然后将电极置于强酸混合液(硝酸-盐酸-水(1∶3∶4,V/V))中浸泡10 min,再在去离子水中超声清洗20 min。将预处理后的玻碳电极浸置于Fe3O4-PGA@Au悬浮溶液(100 mg/mL)中,静置2 min(恒电位为3.0 V),使玻碳电极表面吸附有带有负电荷的金磁微粒,再用去离子水柔和清洗玻碳电极,用以去除游离的杂质;将吹干后的电极再次浸置于Fe3O4-PGA@Au悬浮溶液(100 mg/mL)中,静置2 min,此为Fe3O4-PGA@Au-GCE无酶型电化学生物传感器,室温静置备用。
1.3.3 无酶生物传感器检测葡萄糖条件的优化
电化学测定在CHI660e型电化学工作站上进行,采用三电极体系:铂电极为对电极,Ag/AgCl电极为参比电极,修饰的玻碳电极为工作电极。利用循环伏安(cyclic voltammetry,CV)法测定无酶生物传感器检测葡萄糖时氧化峰电流,通过峰电流强度评估并优化检测体系的参数。分别考察检测温度、检测时间、检测pH值和扫描速率对检测体系的影响。将1 mL葡萄糖标准液加入到15 mL Na2HPO4-NaH2PO4缓冲溶液(0.2 mol/L,pH 7.2)中,将Fe3O4-PGA@Au-GCE浸入反应体系中,采用NaOH调节体系pH值为7.2~8.2,维持总体积16 mL,葡萄糖浓度为0.01 mmol/L,在不同水浴温度条件下(30~55 ℃)孵育不同的时间间隔(5~30 min),设置不同的扫描速率(20~70 mV/s),根据结果筛选最佳检测参数。
1.3.4 葡萄糖的检测
使体系中葡萄糖浓度分别为0、0.1、1.0、5.0、10.0、50.0 μmol/L和100.0 μmol/L,采用Fe3O4-PGA@Au-GCE,根据优化后的体系参数,利用CV法检测不同浓度葡萄糖的峰电流强度,观察CV曲线变化。将峰电流强度换算为峰电流密度(即玻碳电极表面有效单位面积的电流强度(Id,μA/cm2),以峰电流密度为纵坐标、葡萄糖浓度(C,μmol/L)为横坐标构建工作曲线,其中葡萄糖浓度分别设置为0.10、0.25、0.50、1.00、2.50、5.00、10.00、25.00、50.00、100.00、250.00、500.00 μmol/L和1 000.00 μmol/L;选择食品中常见的糖类作为参照(0.1 mmol/L,高于对照样品中葡萄糖浓度10 倍),评估葡萄糖(0.01 mmol/L)检测体系的抗干扰性能;测定葡萄糖0.01 mmol/L和0.1 mmol/L两个标准溶液浓度,重复实验5 次,采用所构建的工作曲线确定该体系的回收率和相对标准偏差。
1.3.5 实际样品的检测
选择常见水果(红富士苹果和脐橙)作为实际样品模型,并对样品进行必要的前处理。将水果样品分别去皮去籽后,充分粉碎搅拌至糊状;再取该糊状样品1 g加入到20 mL锥形瓶中,并加入双蒸水10 mL,超声振荡15 min后,离心去沉淀,将上清液用的微孔滤膜过滤(0.45 μm)一次;采用葡萄糖检测试剂盒测定初始葡萄糖浓度;再向样品上清液中添加不同浓度的葡萄糖标准液(0.1、0.5、1.0 mmol/L),采用Fe3O4-PGA@Au-GCE无酶传感器测定其电化学行为,重复实验5 次。基于所构建的工作曲线计算实际样品体系中的葡萄糖终浓度,考察检测体系对实际样品的加标回收率和相对标准偏差。
1.4 数据处理
利用Origin 8.0软件处理数据并作图,采用DPS 7.05软件对数据进行统计分析。
2 结果与分析
2.1 Fe3O4-PGA@Au的表征
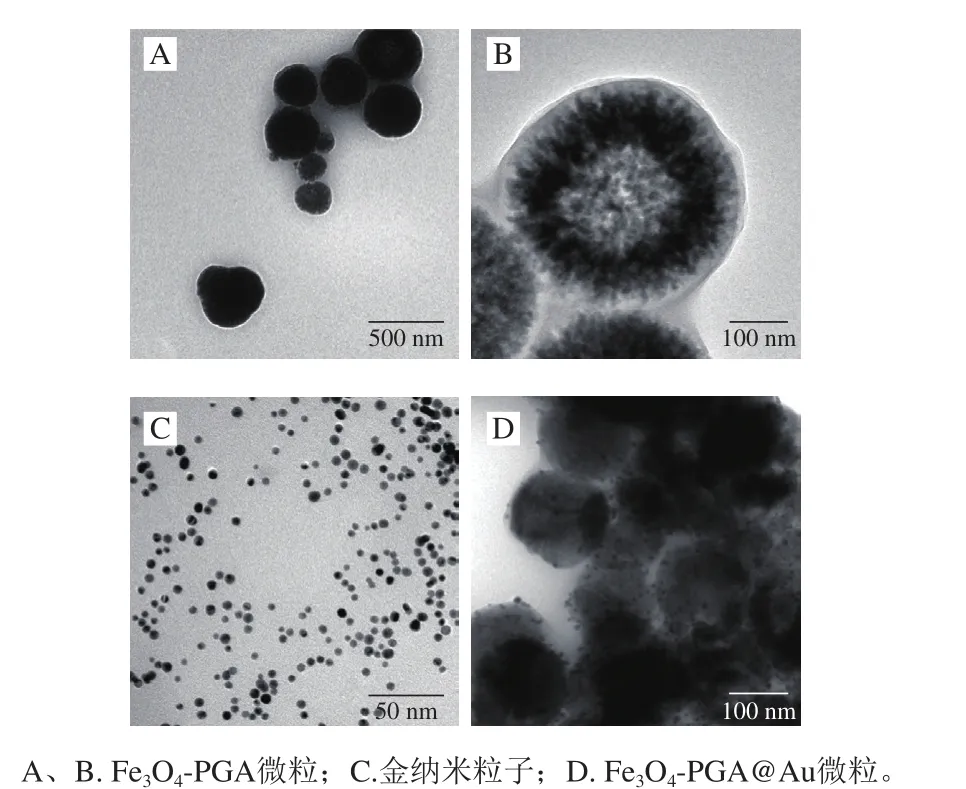
图2 纳米粒子的透射电子显微镜图片Fig. 2 TEM images of Fe3O4-PGA nanoparticles (A and B), gold nanoparticles (AuNPs) (C) and Fe3O4-PGA@Au nanoparticles (D)
由图2A、B可知,制备的Fe3O4-PGA粒子平均粒径约为290 nm,呈现近似圆球形的颗粒;在黑色的Fe3O4核心外壁包覆有一层透明薄膜,厚度约为10 nm,初步判断为PGA层。金纳米粒子的透射电子显微镜图见图2C,金纳米粒子粒径约为4 nm,多由圆球型和圆棒型粒子组成。由图2D可知,在Fe3O4-PGA粒子透明层表面吸附有大量的金纳米粒子。Fe3O4-PGA@Au微粒的X射线衍射、傅里叶变换红外光谱和磁学性质进行表征。
从图3A可知,基于JCPDS 19-0629卡,衍射峰(111)和(311)对应Au;衍射峰(220)、(311)、(400)、(511)、(422)和(440)对应Fe3O4,说明Fe3O4-PGA@Au微粒中含有Au和Fe3O4。其中,(111)和(311)对应的衍射峰2θ为38.56°和77.58°[20-22]。Fe3O4衍射峰所对应的2θ为30.17°、35.54°、43.27°、53.62°、57.11°和62.85°,表明微粒中的Fe3O4为立方反尖晶石结构,具备良好的电磁性能[23]。
Fe3O4-PGA和Fe3O4-PGA@Au的傅里叶变换红外光谱图谱见图3B,Fe3O4-PGA和Fe3O4-PGA@Au两种微粒在578 cm-1处都出现Fe—O振动的吸收峰;同时,在1 610、1 659 cm-1和2 938 cm-1处都出现吸收峰,分别对应C=C、C=O和C—H键,这几个化学键都来自于PGA的制备和修饰[16,24]。此外,Fe3O4-PGA在3 457 cm-1处具有明显的吸收峰,对应氨基基团中的N—H,PGA作为一种天然的多聚氨基酸具有丰富的氨基基团[25];而Fe3O4-PGA@Au中3 457 cm-1所对应的N—H峰强度变弱,说明金纳米粒子已通过氨基与Fe3O4-PGA充分吸附[25]。Fe3O4-PGA和Fe3O4-PGA@Au的磁学性质分析结果表明,两种纳米粒子饱和磁化值分别为62.7 emu/g和42.3 emu/g,说明金纳米粒子的吸附弱化了磁核的磁性。
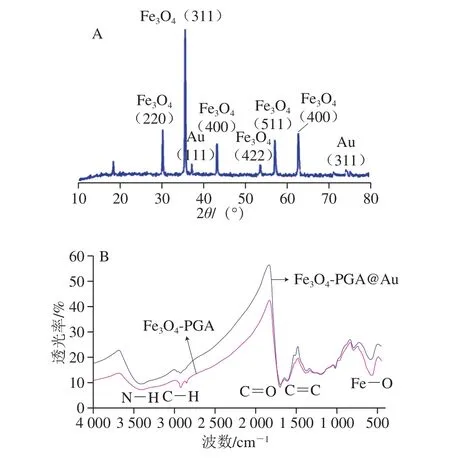
图3 Fe3O4-PGA@Au X射线衍射(A)和傅里叶红外光谱(B)图Fig. 3 X-ray diffraction pattern (A) and Fourier transform infrared spectrum (B) of Fe3O4-PGA@Au nanoparticles
2.2 Fe3O4-PGA@Au-GCE检测体系的参数优化
由图4A可知,峰电流强度随扫描速率逐渐增大,当扫描速率超过50 mV/s后,峰电流强度逐渐下降,可能是较高的扫描速率时,修饰电极出现极化现象,形成暂态,影响了峰电流强度[26]。
从图4B可知,检测时间为15 min时,峰电流强度最高。此催化反应的产物中含有过氧化氢,其自身可以水解产生微弱电流;长时间催化所积累的过氧化氢会干扰电极对葡萄糖的识别性能,进而造成峰电流强度的下降。检测葡萄糖的模拟酶的催化反应需要在弱碱环境中完成;且当体系中出现OH-时,葡萄糖分子易聚集于电极附近,降低葡萄糖氧化的活化能,使其更容易被氧化,因此设置pH值范围为7.2~8.2[27]。从图4C可见,当检测体系的pH值为7.8时,峰电流强度最高;当pH值继续升高,反应受到抑制,峰电流强度开始下降。从图4D可知,最适反应温度为40 ℃,当温度继续提升,峰电流强度开始下降,原因可能是温度过高会造成电极表面金磁微粒的基底效应,引致修饰层的剥离,影响了峰电流强度[28]。综上,选择最佳检测条件为扫描速率50 mV/s、检测时间15 min、pH 7.8和反应温度40 ℃。
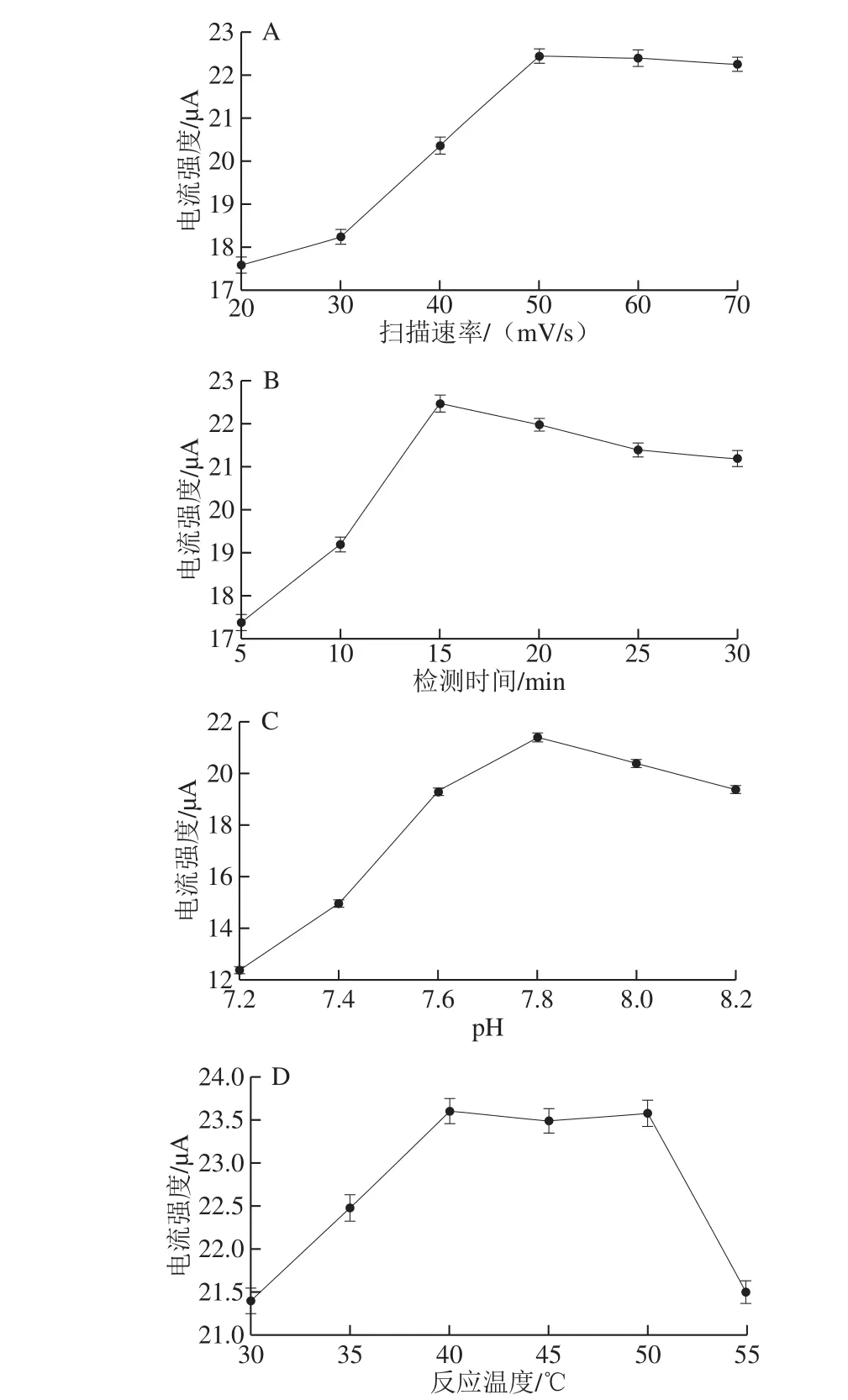
图4 扫描速率(A)、检测时间(B)、体系pH值(C)和反应温度(D)对Fe3O4-PGA@Au-GCE无酶传感器检测葡萄糖的影响Fig. 4 Effect of scan rate (A), detection time (B), pH value (C) and reaction temperature (D) on detection of glucose using Fe3O4-PGA@Au-GCE non-enzymatic sensor
2.3 Fe3O4-PGA@Au-GCE检测葡萄糖体系的构建
基于优化后的检测体系,采用CV法评估葡萄糖无酶检测体系的电化学响应性能,并构建葡萄糖检测的工作曲线。由图5可知,当体系中没有葡萄糖时,CV曲线没有出现明显的氧化峰和还原峰;当体系中加入葡萄糖(0.1 μmol/L)时,在0.15 V处出现氧化峰,说明电极表面的金磁微粒可以替代葡萄糖氧化酶催化氧化葡萄糖水解产生葡萄糖酸和过氧化氢,该过程形成电信号,出现氧化峰;当体系中葡萄糖的浓度逐渐增大,氧化峰的电流强度也逐渐提高[29-30],葡萄糖浓度为100 μmol/L时,峰电流强度达到最大值-27.3 μA。由图5可知,葡萄糖浓度C与峰电流密度Id在两段浓度范围内存在良好的线性关系,与其他的研究类似[12,29]。在葡萄糖浓度范围为0.1~5.0 μmol/L时,峰电流密度回归方程为Id=2.95C+57.37,R2=0.978 5;在10~250 μmol/L时,峰电流密度回归方程为Id=0.118 9C+81.61,R2=0.984 5,检出限为0.74 μmol/L(RSN=3)。结果表明,回收率在96%~107%之间,相对标准偏差在3%~5%之间,符合检测要求(12%以下)[30]。采用Fe3O4-PGA@Au-GCE所构建的无酶葡萄糖检测传感器具有较高的灵敏度和重复性。
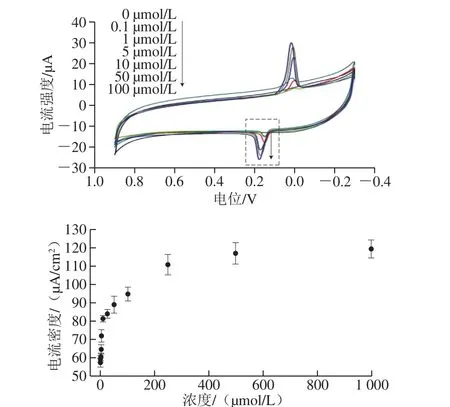
图5 修饰电极对不同浓度葡萄糖的响应Fig. 5 Response of Fe3O4-PGA@Au-GCE to different concentrations of glucose
选择4 种常见糖类作为干扰物质评估无酶葡萄糖检测生物传感Fe3O4-PGA@Au-GCE器的检测特异性。由图6可知,浓度皆为0.1 mmol/L的乳糖、麦芽糖、果糖和蔗糖氧化峰的峰电流强度均在5 μA以下,与此同时,0.01 mmol/L的葡萄糖峰电流强度超过20 μA,说明该生物传感器具有选择性检测葡萄糖的性能。
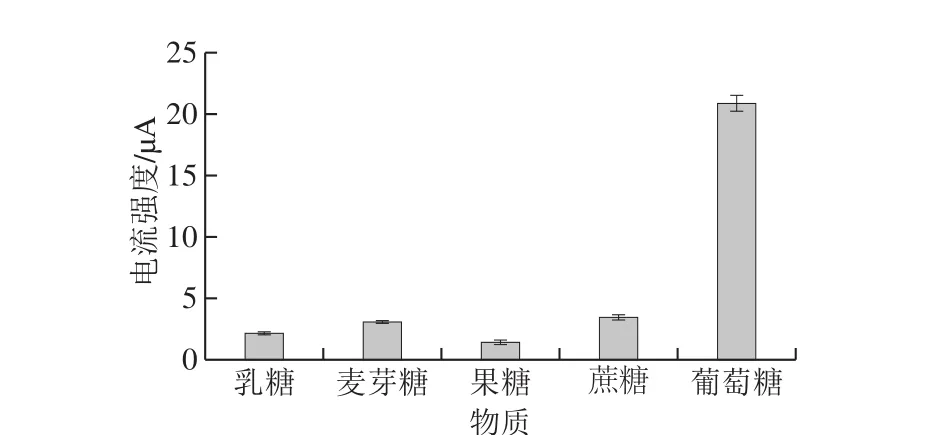
图6 Fe3O4-PGA@Au-GCE选择性检测葡萄糖Fig. 6 Selectivity of Fe3O4-PGA@Au-GCE toward glucose versus other tested sugar
2.4 实际样品的检测结果
本实验所构建的Fe3O4-PGA@Au-GCE无酶型葡萄糖生传感器在检测纯水中葡萄糖的过程中表现出了良好的性能,为拓宽其应用范围,需考察传感器在实际样品检测中的相关表现。向不同种类的纯果汁中的添加不同浓度的葡萄糖标准液,再利用所制备的无酶传感器进行测定,根据葡萄糖工作曲线获得葡萄糖浓度,结果见表1。在苹果汁和柑橘汁中,无酶传感器检测实际样品中葡萄糖回收率为99%~101%,且组内相对标准偏差为7.3%,说明此类型无酶传感器在实际样品检测中,具有良好精密度和重复性。
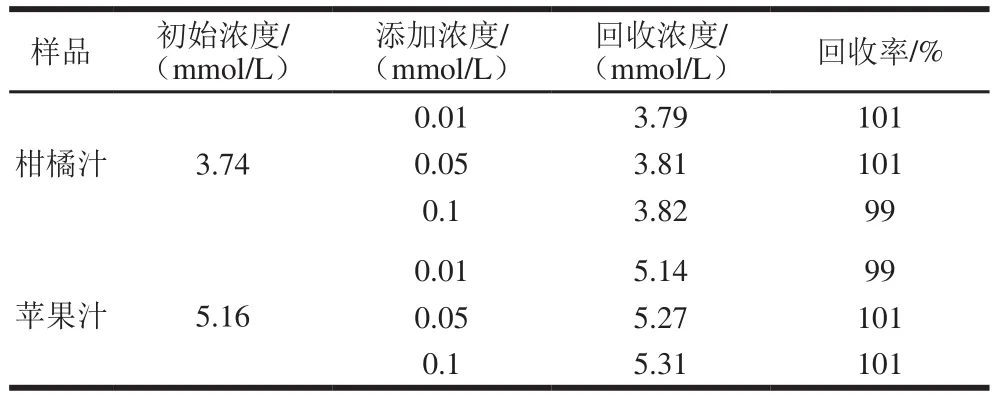
表1 实际样品中葡萄糖含量的分析Table 1 Analytical results of glucose contents in real samples
3 结 论
本研究采用天然PGA绿色制备Fe3O4-PGA@Au,并利用金磁微粒优良的模拟酶催化性能替代葡萄糖氧化酶构建无酶型葡萄糖检测生物传感器。该粒子良好的分散性和催化活性,使修饰的电极检在测葡萄糖的过程中呈现出较好的灵敏度和重复性。目前该粒子已被诸多研究成果证实具有多种天然酶的模拟酶性质,可将其拓展于其他酶生物传感器的构建研究。此类无酶型生物传感器可以克服复杂的环境刺激,用于极限条件下各类成分的分析,将为人体样品、食品、药品和环境组分检测技术的改良提供基础资料。
