膀胱癌自噬基因筛选及患者预后风险模型的构建
2020-07-04李晨晨肖芝松通讯作者
李晨晨 肖芝松(通讯作者)
(大理大学 云南 大理 671000)
细胞自噬是指在内源性自噬相关基因(autophagy related gene,Atg)的严格调控下的细胞自我代谢过程也是人体防止正常细胞损伤的机制,若自噬机制异常就会引起细胞损伤。有研究发现,在肿瘤早期,自噬能够保护肿瘤细胞躲避自体免疫应答,促进肿瘤细胞存活;而过度的自噬又会促进肿瘤细胞凋亡,进而发挥抗肿瘤机制[1]。
膀胱癌是泌尿系统中最常见的恶性肿瘤之一,全球范围内每年新增的膀胱癌患者超过33 万例,死亡病例多于3 万例[2]。在我国泌尿生殖系肿瘤中,膀胱癌也是发病率和病死率最高的泌尿生殖系统肿瘤,而且中国膀胱癌的发病率也在呈逐年增长的趋势[3]。若能进一步明确膀胱癌的独立预后因子,对患者的诊断、治疗方式和改善患者生活质量、总体生存率都会起到至关重要的作用。
1.资料与方法
1.1 数据资料的选取
下载癌症基因组图谱(The CancerGenome Atlas,TCGA)数据库数据库中人膀胱癌的RNA-Seq 数据和412 例膀胱癌患者临床信息。RNA-Seq 数据中包括19 例正常膀胱样本和414 例膀胱癌样本的测序数据。通过R 软件对所下载数据进行整理。通过HADB(http://www.autophagy.lu/)获得人自噬相关mRNAs数据。
1.2 差异基因的筛选
整理TCGA 数据库膀胱癌RNAs 表达情况并从其中提取人自噬相关基因的表达数据,通过R 软件对膀胱癌正常样本和癌症样本进行分析(用limma 包对自噬基因表达数据进行归一化处理并采用wilcox.t 检验进行差异表达)。采用错误发现率(FDR)对自噬mRNAs 的As 的差异表达的显著性进行校正(标准设定为:①P及FDR <0.05;②∣logFCfilter (FC)∣>1)。共筛选出38 个显著差异表达自噬基因。
1.3 单因素和多因素cox 回归分析
通过排除2 例生存信息不完整和4 例RNA 测序数据缺失的膀胱癌患者资料,将406 例患者的对应的自噬基因测序数据和生存数据进行合并。利用R 语言survival 程序包进行单因素cox分析,并把得到的与膀胱癌预后显著相关的自噬基因(P<0.05)纳入多因素cox 分析来进一步验证这些基因对膀胱癌患者预后的价值。经过上述分析,建立评估膀胱癌患者预后风险模型 风险值(R iskScore)=expmRNA1×βmRNA1+expmRNA2×βmRNA2+ …… +expmRNAn×βmRNAn(exp:为表达水平;β 为多因素cox 回归分析的回归系数)。
1.4 划分高低风险组膀胱癌患者并绘制ROC 曲线
通过构建的膀胱癌患者预后cox 模型来计算406 个膀胱癌患者的风险值。以中位值将患者分为高、低风险两组并进行Kaplan-Meier 生存曲线绘制。使用R 软件survival、survminer包来绘制ROC 曲线来判断预后模型预测患者五年生存率的准确概率。
2.结果
2.1 差异自噬基因的筛选
通过R 软件整理TCGA 数据库中433 个样本(正常样本19 例、肿瘤样本414 例)的基因测序数据并提取其中232 个自噬基因(通过HADB(http://www.autophagy.lu/)获得)的表达数据,通过R 软件利用wilcox.t 检验进行差异表达分析,发现232 个基因中有38 个自噬基因显著差异表达。
2.2 单因素和多因素cox 回归分析
为了初步筛选与膀胱癌预后相关的自噬基因,首先通过R软件的“survival 程序包”对差异表达的38 个自噬mRNAs 进行单因素Cox 回归分析,P<0.05 认为差异有统计学意义,结果一共发现有7 个自噬基因与患者预后显著相关(P<0.05),通过R 软件绘制差异有统计学意义的森林图(图1)进行展示。接下来通过多因素cox 分析进行进一步筛选,发现5 个自噬基因APOL1、ITGA3、P4HB、MYC、DIRAS3 具有预测患者预后的功能,预后风险模型为:风险值=(APOL1×-0.14398468)+(ITGA3×-0.10405556)+(P4HB×0.68837742)+(MYC×0.20125767)+(DIRAS3×0.32094798)。其中APOL1 和ITGA3 自噬基因的多因素cox 回归系数均小于0,提示这2 个自噬基因高表达患者的预后较低表达的患者较好。P4HB、MYC、DIRAS3 自噬 基因的多因素cox 回归系数均大于0,提示这3 个自噬基因低表达患者的预后会优于高表达的患者。

图表 1
2.3 膀胱癌患者高低风险组的划分及ROC 曲线的绘制
为了评估预后模型的预测能力,首先对高风险组和低风险组进行K-M 生存分析,通过风险预后模型来计算406 例患者的风险值并以中位值将患者分为高、低风险两组。K-M 生存曲线(图2)显示高风险组(五年生存率约为32.2%)和低风险组(五年生存率55.5%)患者生存率之间存在显著差异(P<0.001)。ROC 曲线(图3)下面积为0.757,确认了模型预测膀胱癌患者预后的准确性。
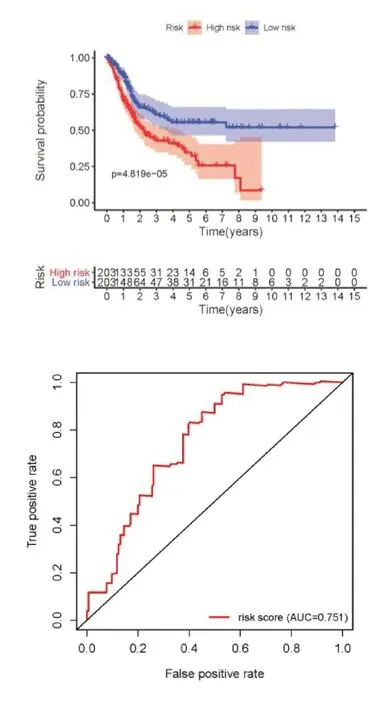
图表 3
3.讨论
膀胱癌是泌尿系统常见的恶性肿瘤之一。目前膀胱癌的诊断金标准为:膀胱镜下膀胱黏膜活检和尿脱落细胞学检查,由于这些方法被各自的局限性所限制,所以寻找一种早期无创性的诊断方式就极为重要。
自噬在肿瘤发生的初始阶段主要起抑制肿瘤发生的作用,在晚期则主要促进肿瘤的发展[4]。本文对膀胱癌中异常表达的自噬基因进行探索,筛选出与患者总体生存预后显著相关的核心自噬基因,从基因表达层面预测膀胱癌患者预后风险。我们筛选出38 个自噬相关mRNAs 并对这些自噬mRNAs进行单因素cox 回归分析,筛选出与膀胱癌患者预后显著相关的自噬7 个mRNAs 之后,对这7 个基因进行多因素cox回归分析,最终选出5 个膀胱癌的独立预后因子:APOL1、ITGA3、P4HB、MYC、DIRAS3。基于这5 个自噬mRNAs 来构建预后模型。预后风险模型为:风险值=(APOL1×-0.14398468)+(ITGA3×-0.10405556)+(P4HB×0.68837742)+(MYC×0.20125767)+(DIRA S3×0.32094798)。其 中APOL1 和ITGA3 的多因素cox 回归系数均小于0,提示这2个自噬基因高表达患者的预后优于低表达的患者,P4H B、MYC、DIRAS3 的多因素cox 回归系数均大于0,提示这3 个自噬基因低表达患者的预后优于高表达的患者。利用模型对406 例膀胱癌患者进行风险值的评分并根据风险值中位值将患者划分为高风险组和低风险组,Kaplan-Meier 生存分析证明高风险组膀胱癌患者的总体生存率显著低于低风险组患者(P<0.001)。ROC 曲线验证了模型判断膀胱癌患者风险值的可靠性。通过预测膀胱癌患者的预后风险值,可以为膀胱癌患者进行个性化治疗提供参考,从而降低患者病死率,改善患者预后。
本研究的不足之处在于所有数据均来TCGA 数据库提供的膀胱癌mR NAs 测序数据,无法完全代表其蛋白水平表达的情况。后续可以通过选取临床样本来验证这个5 个自噬基因在预测患者预后风险方面的价值。
综上,本研究通过对膀胱癌患者的基因表达谱及其临床信息进行综合分析,发现了5 个最有可能具有预测患者生存预后功能的独立因素并构建预后风险预测模型,对膀胱癌患者的诊断和治疗和改善预后提供了参考依据。
