鲜食水稻籽粒成熟过程中多糖组成及抗氧化活性分析
2020-07-03李洪亮张东杰
李洪亮 李 丹 张 超 张东杰
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
水稻中含有丰富的营养物质,主要包括淀粉、蛋白质、纤维素、脂类物质等[1]。鲜食水稻指在乳熟期至成熟期之间收获、利用的水稻,此时水稻籽粒营养素含量与活性最佳,这时采收可以提升水稻的利用价值[3]。
2013年,中国的行业专家创造性地提出了基于“全谷物”的“鲜食全谷物”的新概念。“鲜食全谷物”是通过对谷物整粒加工进行彻底和即时的冷冻,不需经过破碎、研磨等加工处理,可极大程度保留稻谷天然营养物质和功能成分。但中国开发鲜食全谷物新产品发展进程缓慢,仅局限于传统意义上的鲜食产品例如玉米和豆类。目前有关于水稻鲜食的报道还很少。
近几年各类谷物多糖功效被报道,玉米多糖具有减肥降脂,降血糖,提升免疫力,抗衰老作用等功效[3-4];大豆多糖对自由基有明显的清除效果,具有抗肿瘤作用,并可以调节血糖、血脂、改善肠道活性、促进营养元素吸收等[5-6];大麦多糖具有降血糖活性,对羟基自由基有良好的清除效果[7]。与稻米有关的多糖研究表明,糙米发芽后多糖、米糠多糖均具有较好的抗氧化活性[8-9];水稻灌浆后16~24 d所含生物活性物质最为丰富[10],但其中发挥重要作用的组分有待深入研究。试验拟以不同成熟时期的鲜食水稻籽粒为原料,探索鲜食水稻籽粒中多糖的单糖组成与抗氧化能力,为鲜食水稻的加工利用提供参考,并为开发新型水稻产品提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
鲜食水稻:型号龙粳-31,分别采集乳熟(前、中、后)期、蜡熟期与完熟期的水稻样品,采收地点为黑龙江省鹤岗宝泉岭名山农场;
无水乙醇、苯酚:分析纯,辽宁泉瑞试剂有限公司;
硫酸、正丁醇、三氯甲烷:分析纯,天津市科密欧化学试剂有限公司;
过硫酸钾、硫酸亚铁、抗坏血酸:分析纯,福晨(天津)化学试剂有限公司;
甲醇、乙腈、1-苯基-3-甲基-5-吡唑啉酮、三氟乙酸:色谱纯,美国Sigma-Aldrich公司;
单糖标准品(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖):美国Sigma-Aldrich公司。
1.1.2 主要仪器设备
超声—微波协同萃取/反应仪:CW-2000型,上海新拓分析仪器科技有限公司;
高效液相色谱仪:Agilent 1260 LC型,安捷伦科技有限公司;
电子天平:AR323CN型,奥豪斯仪器(上海)有限公司;
紫外可见分光光度计:TU-1810PC型,北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 鲜食水稻籽粒多糖提取 参考超声—微波协同萃取法[11],并稍加修改。将鲜食水稻经60 ℃烘干至恒重,脱壳,粉碎,过100目筛得鲜食水稻干粉,鲜食水稻干粉石油醚回流除脂,以料液比1∶10 (g/mL)加入蒸馏水,在超声波功率50 W,微波功率600 W,温度65 ℃条件下超声—微波萃取30 min,3 200 r/min离心15 min,重复提取2次合并上清液。通过Molish试验检测所提物成分[12],酶法除淀粉,用4倍体积无水乙醇在4 ℃下沉淀12 h,3 200 r/min离心15 min,蒸馏水溶解沉淀,Sevage法除蛋白质,膜法除去小分子物质[13-14],冷冻干燥12 h,得鲜食水稻籽粒多糖粉。
1.2.2 鲜食水稻籽粒多糖测定
(1) 配制6%苯酚溶液:称取苯酚100 g,加铝片0.1 g和碳酸氢钠0.05 g,常压蒸馏,收集(180±2) ℃馏分。精密称取该馏分6 g于100 mL容量瓶中,再加入94 g蒸馏水,摇匀后转置于棕色试剂瓶中,即得质量分数为6%的苯酚溶液,将其置于冰箱中备用[15]。
(2) 标准曲线的绘制:精确称取105 ℃干燥至恒重的葡萄糖100 mg溶解于100 mL容量瓶中。摇匀配制成1 mg/mL葡萄糖标准溶液,精密量取0.2,0.4,0.6,0.8,1.0 mL葡萄糖标准液置于25 mL具塞比色管中,各加蒸馏水至2 mL,分别加入6%苯酚试剂1 mL,摇匀后立刻加入浓硫酸5 mL,立刻摇匀后静置30 min。于490 nm处测定吸光度。以葡萄糖质量为横坐标、吸光度为纵坐标,绘制得到标准曲线方程[16-17]。
(3) 鲜食水稻籽粒多糖测定:将提取的样品稀释后按照1.2.2(2)的方法进行测定,得到所提样液含糖量。
1.2.3 鲜食水稻籽粒多糖分子组成测定 取20 mg鲜食水稻籽粒多糖样品于10 mL具塞试管中,加1 mL蒸馏水溶解多糖,加入4 mol/L三氟乙酸1 mL,密封,在110 ℃条件下水解5 h,冷却后,用甲醇蒸馏4 次,除去多余的酸,蒸干后取2 mg干物质,溶解于0.3 mol/L NaOH溶液(200 μL)中,加入0.5 mol/L PMP—甲醇溶液200 μL,混匀,70 ℃条件下反应1 h,加入0.3 mol/L HCl溶液(200 μL),混匀,加入1 mL氯仿,用力振摇,4 000 r/min离心5 min,弃掉氯仿层[18-19],将上清液过0.22 μm微孔滤膜过滤,取10 μL滤液准备上样。参照马丽萍[20]的方法,稍作修改,使用1260型高效液相色谱仪,其中HPLC条件为:C18柱;柱温30 ℃;流动相A为pH 6.7的KH2PO4—Na2HPO4溶液(83%),流动相B为乙腈(17%);DAD检测器,波长245 nm。
1.2.4 鲜食水稻籽粒多糖抗氧化能力测定
(1) ABTS+自由基清除能力:使用2.45 mmol/L K4S2O8溶液配制2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+)溶液,得到7 mmol/L ABTS+储备液,将储备液在室温、避光条件下放置16 h,取适量储备液,用pH 7.4 PBS(phosphate buffer saline)缓冲液稀释至734 nm波长下OD值为0.70±0.02,作为ABTS+工作液。将样品稀释得到不同浓度梯度待测液,取0.5 mL样品,加入3.5 mL ABTS+工作液,均匀混合,避光反应20 min后在734 nm波长下测定吸光度[21]。根据式(1)计算得到ABTS+自由基清除率。
(1)
式中:
R——清除率,%;
A0——空白组吸光度值;
A1——样品吸光度值;
A2——对照组吸光度值。
(2) DPPH自由基清除能力:用无水乙醇配制0.1 mmol/L 1,1-二苯基-2-三硝基苯肼(DPPH)溶液于棕色容量瓶中,避光保存。将稀释成不同浓度梯度的样品分别取2 mL于试管中,加入2 mL DPPH溶液,混合均匀,避光条件下反应30 min,于517 nm波长下测定吸光度[22]。根据式(1)计算DPPH自由基清除率。
(3) 羟基自由基清除能力:分别配制质量浓度为0.2,0.4,0.6,0.8,1.0 mg/mL鲜食水稻籽粒多糖溶液置于不同烧杯中,然后分别加入9 mmol/L FeSO4溶液1 mL、9 mmol/L水杨酸—乙醇溶液1 mL,最后加入8.8 mmol/L H2O2溶液1 mL并启动整个反应,37 ℃反应0.5 h,以蒸馏水为参比,在510 nm下测量各浓度的吸光度[23]。根据式(1)计算羟基自由基清除率。
(4) 超氧阴离子清除能力:取50 mmol/L Tris-HCl 溶液(pH 8.2)3 mL于10 mL具塞试管中,分别加入0.0,0.2,0.4,0.6,0.8,1.0 mg/mL样品2 mL,混匀,在25 ℃水浴条件下反应10 min,加入提前在等温度下预热的30 mmol/L邻苯三酚溶液200 μL,混匀后反应4 min,加入0.5 mL浓盐酸终止反应,在320 nm处测量吸光度[24]。根据式(1)计算超氧阴离子清除率。
1.3 数据分析
试验数据利用SPSS分析软件进行处理,差异显著性P<0.05表示有差异统计学意义。各组数据平均值(Mean)均采用:均数±标准差表示,n=3,作为最终参考比较值。
2 结果与分析
2.1 鲜食水稻籽粒多糖含量
将在5个不同成熟阶段采集的鲜食水稻样品进行测定,根据葡萄糖标准曲线所得到的回归方程y=0.284 5x-0.022 5(R2=0.998 9)得到各采集时间多糖含量以及变化规律如图1所示。随着成熟时间的延长,鲜食水稻籽粒中多糖含量呈先上升后下降的趋势,其中乳熟后期多糖含量最多,达46.89 mg/g。水稻灌浆初期,籽粒中的多糖组分处于蓄积状态,在乳熟后期多糖含量达到最大值,籽粒逐渐变坚硬,随后多糖逐渐合成淀粉储存于籽粒中,以至于多糖含量降低,成熟后多糖含量变化趋于平稳。
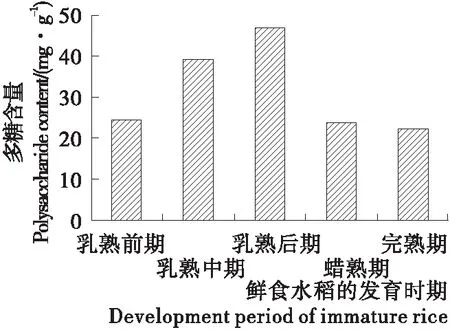
图1 不同采集时期鲜食水稻籽粒多糖含量
Figure 1 Polysaccharides content of immature rice seeds in different collecting periods
2.2 鲜食水稻籽粒多糖Molish试验分析
糖在浓H2SO4或浓盐酸的作用下脱水形成糠醛及其衍生物与α-萘酚作用形成紫红色复合物。如图2所示,添加淀粉的b管中几乎无颜色变化,与空白相近,c~h管中均产生颜色反应,结果表明通过超声—微波协同萃取出的物质确为非淀粉多糖。

a. 水 b. 淀粉 c. 葡萄糖 d~h. 分别为乳熟前期、乳熟中期、乳熟后期、腊熟期及完熟期鲜食水稻提取出的多糖
图2 Molish法鉴别鲜食水稻籽粒多糖
Figure 2 Identification of fresh edible rice seeds polysaccharides by Molish method
2.3 鲜食水稻籽粒多糖结构组成
由图3可知,甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖9种单糖标准品的保留时间分别为12.495,17.224,18.114,20.827,25.390,28.977,30.627,31.835,36.943 min。将不同浓度单糖对照品测定后进行分析得到回归方程如表1所示。
由表1可以看出,各单糖标准曲线均有较好的拟合度。根据各单糖标准曲线,计算出不同时期的鲜食水稻籽粒中多糖所含的各单糖含量,单糖含量如表2所示。
从表2可以得出,鲜食水稻籽粒中的多糖,均含有甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖,但在蜡熟期、完熟期这两个时期的鲜食水稻提取出的多糖中,未检测出甘露糖和岩藻糖,其原因可能是水稻在成熟后期甘露糖和岩藻糖不能稳定的存留在籽粒内部导致的。随着鲜食水稻籽粒逐渐成熟,半乳糖含量呈下降趋势,葡萄糖含量相对较多,且呈上升趋势,说明葡萄糖为鲜食水稻籽粒中多糖的主要组成部分。

a. 甘露糖 b. 鼠李糖 c. 葡萄糖醛酸 d. 半乳糖醛酸 e. 葡萄糖 f. 半乳糖 g. 木糖 h. 阿拉伯糖 i. 岩藻糖
图3 单糖标准品高效液相色谱图
Figure 3 HPLC chromatogram of monosaccharide standard
2.4 鲜食水稻籽粒多糖抗氧化能力
2.4.1 ABTS+自由基清除能力 由图4可知,鲜食水稻籽粒多糖对ABTS+自由基有一定清除能力,且呈明显的浓度依赖性;当多糖浓度为1 mg/mL时,乳熟后期鲜食水稻籽粒多糖清除率最强,达86.18%,其活性已趋近于VC的活性,较其他时期存在显著差异(P<0.05)。可见在乳熟后期鲜食水稻籽粒多糖清除ABTS+自由基能力更强。有研究[25-26]表明,小米糠多糖、燕麦多糖对ABTS+自由基清除率约为57.84%,50.62%,均低于试验中乳熟后期鲜食水稻籽粒多糖。
2.4.2 DPPH自由基清除能力 如图5所示,在试验浓度范围内,鲜食水稻籽粒多糖对DPPH都有一定的清除作用,其清除效果与多糖浓度呈正相关。在测定范围内浓度为1 mg/mL时,对DPPH的清除率最高;乳熟后期鲜食水稻籽粒多糖与其他4个成熟阶段的多糖存在差异显著(P<0.05)。虽然与VC相比还存在一定差异,但是与相关研究中大豆多糖(19.19%)[27]、纳豆多糖(18.33%)[28]相比还存在一定优势。

表1 单糖标准品标准曲线

表2 鲜食水稻籽粒多糖的单糖百分含量†
† ND为未检出;与完熟期相比较,*:P<0.05,**:P<0.01,***:P<0.001。
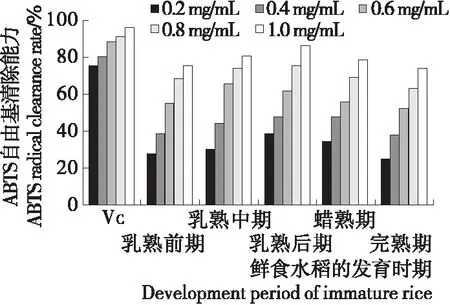
图4 不同成熟时期鲜食水稻中多糖的ABTS+自由基
Figure 4 ABTS+radical scavenging ability of polysaccharides in immature rice at different developing stages
2.4.3 羟基自由基清除能力 如图6所示,乳熟后期鲜食水稻籽粒清除能力均比同一浓度下不同生长阶段的鲜食水稻籽粒多糖的清除能力高,达75.62%。说明鲜食水稻籽粒在乳熟后期至蜡熟期的生长阶段,其羟自由基清除能力更强。
2.4.4 超氧阴离子清除能力 从图7可以看出,VC和鲜食水稻籽粒多糖对超氧阴离子都有一定的清除能力;其中乳熟后期鲜食水稻籽粒多糖对超氧阴离子的清除率最高,达41.49%,但仍略逊色于VC的清除能力。有研究[29]表明,粳米蛋白肽对超氧阴离子的清除能力为42.00%,与试验结果相似。说明试验所获原料同样具有清除超氧阴离子的能力。

图5 不同成熟时期多糖的DPPH自由基清除能力
Figure 5 DPPH radical scavenging ability of polysaccharides in immature rice seeds at different developing stages

图6 不同成熟时期鲜食水稻籽粒多糖的羟基自由基清除能力
Figure 6 OH radical scavenging ability of polysaccharides on immature rice at different developing stages

图7 不同成熟时期鲜食水稻籽粒多糖的超氧阴离子清除能力
Figure 7 Superoxide anion scavenging ability of polysaccharides in immature rice at different developing stages
3 结论
以不同成熟时期的鲜食水稻籽粒为原料,通过超声—微波协同萃取技术,得到非淀粉多糖,进一步研究了多糖的组成及抗氧化活性。试验结果表明,乳熟后期,鲜食水稻中多糖的含量最高,达46.89 mg/g,而且其组分主要为甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖等,而完熟期鲜食水稻的多糖组分中并未检出甘露糖和岩藻糖;研究发现,乳熟后期的鲜食水稻籽粒多糖对ABTS+自由基、DPPH自由基、羟基自由基、超氧阴离子清除率分别为86.18%,56.81%,75.62%,41.69%,均强于其他时期,但与VC相比仍显逊色。
