自体骨髓单核细胞移植对兔退行性病变后椎间盘的修复作用
2020-07-02崔基浩李创马文斌李春徐万宏
崔基浩 李创 马文斌 李春 徐万宏
腰椎间盘退行性病变是临床常见疾病,严重影响患者的日常生活及工作[1]。椎间盘是由软骨终板、纤维环及中间的髓核组成,正常的髓核细胞通过分泌各种生长因子维持细胞外基质的合成与分解代谢的动态平衡。在衰老、创伤、遗传、生活方式等因素作用下,髓核细胞数量逐渐减少、功能减退,使其调节胞外基质的代谢平衡被打破,导致椎间盘退行性病变:蛋白多糖、Ⅱ型胶原合成逐渐减少,髓核组织渗透压下降、水分丢失、椎间隙变窄、脊柱生物力学发生改变[2]。临床表现为腰痛、椎间隙高度丢失及MRI T2W1加权像高信号消失等特征。已有的药物及物理治疗虽可延缓病程、改善部分症状,但无法逆转疾病过程。手术治疗包括椎间盘摘除、椎板切除椎管减压、椎体间融合、人工椎间盘等[3],均以破坏椎间盘的正常生理、解剖结构为代价,不能从根本上治愈椎间盘的退行性病变。骨髓单核细胞(Bone marrow mononuclear cells,BMMNC)是由包括间充质干细胞、造血干细胞、造血祖细胞、内皮祖细胞、脂肪细胞、巨噬细胞、单核细胞、中性粒细胞和血小板在内的异质性细胞群组成[4],可产生大量的细胞因子和营养因子,能够激活体内的内源性修复反应[5]。本研究将自体骨髓单核细胞注入兔退行性病变的椎间盘,利用影像学及组织学方法,观察髓核含水量、椎间隙高度的维持及细胞形态、胞外基质含量,探讨自体骨髓单核细胞对退行性病变后椎间盘的修复作用,以期为临床应用提供理论依据。
1 资料与方法
1.1 实验动物及分组
新西兰大白兔12只,3月龄,体质量约2.5~3.0 Kg,雌雄不限,随机分为对照组(n=6)和治疗组(n=6)。
1.2 研究方法
1.2.1 提取自体骨髓单核细胞
治疗组实验兔髂后上棘处穿刺,抽取骨髓(约1~2 mL),与Hank's平衡盐溶液1∶1混合,1 000 r/min离心30 min,按梯度界面回收单核细胞层,然后用生理盐水配置成细胞密度为5×105cells/mL的细胞悬液,标记待用。
1.2.2 椎间盘穿刺造模
两组实验兔麻醉后,暴露L4/5、L5/6、L6/7椎间隙,使用16 G穿刺针沿椎间盘左侧刺入,见胶冻样髓核溢出即为造模成功。对照组直接缝合关闭伤口。治疗组使用22 G针头自椎间盘前方穿刺注入制备的BMMNCs悬液约0.3 mL,然后缝合关闭伤口。
1.3 观察指标
1.3.1 椎间盘高度指数观察
两组分别在术后第1天和第4、8、24周时行腰椎侧位X线摄片,使用影像软件系统进行测量并计算椎间盘高度指数(Disc height index,DHI)。DHI=椎间盘高度/上位椎体高度×100%。
1.3.2 椎间盘MRI观察
两组分别在术后第4、8、24周进行MR T2W1加权像扫描,并以正常椎间盘MR T2W1加权像扫描为空白对照。
1.3.3 椎间盘组织学观察
两组分别在术后第4、8、24周完成影像学检查后,取L4/5、L5/6、L6/7椎间盘组织行固定、包埋、切片及HE染色,并以正常椎间盘作为空白对照。
1.4 统计学分析
采用SPSS 22.0统计学软件处理数据,组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 椎间盘高度指数观察对比
两组在术后第1天和第4、8、24周分别进行腰椎侧位X线摄片,并计算DHI。结果显示,对照组的DHI均值分别为9.00%、7.15%、5.73%和4.18%,而治疗组的DHI均值分别为9.10%、8.75%、8.70%、7.35%。治疗组在阻止椎间隙高度丢失方面明显优于对照组(P<0.05)(图1)。
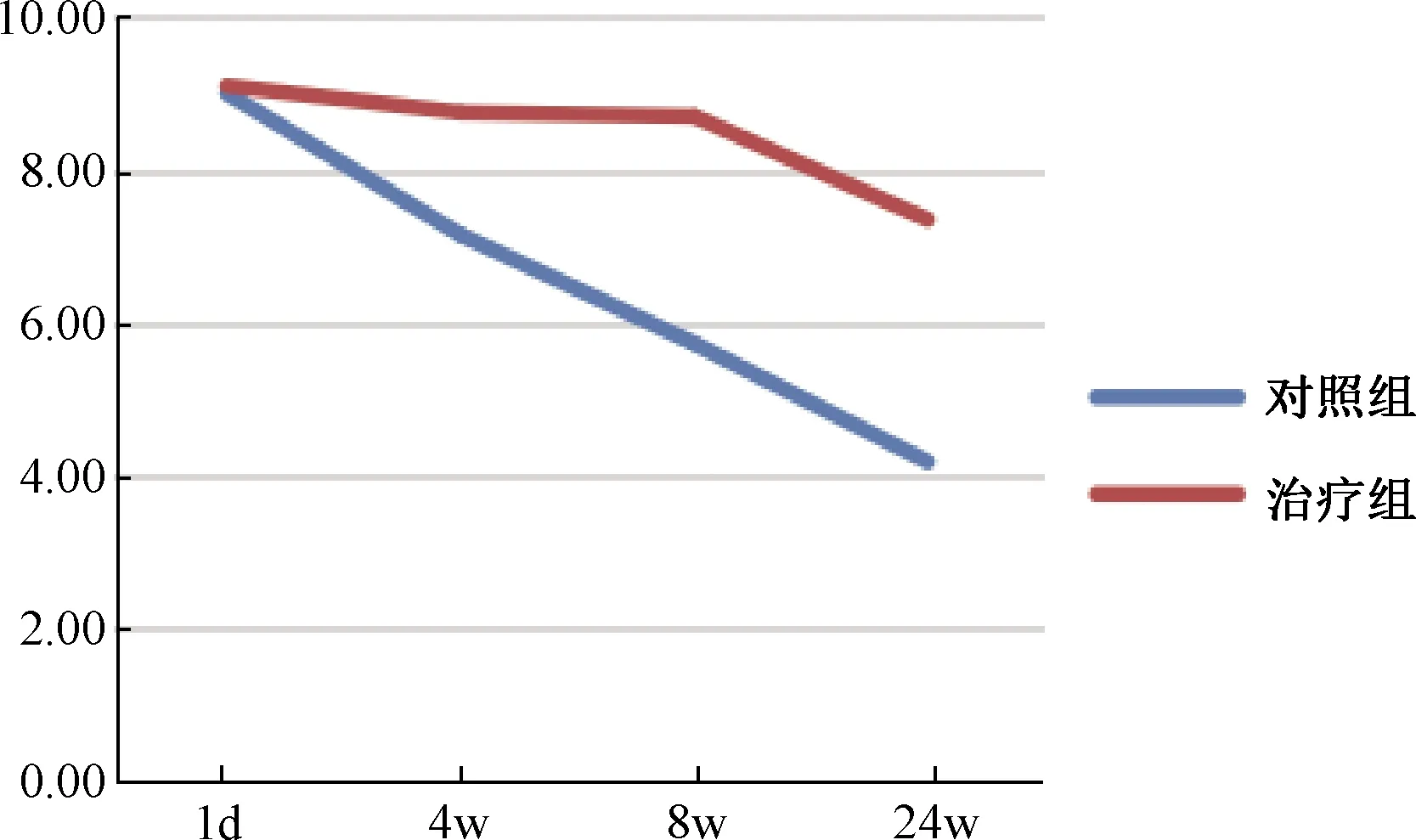
图1 各组各时间点椎间盘高度指数(DHI)Fig. 1 DHI in each group at different time points
2.2 椎间盘MR观察对比
MR T2W1加权像扫描结果显示,术后第4、8、24周时治疗组椎间盘MR T2W1加权像信号始终高于对照组(P<0.05),与正常椎间盘相近,说明治疗组椎间盘含水量的维持明显优于对照组。此外,还观察到对照组的椎间隙变窄趋势较治疗组明显(图2)。

图2 术后第8周各组椎间盘MR T2W1加权像Fig. 2 MR T2W1 weighted images of intervertebral discs in each group at the 8th week of postoperation
2.3 组织学观察
组织学观察显示,正常髓核组织为有序的细胞外基质排列、分布均匀的椭圆形髓核细胞。治疗组的髓核细胞数量与正常髓核相比相对减少,但排列规整,呈椭圆透明状,胞外基质均匀。对照组的髓核细胞数量更加减少,分布零散、混乱,呈梭形及不规则形,体积变小甚至消失不见,胞外基质收缩、不均(图3)。

图3 各组各时间点椎间盘组织学观察Fig. 3 Histological observation of intervertebral disc in each group at different time points
3 讨论
椎间盘退行性病变临床较为常见,保守治疗仅可延缓疾病进程、缓解部分症状;手术治疗均会破坏椎间盘的正常生理、解剖结构,且无法恢复正常的生理功能。目前研究表明,椎间盘内髓核细胞数量的减少及功能减退引起胞外基质蛋白含量下降是导致椎间盘退变的主要原因,这些病理改变会引起椎间盘组织含水量降低、渗透压下降、营养通道关闭,进一步加剧疾病进程,最终引起脊柱的生物力学改变,产生腰痛、下肢放射麻痛、间歇性跛行、马尾综合征等一系列临床症状[6]。因此,为了减缓甚至逆转椎间盘的退变过程,恢复椎间盘的正常结构功能,可以通过移植具有类髓核细胞功能的外源细胞或者激活原有的髓核细胞功能,促使蛋白多糖及Ⅱ型胶原等胞外基质的合成,从而达到修复退变椎间盘的目的。近年来,在椎间盘退变的再生医学研究中,间充质干细胞(Mesenchymal Stem Cells,MSCs)移植备受关注。MSCs是多能性细胞,具有很强的增殖、分化能力,且易从各种组织来源中获得[7]。Deschepper等[8]证实,MSCs治疗退变椎间盘具有一定的效果,表现为椎间盘高度增加、MRI T2W1加权信号增强、组织学分级改善、细胞外基质含量和相关基因表达的恢复等。然而,该方法目前尚存在一些问题,无法应用于临床。因此,我们认为选择一种具有与MSCs类似的再生作用,不需要体外扩增、易获取及利于临床转化的细胞是解决上述问题的可能的途径。
BMMNCs由包含MSCs、造血干细胞、造血祖细胞、内皮祖细胞、脂肪细胞、巨噬细胞、单核细胞、中性粒细胞和血小板在内的异质性细胞群组成,对骨关节炎[9]、脊髓损伤[10]、缺血性脑损伤[11]等疾病具有治疗作用;另外,BMMNCs的快速收集、移植等操作允许在手术室中完成,且无需体外培养[12],从而降低了成本和污染风险。BMMNCs是一种比较理想的,有望用于修复椎间盘退变的外源性移植细胞。
当椎间盘发生退变时,其髓核细胞凋亡,细胞数量减少,胞外基质降解加快,蛋白多糖及Ⅱ型胶原含量减少[13];组织亲水能力明显下降,使椎间盘含水量显著降低,椎间隙高度逐渐变窄。椎间盘退变时X线表现为椎间隙变窄、边缘骨赘形成和脊柱曲线改变,其中椎间隙高度变窄为最具特征性的改变。本研究中,两组术后的X线检查结果显示,治疗组椎间盘的退变得到显著减缓。
通过对椎间盘进行MR T2W1加权像扫描,评估其信号的强弱,反映出椎间盘的含水量变化及具有亲水性带电荷的蛋白多糖的含量,是评价椎间盘退变的一个重要指标。本研究结果显示,治疗组椎间盘MR T2W1加权像信号始终高于对照组,且较接近正常椎间盘的信号强度,说明本实验中治疗组椎间盘含水量的维持明显优于对照组,证明治疗组椎间盘的退变过程被延缓或中止,椎间盘得到一定修复。
椎间盘退变时其组织学层面的细胞形态、结构都会发生一定的病理变化,组织学染色观察也是公认最准确的评价退变的方法[14]。本研究结果显示,在髓核细胞形态、胞外基质分布及细胞数量方面,治疗组明显优于对照组,与正常椎间盘接近,也同样说明了治疗组椎间盘的退变得到有效减缓。
综上所述,自体骨髓单核细胞对退变的椎间盘具有一定的修复再生作用,具有潜在的应用前景,值得进一步深入研究。
