血流向量成像技术评价房间隔缺损的左室流场变化特点及能量损耗变化规律
2020-07-02张键王庆慧丁云川陈剑侯宗柳苏璇李建华张瑜
张键,王庆慧,丁云川,陈剑,侯宗柳,苏璇,李建华,张瑜
1.昆明医科大学(昆明,650051) 2.昆明市延安医院 超声医学科(昆明,650051) 3.云南省心血管疾病重点实验室(昆明,650051) 4.云南省心脏疾病临床医学中心(昆明,650051)
0 引言
房间隔缺损(atrial septal defect,ASD)是最常见的先天性心脏病之一,在先天性心脏疾病中约占10%~20%,在成年人先天性心脏病发病率中占第一位。心房水平的分流会引起腔室内血流动力学的变化,但常规超声只能测量与声束平行的血流速度,无法准确获取血流的真实速度、方向,对于整个心腔的流场运动状态和结构变化情况有一定的局限性[1]。血流向量成像技术能观察腔室内血流的流场状态,评价相关速度、流量、涡量和能量损耗值等腔室内流体运动学相关变化的无创量化指标[2]。
本研究利用血流向量成像技术(vector flow mapping,VFM)来评价房间隔缺损患者在心动周期不同时相下左心室流体相关的流场运动状态及能量损耗的变化,从而揭示ASD所导致的左室流体力学的异常,从而为左室心功能的定量评估提供可靠地依据。
1 资料与方法
1.1 研究对象
2018年8月至2019年4月间,收入我院就诊的继发孔型ASD患者,共60例,其中不伴肺动脉高压(pulmonary arterial hypertension,PAH)者28例,男17例,女11例,年龄20~73岁,平均(42±11)岁,为PAH(-)组;伴PAH者32例,男20例,女12例,年龄22~75岁,平均(41±12)岁,为PAH(+)组。ASD的诊断经常规及食管超声心动图证实,除外合并右室流出道狭窄、肺动脉狭窄及其他器质性心脏疾病。轻度肺动脉高压的诊断标准为肺动脉收缩压≥40~50 mmHg(1 mmHg=133.32 Pa),故本研究中肺动脉收缩压>40 mmHg被定义为PAH。
2018年8月至2019年4月间,收入我院就诊的相关健康志愿者,共31例,其中男性18例,女性13例,年龄20~72岁,平均年龄(40±12)岁,为正常对照组。排除了各种心肺疾病,无血脂、血糖、血压等指标异常;患者享有知情同意权。
1.2 仪器与方法
1.2.1 仪器
HITACHI公司的LISENDO 880彩色多普勒超声诊断检查仪器,相控阵单晶体探头S121,频率1.0~5.0 MHz。
1.2.2 方法
1)常规超声心动图及血流成像技术(vector flow mapping,VFM)检查:受检者采取左侧卧位,平静呼吸;连接同步体表心电图,经心尖四腔心、三腔心及两腔心等多切面扫查,开启VFM模式,调节设备相关设置,获取优质的VFM影像;采集3个连续的心动周期,彩色多普勒帧频≥55帧/s。2)VFM数据分析:将采集到的图像通过VFM模式进行在线分析;选择相应的心动周期,并完整地勾画出心内膜;选择Time-Flow Curve功能,获取相关的时间-流量曲线,将整个心动周期划分为等容舒张期(P0)、舒张早期的快速充盈期(P1)、舒张中期(P2)、心房收缩早期(P3)、心房收缩中期(P4)、心房收缩晚期(P5)、等容收缩期(P6)、收缩中期的快速射血期(P7)、收缩晚期的减慢射血期(P8)等9个时相;分别选择Streamline、Energy loss选项,获取P0~P8期左心室内的流线以及能量损耗图像,测量涡流数量、面积、循环强度及能量损耗等相关参数。
1.3 统计学分析
本研究采用SPSS 22.0来进行相关统计学分析。受检者的基础数据、左心室结构和功能、流场参数用均数±标准差来表示,多组间比较采用单因素方差分析。对左心室的整体EL、流场参数及左室舒张功能参数采用Pearson双变量相关检验来进行相关分析,检验水准α=0.05(双侧),以P<0.05视为差异有统计学意义。
2 结果
2.1 左心室内流线的变化特点
正常对照组:在P0期,左室内未发现明显的涡流出现;二尖瓣开放之后,血流方向由心底部朝向心尖侧,P1、P2期,发现位于二尖瓣口附近存在较多的涡流;P3、P4、P5期的涡流仍然以在二尖瓣口周围为主;二尖瓣关闭之后,P6期的涡流从二尖瓣口周围向左室流出道侧移动;进入P7、P8期,涡流逐渐减退消失。
PAH(-)组:涡流的整体变化特点与正常对照组相似。
PAH(+)组:在P0期,左室内未发现明显的涡流出现;在P1-P7期,左室内均有大小、方向、数目不一样的涡流产生,形态不规则,运动方向比较杂乱,疏密而不均匀;P3、P4、P5期,左心室的中部会出现较大的涡流;P6、P7期,涡流杂乱多变,圈数套叠现象比较多见,分布呈不规律性;进入P8期,涡流逐渐减退消失。详见图1。
实验结果发现,PAH(-)组的涡旋面积、循环强度、涡旋数量大小比正常对照组稍增大,而PAH(+)组则相较两者明显增加,其差异均有统计学意义(P<0.05)。详见表1。
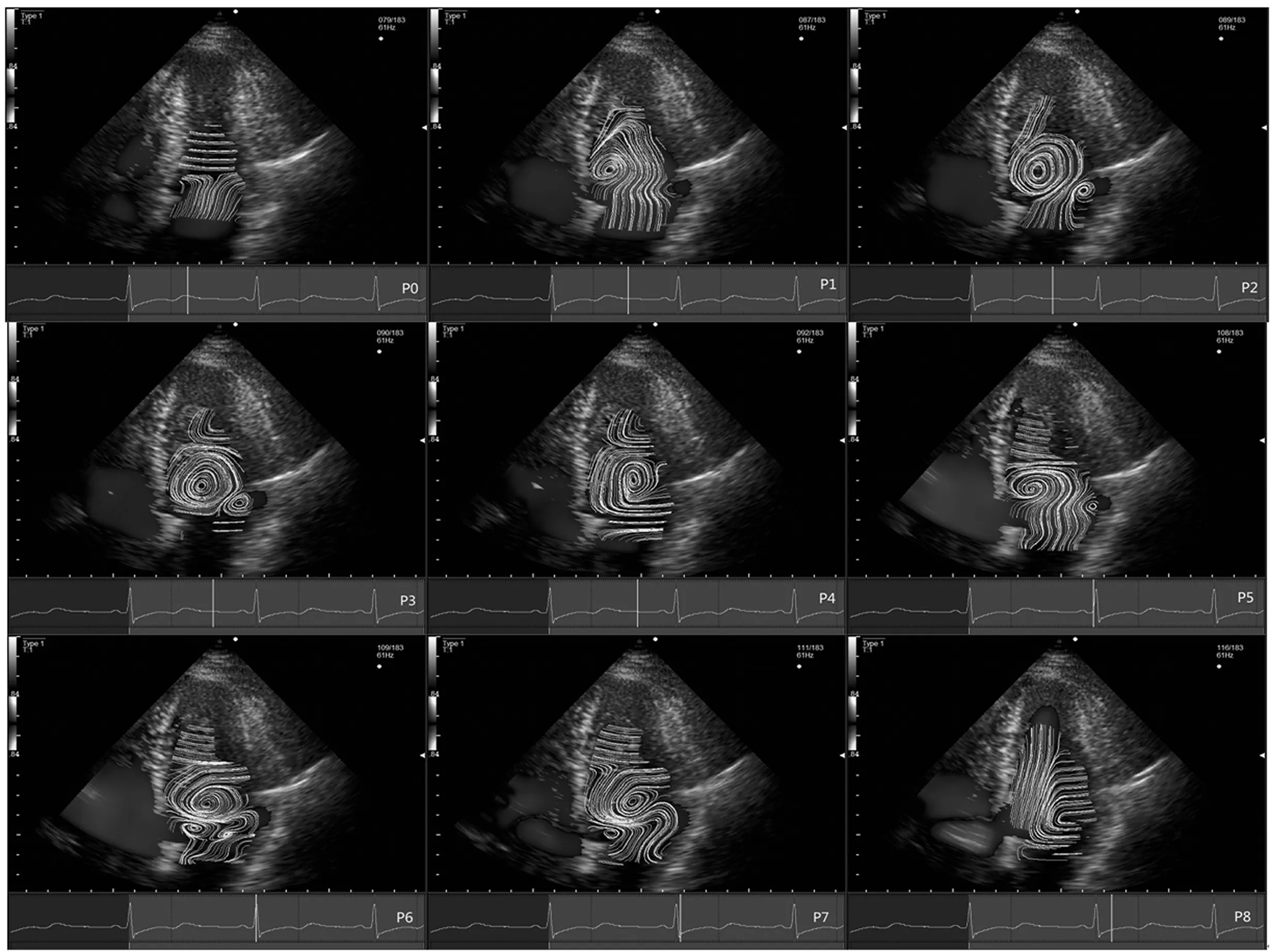
图1 依次分别为PAH(+)组P0-P8期的流线图Fig.1 Flow line of P0-P8 in PAH(+)group

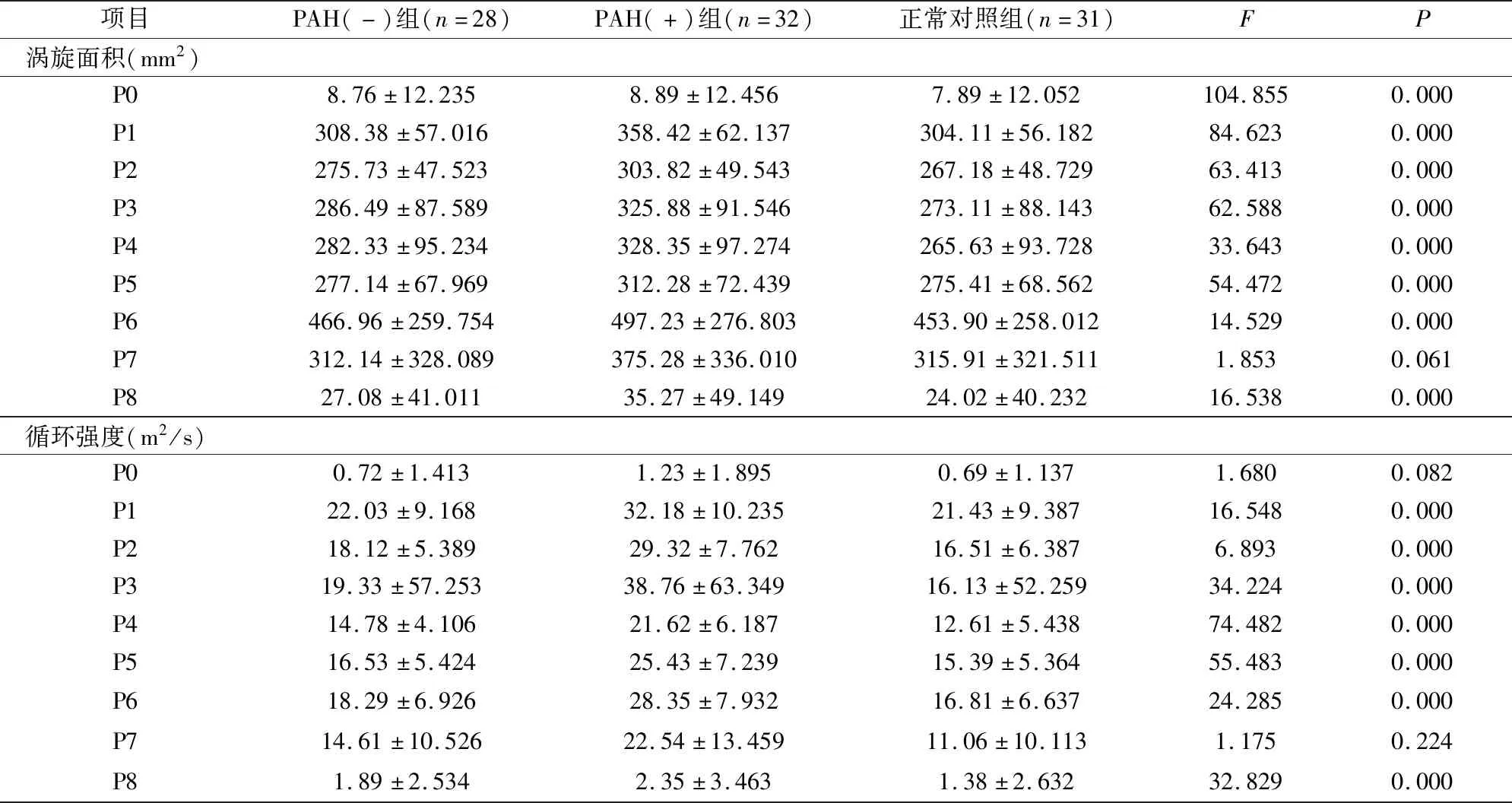
项目PAH(-)组(n=28)PAH(+)组(n=32)正常对照组(n=31)FP涡旋面积(mm2)P08.76±12.2358.89±12.4567.89±12.052104.8550.000P1308.38±57.016358.42±62.137304.11±56.18284.6230.000P2275.73±47.523303.82±49.543267.18±48.72963.4130.000P3286.49±87.589325.88±91.546273.11±88.14362.5880.000P4282.33±95.234328.35±97.274265.63±93.72833.6430.000P5277.14±67.969312.28±72.439275.41±68.56254.4720.000P6466.96±259.754497.23±276.803453.90±258.01214.5290.000P7312.14±328.089375.28±336.010315.91±321.5111.8530.061P827.08±41.01135.27±49.14924.02±40.23216.5380.000循环强度(m2/s)P00.72±1.4131.23±1.8950.69±1.1371.6800.082P122.03±9.16832.18±10.23521.43±9.38716.5480.000P218.12±5.38929.32±7.76216.51±6.3876.8930.000P319.33±57.25338.76±63.34916.13±52.25934.2240.000P414.78±4.10621.62±6.18712.61±5.43874.4820.000P516.53±5.42425.43±7.23915.39±5.36455.4830.000P618.29±6.92628.35±7.93216.81±6.63724.2850.000P714.61±10.52622.54±13.45911.06±10.1131.1750.224P81.89±2.5342.35±3.4631.38±2.63232.8290.000
(续表1)
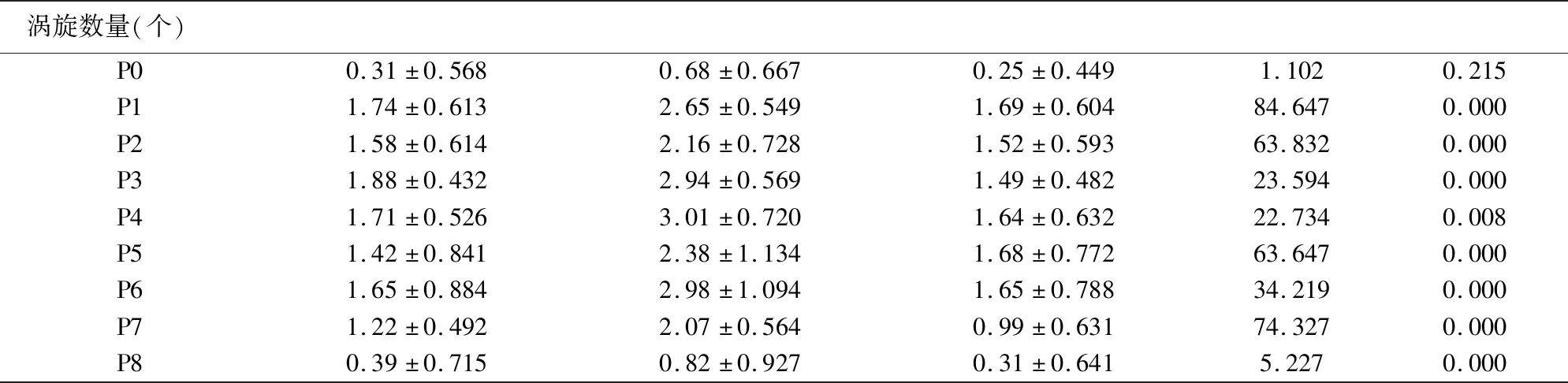
涡旋数量(个)P00.31±0.5680.68±0.6670.25±0.4491.1020.215P11.74±0.6132.65±0.5491.69±0.60484.6470.000P21.58±0.6142.16±0.7281.52±0.59363.8320.000P31.88±0.4322.94±0.5691.49±0.48223.5940.000P41.71±0.5263.01±0.7201.64±0.63222.7340.008P51.42±0.8412.38±1.1341.68±0.77263.6470.000P61.65±0.8842.98±1.0941.65±0.78834.2190.000P71.22±0.4922.07±0.5640.99±0.63174.3270.000P80.39±0.7150.82±0.9270.31±0.6415.2270.000
2.2 左心室内能量损耗的变化规律
实验结果发现,PAH(-)组各时相下的EL值比正常对照组稍增大,而PAH(+)组则相较两者明显增加,其差异均有统计学意义(P<0.05)。详见表2。

表2 各心动周期不同时相下左心室整体能量损耗的比较Tab.2 Comparison of global left ventricular energy loss in different cardiac cycles
2.3 左心室内涡流、能量损耗与心功能相关参数的比较分析
实验结果发现,PAH(+)组与PAH(-)组的左室整体EL值大小在P1、P2、P3、P4期分别与其循环强度、涡旋面积及涡旋数量呈正相关(P均<0.05);正常对照组的EL值在P0、P1、P2、P3、P4期分别与其循环强度、涡旋面积及涡旋数量呈正相关(P均<0.05)。
PAH(+)组、PAH(-)组、正常对照组的左室整体EL值大小在P1、P2、P3期分别与其E、E/e呈正相关,与e呈负相关,差异均有统计学意义(P<0.05)。见图2。
3 讨 论
VFM是以彩色血流多普勒成像技术和二维心肌组织追踪技术为基本,以血液是不可压缩的,质量守恒定律,连续方程为原理,通过对结合腔室内的血流分析来观测血液流速、流量大小以及涡流的相关时间-空间分布的具体情况[3],Uejima[4]等通过实验发现VFM所测量得到的血流速度向量大小与实际的血流速度值相似度极高,进而进一步验证出VFM成像技术可以作为一种有效评估腔室内血流动力学的临床应用技术。本研究利用VFM成像技术来评价ASD在心动周期不同时相下左室流体相关的流场运动状态及EL的变化规律,从而为研究腔室内的血流动力学变化提供了一种崭新的思路。
本研究发现,PAH(-)组与正常对照组的涡流变化特点相似,P1、P2期发现二尖瓣口附近存在较多涡流,P6期的涡流从二尖瓣口周围向左室流出道侧移动。原因考虑ASD不合并PAH时,右室内收缩末期压力无明显升高,室间隔无明显受压,对左心室形态影响不大[5]。PAH(+)组在心动周期各时相下左室内均有大小、方向、数目不一样的涡流产生,同时PAH(+)组的涡旋面积、循环强度、涡旋数量大小相较其余两组明显增加,这种变化特点,主要是由于ASD所产生的左向右分流减少了左室舒张末期充盈量,同时增加了右室舒张末期容积,右室容积越大,对左室舒张末期充盈量影响也越大;PAH使右室收缩末期压力增加,挤压室间隔靠向左室一侧,左室的形态由正常的椭圆形变为狭长的长椭圆形或不规则形,趋于狭小,在严重病例中甚至呈“裂隙样”改变,室间隔运动不协调,从而导致血液淤滞、血液容量增多及血液质点增多[6]。


图2 三组EL与E、e、E/e的重叠分布散点图Fig.2 Three groups of scatter plots of overlapping distribution of EL、E,e,E/e
结果发现,PAH(-)组各时相下的EL值比正常对照组稍增大,而PAH(+)组则相较两者明显增加,其整体EL峰值均出现在P1期。且相关性分析发现三组的EL值在P1、P2、P3、P4期分别与其循环强度、涡旋面积及涡旋数量呈正相关;且与其E、E/e呈正相关,与e呈负相关。涡旋在腔室内相互撞击、旋转,会扰乱血流速度向量的分布,此时由于血流的黏滞性以及心室壁各节段的室壁剪切应变力与周围血液之间的相互摩擦将会产生摩擦相关的热能,从而增加相应流体的能量损耗,即EL值与涡流的循环强度、涡旋面积及涡旋数量大小密切相关[7]。ASD合并PAH时,左室受压变形,左室容积缩小,舒张期充盈受限,射血分数下降,左心舒张末压升高,心功能受损。同时,由于左室回心血量减少,左室充盈减少,进一步通过Frank-Starling定律导致左室输出量减少,能量损耗明显增加[8]。左室舒张期又是主动消耗能量的过程[9],心脏的有效射血量随之降低,从而使提供给心肌的氧气和能量受到制约,最终造成舒张功能的相应减低。上述现象表明,对心腔内流体能量损耗的定量评估可以为心功能评价提供新的参考。
目前本研究仍存在一定的局限性,一是目前研究的样本量比较少,需要进一步增加,从而获取更加客观的实验结果;二是VFM是利用二维图像来模拟三维的血流流场[10],因此难免会丢失一些重要的信息。相信未来伴随着科技的进步,VFM成像技术将会拥有更加广泛和实用的诊疗价值和社会应用价值。
综上所述,VFM成像技术可显示ASD左室内血流的流场状态变化特点以及能量损耗的变化规律,通过可视化测量涡旋面积、涡旋数量、循环强度以及能量损耗大小,可为ASD左室心功能的定量评估、内外科的治疗选择以及效果的观察提供强有力的诊断和测量技术保障。