有机膦催化炔酮分子间的环化反应研究
2020-07-02陈艳艳傅俊峰韩小瑜
陈艳艳,傅俊峰,韩小瑜,2
(1.浙江科技学院 生物与化学工程学院,杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,杭州 310023)
炔酮是一类化学性质相对活泼的有机化合物,含有双官能团[1]。基于其所含的碳-碳三键及羰基独特的化学反应活性,炔酮介导了诸多独特的化学转化,可作为潜在的C2、C3、C4合成子构建各种碳环或杂环化合物[2]。在小分子叔膦催化剂的作用下,炔酮产生两性离子中间体,进而发生环加成反应,如[3+2][3-4]、[4+1][5]、[4+2][6-7]和[6+3][8]等环加成反应,成为近年来有机合成的研究热点。许多合成反应已应用于天然产物和生物活性分子的合成中[9],使其在合成方法学及药物化学领域占据重要地位。
环戊烯酮骨架是天然产物和生物活性分子中的多功能结构单元,可以在烯酮基序上进行广泛的功能化[10-11]。特别是含有环戊烯酮单元的前列腺素显示出多种生物活性,如抗肿瘤、抗病毒和抗炎活性[12]。合成这种结构单元的方法有通过Nazarov环化、Pauson-Khand反应、分子内羟醛反应和亚砜消除,进而发生Diels-Alder反应及炔酮的等位环羰基化等有机化学反应[13-14]。然而,这些合成方法大多存在多级操作或效率低等问题,因此开发一种简单、经济和高效的合成方法,对环戊烯酮类化合物的合成有重要意义和潜在的应用价值。
1 试验部分
1.1 材料和仪器
1.1.1 材 料
正丁基锂、三氟化硼乙醚、苯酚、冰乙酸、叔膦催化剂等化学品,以及分析纯溶剂甲苯、四氢呋喃、1,2-二氯乙烷、冰乙酸、石油醚等,均购自萨恩化学技术(上海)有限公司。4-苯基-3-丁炔-2-酮参照文献[15]制备。
1.1.2 仪 器
核磁共振仪AV500(德国布鲁克公司),磁力搅拌低温槽EYELAPSL-1810(日本东京理化器械株式会社),电子分析天平BSA224S(德国赛多利斯集团),旋转蒸发仪N-1300D-W(日本东京理化器械株式会社),熔点测定仪JH60(上海佳航仪器公司)。
1.2 试验方法
1.2.1 4-苯基-3-丁炔-2-酮制备
以苯乙炔和乙酸乙酯为原料,通过图1方法制得化合物3[15]。
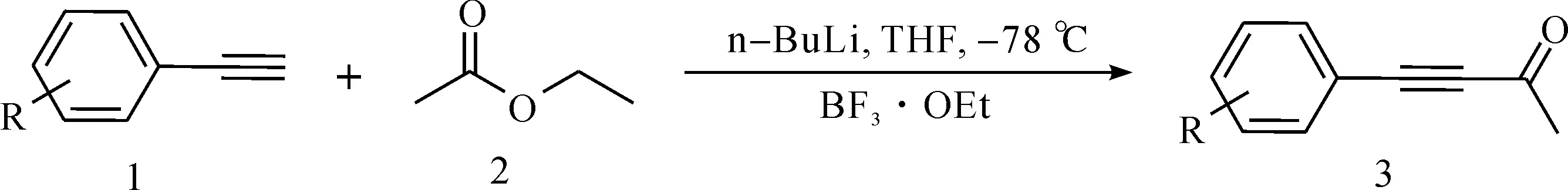
图1 4-苯基-3-丁炔-2-酮底物的制备Fig.1 Preparation of 4-phenylbut-3-yn-2-one
在烘干的50 mL圆底烧瓶中,在氮气保护下分别加入7.6 mL无水四氢呋喃(THF)溶液和7.6 mmol的化合物1,将该混合物冷却至-78 ℃,再加入正丁基锂(n-BuLi)3.04 mL,使反应进行30 min。之后加入乙酸乙酯2(溶解于11.4 mL的无水四氢呋喃中)及三氟化硼乙醚溶液(BF3·OEt)1.13 mL,并继续反应30 min。经TLC(thin layer chromatography,薄层色谱)点板监测反应进行,直至反应完成。加入饱和的氯化铵溶液(20 mL)淬灭反应,再将反应物升温至室温。先用乙酸乙酯萃取3次,再用饱和氯化钠溶液洗涤,最后用无水硫酸钠进行干燥。除去有机溶剂后,残余物通过层析柱(石油醚与乙酸乙酯的体积比为50∶1)分离纯化得到化合物3。
1.2.2 叔膦催化炔酮分子间[3+2]环加成反应
如图2所示,催化剂对甲氧基三苯基膦((p-OMePh)3P,100 mol%)溶于1 mL 1,2-二氯乙烷溶剂中,加入冰醋酸(AcOH,30 mol%),之后加入4-苯基-3-丁炔-2-酮(DCE,0.04 mol)。通过TLC点板跟踪反应直至反应结束。真空除去有机溶剂,残余物通过层析柱(石油醚与乙酸乙酯的体积比为50∶1)分离纯化,得到化合物4。
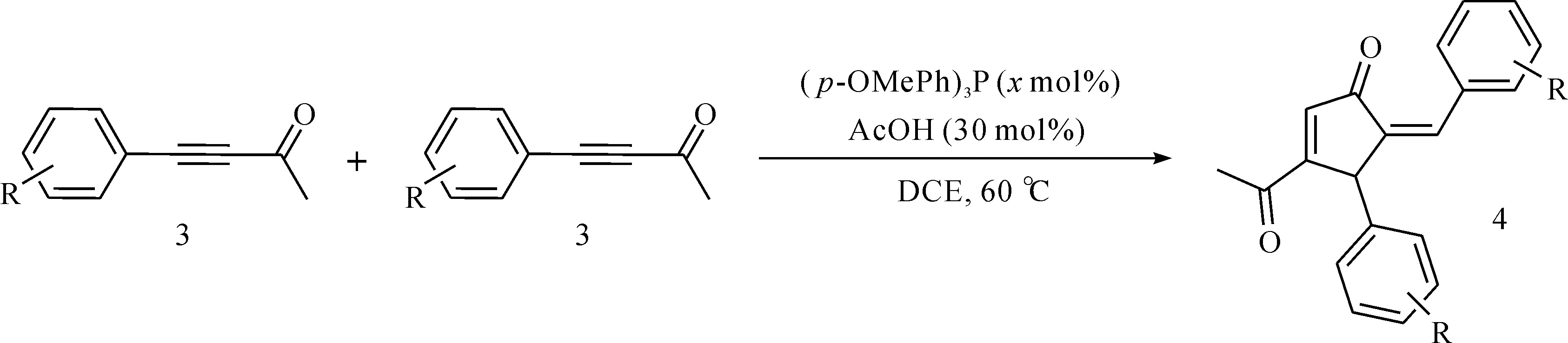
图2 叔膦催化炔酮分子间环化反应Fig.2 Phosphine catalyzed intermolecular cyclization reaction
2 结果和讨论
2.1 炔酮分子间环化反应条件的优化
以4-苯基-3-丁炔-2-酮为反应底物,1,2-二氯乙烷为反应溶剂,选取三价叔膦催化剂在含有30 mol%添加剂苯酚的条件下进行[3+2]环化反应试验。结果表明,在强亲核性Bu3P催化作用下并未发生反应,故未得到环戊烯酮化合物;而筛选的其他三价叔膦催化剂(表1,编号3—5)都能得到目标产物,并表现出良好的催化活性(表1,编号1—5)。从表1中可以看出,在相同反应条件下,(p-OMePh)3P对反应的催化活性最好,产物的收率较高;增加催化剂用量时,反应所需时间缩短,产物的收率得到提高(表1,编号6—8)。

表1 催化剂及其用量的试验及结果Table 1 Test and result of catalyst and its dosage
在确定最佳催化剂及其用量后,我们对反应添加剂进行了筛选,选取实验室比较常用的添加剂如邻氟苯甲酸(o-FPhCOOH)、冰乙酸(AcOH)及联二萘酚(BINOL,30 mol%)等进行试验,结果见表2。由表2可知,当添加剂为对甲基苯磺酸(TsOH)时,分子间不发生[3+2]反应;当冰乙酸和苯酚(PhOH)为反应添加剂时,产物的收率较高。但苯酚作为反应添加剂时,反应物完全反应时间过长,综合考虑后确定冰乙酸为最佳反应添加剂。

表2 添加剂的优化试验及结果Table 2 Optimization test and result of additives
此外,从表3试验结果来看,溶剂和反应温度对炔酮的分子间[3+2]反应有较大的影响。以甲苯、二氯乙烷、四氢呋喃等作为反应溶剂进行试验条件筛选,醚类溶剂和苯类溶剂的反应结果较差(表3,编号1—6),而1,2-二氯乙烷为溶剂时反应结果较好,在反应温度从室温升至40 ℃时,反应时间减少,收率提高。在60 ℃条件下产物的收率最高(表3,编号7)。

表3 溶剂和反应温度的优化试验及结果Table 3 Optimization test and result of solvents and reaction temperatures
以上试验结果表明:在(p-MeOPh)3P和AcOH共同催化作用下,以1,2-二氯乙烷作为反应溶剂,在反应温度为60 ℃下反应2 h,5-次烷基-2-环戊烯酮化合物收率较高。因此,该反应条件被确定为叔膦催化炔酮分子间[3+2]环化反应的最佳反应条件。
2.2 不同取代基对[3+2]炔酮环化反应的影响
在确定最佳反应条件的基础上,我们进一步考察了该环加成反应对底物的普适性。试验结果(图3)表明,反应物炔酮的苯环上连有供电子及吸电子取代基时,反应都表现出良好的兼容性,均以良好的收率得到环戊烯酮化合物(4a~4e)。这表明该叔膦催化的炔酮的分子间[3+2]环化反应的底物适用性较为广泛,是合成5-次烷基-2-环戊烯酮类化合物的一种经济可行的方法。所有合成产物均通过1HNMR、13CNMR进行结构表征确认。
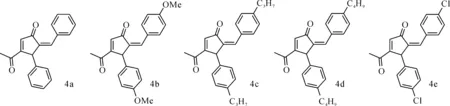
图3 对甲氧基三苯基膦催化[3+2]环加成反应底物普适性考察Fig.3 (p-OmePh)3P catalyzed [3+2] cyclization reaction-substrates exploration
4a:收率73%,淡黄色固体;熔点178~180 ℃。1H NMR(500 MHz,丙酮)7.58(s,1H),7.41(d,J=5.5 Hz,2H),7.25-7.24(m,5H),7.19(t,J=7.5 Hz,2H),7.11(t,J=7.5 Hz,1H),6.88(s,1H),5.26(s,1H),2.36(s,3H);13C NMR(126 MHz,丙酮)198.0,196.5,166.2,137.8,137.5,135.8,135.0,133.5,131.2,130.0,128.6,128.5,128.4,127.2,48.6,28.4;理论值为C20H16O2Na[M+Na]+=311.104 8,实测值=311.104 9。
4b:收率56%,淡黄色固体;熔点185~186 ℃。1H NMR(500 MHz,丙酮)δ8.06(d,J=8.9 Hz,1H),7.54(s,1H),7.43-7.36(m,1H),7.19(d,J=8.8 Hz,1H),7.12(d,J=8.7 Hz,1H),6.88(dd,J=6.3,1.8 Hz,1H),6.87-6.83(m,1H),6.83-6.81(m,1H),6.80-6.76(m,1H),6.75-6.71(m,1H),3.85-3.69(m,6H),2.35(d,J=4.6 Hz,3H);13C NMR(126 MHz,丙酮)δ198.1,195.2,165.8,162.3,161.6,158.7,142.3,139.6,137.2,135.8,134.6,131.8,129.3,129.0,127.4,114.3,114.0,55.3,55.1,26.9;理论值为C22H20O4Na[M+Na]+=371.125 9,实测值=371.126 6。
4c:收率51%,淡黄色固体;熔点115~116 ℃。1H NMR(500 MHz,丙酮)δ7.55(s,1H),7.34(d,J=8.0 Hz,2H),7.15(d,J=7.9 Hz,2H),7.05(d,J=8.0 Hz,2H),6.99(d,J=8.0 Hz,2H),6.84(s,1H),5.20(s,1H),2.54-2.49(m,2H),2.49-2.42(m,2H),2.35(s,3H),1.55(m,2H),0.86(t,J=7.3 Hz,6H);13C NMR(126 MHz,丙酮)δ198.2,196.6,166.1,145.3,141.5,137.0,135.7,134.9,134.7,131.4,131.1,128.6,128.4,48.4,37.8,37.5,28.4,24.2,24.1,13.7;理论值为C26H28O2Na[M+Na]+=395.198 7,实测值=395.199 0。
4d:收率60%,淡黄色固体;熔点106~108 ℃。1H NMR(500 MHz,丙酮)δ7.54(d,J=1.1 Hz,1H),7.34(d,J=8.2 Hz,2H),7.15(d,J=8.1 Hz,2H),7.06(d,J=8.2 Hz,2H),7.00(d,J=8.1 Hz,2H),6.84(d,J=1.5 Hz,1H),5.20(s,1H),2.56-2.51(m,2H),2.51-2.46(m,2H),2.35(s,3H),1.51(m,4H),1.31-1.24(m,4H),0.89(t,J=6.2 Hz,3H),0.86(t,J=6.2 Hz,3H);13C NMR(126 MHz,丙酮)δ198.3,196.6,166.1,145.58,141.8,137.0,135.7,134.9,134.7,131.5,131.0,128.6,128.6,128.4,48.4,35.5,35.1,33.3,33.2,28.4,22.3,22.2,13.9,13.8;理论值为C28H32O2Na[M+Na]+=423.230 0,实测值=423.230 8。
4e:收率68%,淡黄色固体;熔点106~108 ℃。1H NMR(500 MHz,丙酮)7.53(d,J=1.5 Hz,1H),7.33(m,2H),7.25(m,2H),7.17(m,4H),6.90(d,J=2.0 Hz,1H),5.21(t,J=1.5 Hz,1H),2.39(s,3H);13C NMR(126 MHz,丙酮)197.4,196.2,165.4,137.6,136.4,136.2,135.8,133.9,133.3,132.3,131.7,129.9,128.91,128.86,47.7,28.3;理论值为C20H15Cl2O2[M+H]+=357.044 9,实测值=357.044 9。
3 结 语
本研究报道了(p-OMePh)3P催化的4-苯基-3-丁炔-2-酮分子间[3+2]环化反应。该反应条件温和,收率良好,底物适用范围广,是一种制备环戊烯酮类化合物的有效合成方法。所有产物均经氢谱和碳谱来进行结构表征的确认。叔膦催化环加成反应的发现,进一步扩充了膦催化[3+2]环化反应类型,为构建含有环戊烯酮结构单元的生物活性分子提供了潜在的合成方法。未来随着新型廉价高效的手性叔膦催化剂的出现及对催化反应机理研究的深入,有机叔膦催化炔酮环加成反应必将进一步拓展。
