大豆GmNRT1.2a 和GmNRT1.2b 基因的克隆及功能探究
2020-07-02李国纪曹金山王幼宁
李国纪 朱 林 曹金山 王幼宁
华中农业大学植物科学技术学院, 湖北武汉 430070
氮素是植物生长所必需的大量元素之一, 其作为重要成分参与核酸、氨基酸、蛋白质和磷脂及酶的合成, 在植物生长发育及光合作用等多个重要过程中氮素都扮演着主要角色。缺乏氮素会显著影响植物的正常生长, 出现植株矮小和产量降低等诸多现象[1]。在农业生产中, 氮素营养对于粮食生产与农业发展都具有至关重要的作用[2]。
植物吸收土壤中的氮素是通过吸收、同化、转运几个步骤实现的[3]。植物可以吸收2 种不同形式的氮, 一是无机氮, 如硝酸盐和氨盐等, 二是有机氮, 如尿素、氨基酸、蛋白质等。硝酸盐和铵盐是植物根系从土壤中获得氮素的最主要的2 种形式,植物根毛通过主动运输的方式吸收并利用NO3-和NH4+, 两者具有不同的理化性质, 因而对植物的生长和代谢也会产生不同的生理效应[4-5]。硝酸盐是植物生长过程中重要的无机氮源, 它不仅作为植物的营养元素, 调控叶面积指数和地上部分干物质累积量[6]以及根系发育等植物生长发育过程[7-8], 也作为一种信号分子, 调节植物生长发育的许多方面, 包括硝酸盐相关的基因表达[9]、根系构型[10]、种子休眠[11]、开花时间[12]等。
众所周知, 豆科作物与其他作物不同, 除可通过主动运输的方式吸收利用氮素营养外, 还可通过其根部特化的组织-根瘤进行共生固氮(symbiotic nitrogen fixation, SNF), 获取氮素营养。共生固氮过程是一个非常复杂的过程, 当土壤中氮元素缺乏时,豆科植物的根系会释放出类黄酮类物质, 并以此吸引根瘤菌聚集到根系周围, 根瘤菌受到类黄酮类物质的诱导会释放结瘤因子(nod factor, NF)。结瘤因子被豆科植物根部的LysM 型受体激酶NFR 接受并由此激活NF 信号通路。在百脉根(Lotus japonicus)中,结瘤因子受体为LjNFR1 及LjNFR5 编码[13-14], 苜蓿(Medicago truncatula) 中 为 MtLYK3/MtLYK4 及MtNFP[15]; 在大豆(Glycine max)中编码结瘤因子受体蛋白的同源基因包括GmNFR1α/β及GmNFR5α/β[16-17]。结瘤因子受体接受NF 后, 启动下游信号转导级联反应和激活质膜上的激酶(包括 LjSYMRK、MtDMI2、GmNORK 等), 引起“钙峰”进而导致根瘤菌和植物根系相互作用并形成侵染线。转录因子NIN 在侵染线和根瘤原基形成过程中起着重要作用,它与NSP1 和NSP2 结合共同调节表皮中的结瘤基因表达和结瘤过程。在豆科植物中相关基因报道已有许多, 但大豆中鉴定到的组分还为数不多, 除了经典的ENOD40[18]之外, 近年来miR172c-NNC1[19]、GmEXPB2[20]、GmPT7[21]、GmBEHL1[22]等已被证明参与调控大豆的结瘤过程。G-protein 信号通路相关基因Gα、Gβ、Gγ[23-24]、RGS[24]等也被发现可以介导大豆根瘤的发生发育。与此同时, 近年来的多项研究结果证明, 生长素合成与生长素信号通路多个组分参与大豆根瘤形成过程, 例如GmYUC2a[25]、miR393-GmTIR1/GmAFB3[26]、miR160-ARF10/ ARF16/ARF17[27]
和miR167-GmARF8a/GmARF8b[28]等。尽管如此, 对于复杂的菌植互作、根瘤发生发育和共生固氮过程,还需要通过多种技术手段挖掘其调控的功能基因,从而全面解析介导大豆共生固氮过程的分子调控网络。
硝酸盐转运蛋白(nitrate transporter, NRT)介导了硝酸盐的吸收、转运和分配, NRT 类转运蛋白主要由NRT1 和NRT2 两个亚家族组成。在拟南芥中,AtNRT1.2属于NRT1亚家族, 并且由于其表达不受NO3-的诱导, 呈组成型表达[29-30]。之前我们已经对大豆GmNRT1.2s有比较详细的生物信息学分析, 相关结果暗示GmNRT1.2s可能参与大豆共生固氮过程。本研究通过对不同组织和不同浓度氮处理下GmNRT1.2a(Glyma.18G126500)和GmNRT1.2b(Glyma.08G296000)[31]的表达检测, 并利用大豆毛状根转化体系研究二者在大豆结瘤过程中的功能, 证明二者在大豆根系结瘤过程中发挥重要作用。
1 材料与方法
1.1 材料
1.1.1 植物材料 大豆材料是已经完成基因组测序的品种Glycine maxvar. Williams 82, 后文简称为W82。
1.1.2 菌株和质粒 克隆基因所采用的大肠杆菌(E. coli)菌株是DH5α, 大豆毛状根转化所用的发根农杆菌(Agrobacterium rhizogenes)为K599, 大豆慢生型根瘤菌菌株为Bradyrhizobium diaefficiensUSDA 110。载体构建涉及到的质粒为T 载体Blunt3,基因过表达载体选用pEGAD。
1.1.3 酶和试剂 KOD plus neo 高保真聚合酶购自TOYOBO, 限制性内切酶购自New England Biolabs (NEB), T4 连接酶购自TaKaRa 公司。
利用Adlab 公司的TRI pure 试剂提取总RNA,用购自TaKaRa 公司的RNA 反转录试剂完成模板cDNA 的合成, 选用北京天根公司的 SuperReal PreMix Plus (SYBR Green)试剂盒进行荧光定量PCR,由上海生工生物公司合成引物, 质粒小提试剂盒、DNA 凝胶回收试剂盒购自Axygen 公司。
1.2 方法
1.2.1 大豆实生苗接种根瘤菌处理 将大豆W82种子用70%的酒精灭菌30 s, 于低氮营养液浸泡的蛭石中萌发, 基础营养液配方参考之前发表文章[32],其中以 Ca(NO3)2·4H2O 作为氮源调整氮浓度至0.25 mmol L-1, 期间以水和低氮营养液交替培养。培养室中, 16 h 光/8 h 暗, 光强140 µmol m-2s-1, 温度26 ℃, 相对湿度为70%。大豆萌发15 d 后, 将大豆慢生根瘤菌Bradyrhizobium diaefficiensUSDA 110(OD600为0.08)轻轻浇灌在大豆幼苗根系周围, 接种量为每棵30 mL, 分别在接菌后10 d 和 28 d 取叶片、根和根瘤样品, 于液氮中速冻后保存于-80℃超低温冰箱中备用。
1.2.2 大豆实生苗氮浓度梯度处理 根据大豆生长发育过程的需氮量以Ca(NO3)2·4H2O 作为氮源,分别设置了无氮(0N, 0 mmol L-1)、低氮(LN, 0.25 mmol L-1)和高氮(HN, 15.75 mmol L-1) 3 个不同浓度的硝酸盐营养液。将W82 分别种植在含有不同浓度硝酸盐营养液浸泡的蛭石基质中, 期间补充相同浓度营养液保证处理一致性。于萌发后15 d 取主根和侧根样品用于后续表达检测。
1.2.3 结瘤因子提取 结瘤因子是在宿主植物根系分泌的类黄酮作用下, 根瘤菌合成并分泌的一类多糖信号分子(脂壳寡糖), 可以激活结瘤因子信号通路。试验中将根瘤菌Bradyrhizobium diaefficiensUSDA 110 在28 ℃, 150 ×g震荡培养, 使OD600达到0.4~0.6 制成种子液。取5 mL 种子液加入250 mL TY培养基中, 28 ℃ , 150 ×g培养至OD600为0.8~1.0。加入0.25 mL 5 mmol L-1的染料木黄酮。将菌液7000 ×g离心10 min 去菌体, 上清液经1/5 体积正丁醇抽提2 次, 1/10 体积正丁醇抽提1 次, 之后利用旋转蒸发仪在80℃的条件下蒸干正丁醇, 用2 mL 蒸馏水溶解, 过滤灭菌后4℃黑暗保存。
1.2.4 大豆实生苗结瘤因子处理 在接种结瘤因子的试验中, 首先于低氮营养液浸泡的蛭石中萌发大豆, 萌发5 d 后于大豆根部接种1 mL 结瘤因子, 3 d 后收集根样品用于分析GmNRT1.2a和GmNRT1.2b的表达。分别用1 mL 蒸馏水和1 mL根瘤菌(OD600为0.08)接种的根样品用作对照, 取样方法同上。
1.2.5 总RNA 提取及基因表达检测 利用TRI pure 试剂提取总RNA, 并且使用RNA 反转录试剂完成模板cDNA 的合成。根据GmNRT1.2a和GmNRT1.2b基因的 CDS 序列设计实时荧光定量PCR 引物GmNRT1.2a-QF: 5′-TGTTCTTGGCAGGCTCAACT ACT-3′,GmNRT1.2a-QR: 5′-CTTCTGGTTCCTTGTTT GCAAT-3′,GmNRT1.2b-QF: 5′-TTCACTTAACAGTT GCTTCAACAGTAG-3′,GmNRT1.2b-QR: 5′-TCTTA CCCCTTGAGCGTGG-3′。按照北京天根公司的SuperReal PreMix Plus (SYBR Green)试剂盒操作说明, 以GmELF1b基因为内参基因, 引物序列为GmELF1b-QF: 5′-GTTGAAAAGCCAGGGGACA-3′,GmELF1b-QR: 5′-TCTTACCCCTTGAGCGTGG-3′。根据相对定量法ΔΔCT 公式计算结果。
1.2.6 基因克隆及过重组质粒构建 在构建
GmNRT1.2a和GmNRT1.2b过表达载体的过程中, 自Phytozome 数据库(http://www.phytozome.net/)获得GmNRT1.2a和GmNRT1.2b的CDS 序列, 二者序列长度分别为1758 bp 和1785 bp。选择植物表达载体pEGAD 作为GmNRT1.2a和GmNRT1.2b的过表达载体, 限制性酶切位点选择其上多克隆位点中的SmaI和BamHI, 具体引物序列为GmNRT1.2a-F: 5′-TCC CCCGGGATGGAATTAGAACAAAACCAGAG-3′,GmNRT1.2a-R: 5′-CGGGATCCTCAGTTGTTTGTAGT TCCTGTCC-3′,GmNRT1.2b-F: 5′-TCCCCCGGGAT GGAATTAGAACAAAACCAGAG-3′,GmNRT1.2b-R:5′-CGGGATCCTCAGTTGTTGTTTGTAGTTCCTG-3′。以cDNA 为模板扩增目的片段(图1-A), 将目的片段回收纯化后连接T 载体进行测序。之后将测序正确的目的基因片段通过酶切酶连的方式连入植物表达载体pEGAD (图1-B)中, 获得GmNRT1.2a和GmNRT1.2b的过表达载体35S::GmNRT1.2a与35S::GmNRT1.2b。将构建完成的重组质粒转化到大肠杆菌DH5α 中, 挑取阳性的单克隆接种LB 培养基进行扩大培养, 之后保菌并提取质粒转化发根农杆菌K599, 挑取阳性单克隆扩繁, 将菌液以1∶1 体积与30%甘油混合, 在液氮中速冻后保存于-80℃冰箱备用。
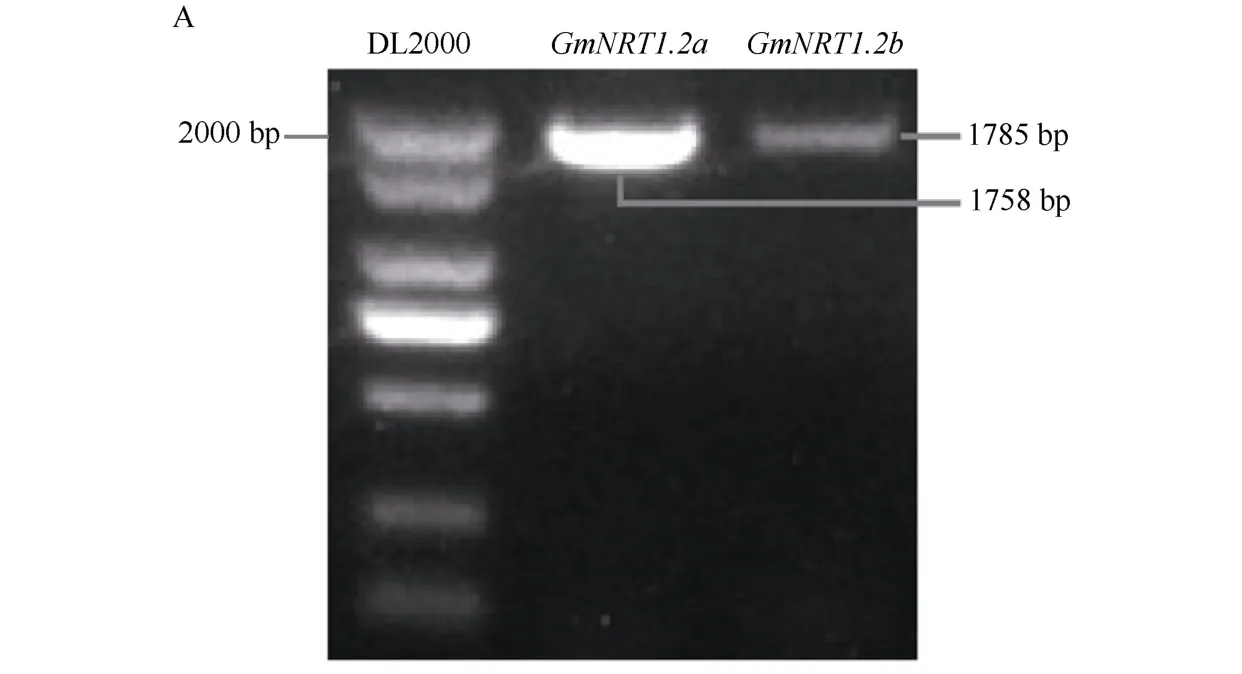
(图1)
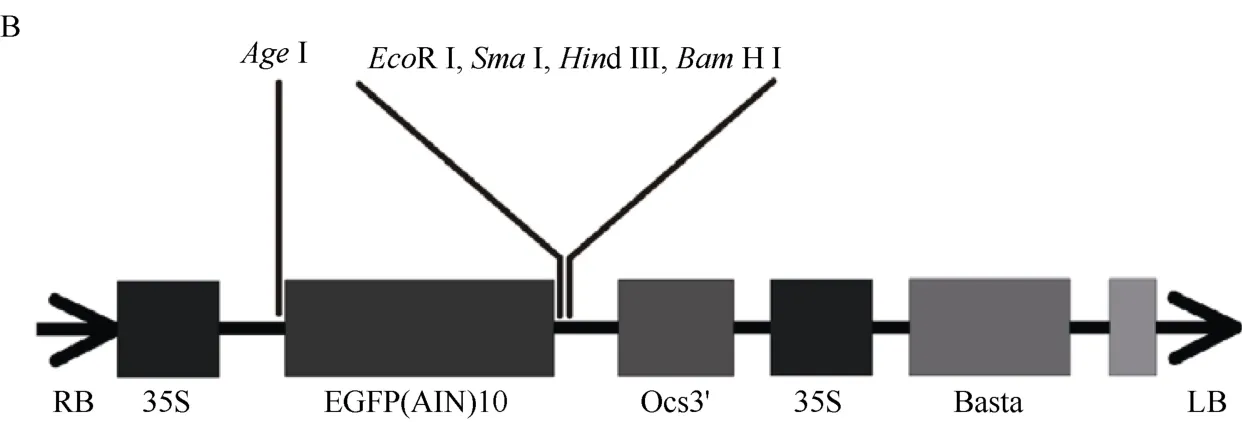
图1 GmNRT1.2a 和GmNRT1.2b 过表达载体构建Fig. 1 Construction of GmNRT1.2a and GmNRT1.2b overexpression vectors
1.2.7 大豆毛状根转化及根瘤表型观察 根据先前描述的方法[33-34]及本实验室已报道体系[19], 大豆萌发3~4 d 后, 将带有重组质粒的农杆菌K599 在3~4 mL LB 液体培养基中28℃下150 转 min-1震荡培养过夜(OD600为0.8~1.0)。以1∶1000 的比例将液体活化培养后的菌液接种于50 mL LB 液体培养基中进行继代培养, 并在培养基中以1∶1000 的比例加入质粒及K599 所带有的抗生素和0.2 mol L-1Acetosyringone (AS), 菌液培养至OD600值约0.8 后,将菌液离心, 弃上清液, 用50 mL 液体共培培养基(CCM)重悬菌液。挑选子叶完整未受损伤的发芽种子, 用解剖刀从胚轴上切下置于灭过菌的皿中(倒入少量菌液), 在子叶下端的0.1~0.2 cm 下胚轴处切开,切完之后将外植体在菌液中侵染1 h。侵染完成后将外植体放在带有被CCM 浸湿的滤纸的灭菌培养皿中, 将其放在暗下共培养3 d 后, 把外植体移到低氮浓度营养液浸泡的蛭石中培养, 期间使用低氮营养液与蒸馏水交替培养, 10 d 后接种根瘤菌(OD600为0.8~1.0), 每棵接种30 mL, 在接种根瘤菌28 d 后,观察根瘤表型, 拍照并统计根瘤数目, 之后取根样品进行后续的基因表达水平分析。
1.3 数据分析所用软件
借助 DNAMAN 7.0 设计相关引物, 使用GraphPad Prism 5.0 统计根瘤数目, 利用SigmaPlot 10.0 软件分析表达结果, 使用SPSS 13.0 分析差异显著性。
2 结果与分析
2.1 GmNRT1.2a 和GmNRT1.2b 的组织表达模式分析
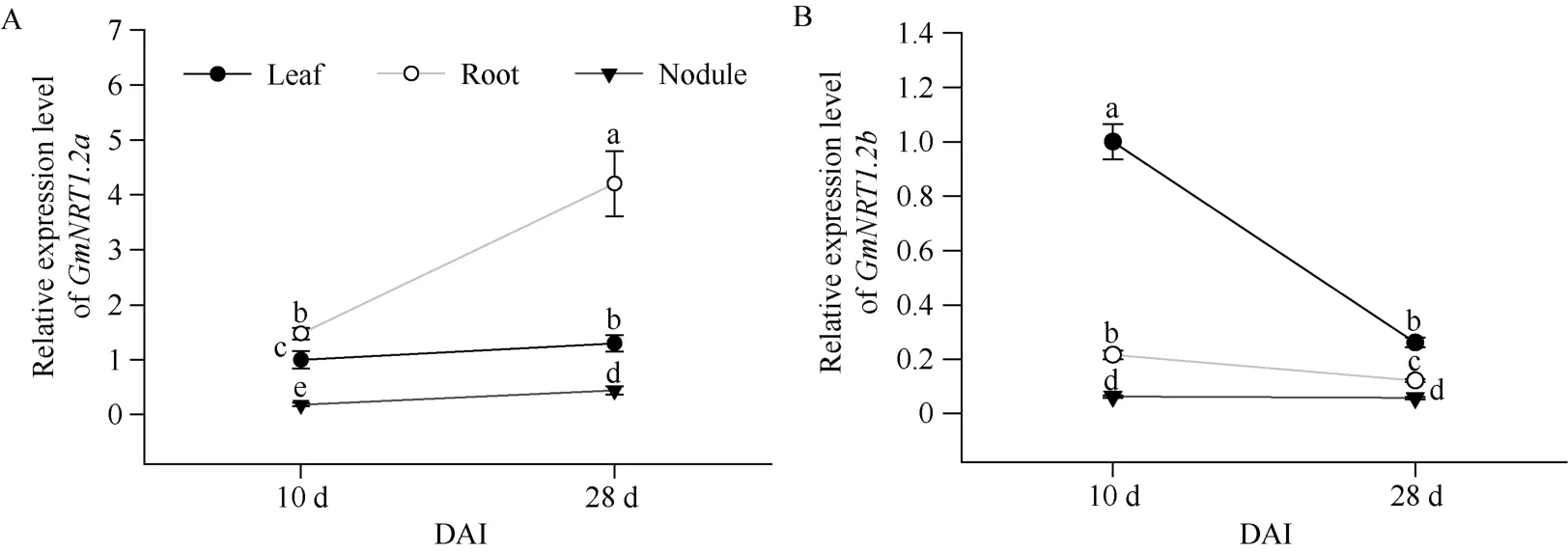
图2 GmNRT1.2a 和GmNRT1.2b 在大豆不同发育时期的组织表达模式分析Fig. 2 Expression pattern of GmNRT1.2a and GmNRT1.2b in different developmental stages of soybean
为了分析GmNRT1.2a和GmNRT1.2b的组织表达模式, 将W82 大豆种子种植到用低氮营养液浸泡的蛭石中, 在其生长到15 d 时接种根瘤菌, 分别在接菌后10 d 和28 d 取叶、根和根瘤不同组织的样品。提取所取样品 R N A 并反转录成 c D N A, 对GmNRT1.2a和GmNRT1.2b基因进行组织表达分析。由图2 可知,GmNRT1.2a和GmNRT1.2b在叶、根和瘤中均有表达, 且不同组织中表达量存在较大差异。GmNRT1.2a在10 d 和28 d 材料中有相同的表达趋势, 表达量根中最高, 叶中其次, 根瘤中最低。在28 d 材料的叶、根和根瘤中,GmNRT1.2a的表达量较其在10 d 材料中均有显著上升, 在根中表现更为明显。与此相比, 10 d 和28 d 材料中GmNRT1.2b在叶中表达量明显高于根和根瘤中, 而在28 d 材料的叶和根中其表达量都有明显下降, 该结果在叶中表现尤为明显。
2.2 GmNRT1.2a 和GmNRT1.2b 基因受硝酸盐诱导表达
为了验证不同浓度硝酸盐对GmNRT1.2a和GmNRT1.2b表达的影响, 本研究对大豆W82 材料分别进行0、0.25 和15.75 mmol L-1硝酸盐处理。取在不同氮浓度中萌发15 d 后的主根和侧根的混合样品,检测GmNRT1.2a和GmNRT1.2b的基因表达。由图3可知, 与其在无氮营养液中的表达水平相比, 随着氮浓度的升高,GmNRT1.2a和GmNRT1.2b的表达量有明显增加。表明GmNRT1.2a和GmNRT1.2b受硝酸盐尤其是高浓度硝酸盐的显著诱导表达。
2.3 GmNRT1.2a 和GmNRT1.2b 响应根瘤菌及结瘤因子的表达模式分析
为了分析GmNRT1.2a和GmNRT1.2b是否响应根瘤菌侵染, 本研究将W82 材料种植在用低氮营养液浸泡的蛭石中, 于萌发后5 d 每棵材料接种1 mL结瘤因子, 并以同时间点接种等体积根瘤菌或蒸馏水作为对照, 在处理3 d 后取主根和侧根的混合样品, 分别对GmNRT1.2a和GmNRT1.2b进行表达分析, 并且以之前已报道的响应结瘤因子信号的GmENOD40-1作为阳性对照。由图 4 可知,GmENOD40-1同时受到根瘤菌和结瘤因子诱导, 且受根瘤菌诱导更强。GmNRT1.2a和GmNRT1.2b的表达同时受到根瘤菌和结瘤因子诱导, 与其对根瘤菌侵染的响应模式相比, 二者受结瘤因子的诱导更为明显。推测它们可能通过经典的结瘤因子信号通路响应根瘤菌的侵染。

图3 GmNRT1.2a 和GmNRT1.2b 在不同浓度下的硝酸盐下的表达模式Fig. 3 Expression pattern of GmNRT1.2a and GmNRT1.2b under different concentrations of nitrate
2.4 过表达GmNRT1.2a 和GmNRT1.2b 增加根瘤数目
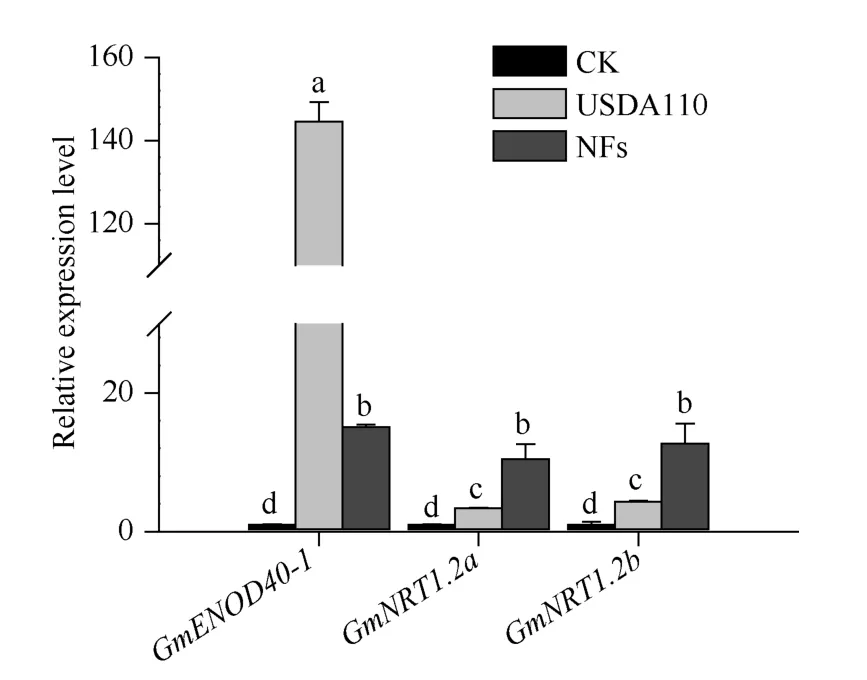
图4 GmNRT1.2a 和GmNRT1.2b 响应接种根瘤菌和结瘤因子表达模式分析Fig. 4 Expression patterns of GmNRT1.2a and GmNRT1.2b in response to rhizobium inoculation and nod factors treatment
为了进一步探究GmNRT1.2a和GmNRT1.2b对根瘤数目的影响, 利用毛状根转化体系分别将带有GmNRT1.2a和GmNRT1.2b过表达重组质粒转化大豆, 以空载体转化作为对照(EV)。在接种根瘤菌28 d后观察根瘤表型并取样, 由图5 可知,GmNRT1.2a或GmNRT1.2b过表达材料中, 其表达量同对照相比均显著升高(图5-A, B)。空载体对照(EV)转化的毛状根的根瘤平均数目为15.38, 而在过表达GmNRT1.2a与GmNRT1.2b的阳性毛状根中, 其平均结瘤数分别为39.60 个与24.63 个(图5-C, D)。说明低氮条件下过表达GmNRT1.2a或GmNRT1.2b都可以极大地增加大豆根瘤数目, 其中过表达GmNRT1.2a根瘤数目增加更明显, 表明GmNRT1.2a及GmNRT1.2b可能正向调控大豆结瘤。
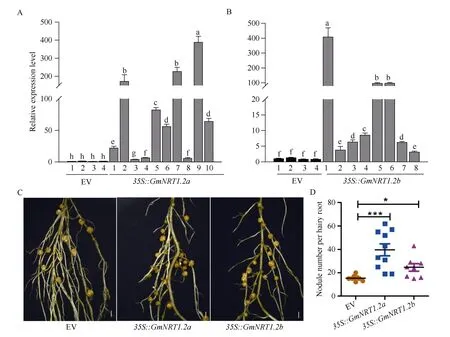
图5 在低氮培养条件下过表达GmNRT1.2a 或GmNRT1.2b 增加结瘤数目Fig. 5 Nodule number increased by 35S::GmNRT1.2a or 35S::GmNRT1.2b under low nitrate condition
3 讨论
近年来, 有关硝酸盐转运蛋白参与氮素营养吸收的研究已成为热点。目前的研究主要集中在拟南芥[35]、水稻[36-39]、番茄[40]、小麦[41]、油菜[42]等植物, 对于大豆中该类蛋白的功能研究报道较少, 尚处于起步阶段。由于物种的特异性, 不同物种的同源基因之间可能存在着功能的分化。大豆GmNRT1.2s的相关生物信息学分析结果也显示, 大豆GmNRT1.2s的碱基和氨基酸序列与拟南芥中的NRT1.2 存在一定差异[31]。另外, 拟南芥中ATNRT1.2s为组成型表达, 即不受硝酸盐的诱导[29-30], 而本研究中发现大豆GmNRT1.2a和GmNRT1.2b同时受到低浓度和高浓度硝酸盐诱导。除此之外, 大豆GmNRT1.2a在根中表达量最高,而GmNRT1.2b主要在叶中表达, 二者主要的表达部位有着明显的不同, 这一差异也在一定程度上暗示着二者可能在某些功能上存在差异。
相关研究结果证明,GmNRT1.2a和GmNRT1.2b过表达后导致大豆的根瘤数目均显著增加, 但是对于GmNRT1.2a和GmNRT1.2b的功能研究尚不完全。在之后的研究中可以利用RNA 干扰(RNA interference, RNAi)技术和 CRISPR 基因编辑技术对GmNRT1.2a和GmNRT1.2b的功能进行深入探究, 建立快速稳定的RNAi 与CRISPR 大豆毛状根转化体系, 对进一步研究GmNRT1.2a和GmNRT1.2b在结瘤过程中的作用具有重要意义。
基于大豆GmNRT1.2a和GmNRT1.2b受高浓度硝酸盐诱导, 并且在接种根瘤菌和结瘤因子后表达上调, 推测它们可能受某些转录因子调控, 后续研究可以通过生物信息学分析预测其上游转录因子,并通过酵母单杂技术进行文库筛选候选的转录因子,进一步利用ChIP-PCR 与EMSA 技术验证转录因子对GmNRT1.2a和GmNRT1.2b的调控。为了完善对GmNRT1.2a和GmNRT1.2b调控大豆结瘤的分子机制研究, 还可以开展其互作蛋白的预测及鉴定, 例如, 通过string 10 (https://string-db.org/)网站进行互作预测, 同时利用酵母双杂交及IP-MS 大规模寻找可能与GmNRT1.2a 和GmNRT1.2b 互作的蛋白, 从而更深入地解析GmNRT1.2a和GmNRT1.2b调控大豆结瘤的分子网络。
4 结论
GmNRT1.2a和GmNRT1.2b分别在大豆根和叶中表达最高。GmNRT1.2a和GmNRT1.2b受硝酸盐诱导表达, 且显著响应根瘤菌及结瘤因子处理。在毛状根转化体系中, 过表达GmNRT1.2a和GmNRT1.2b使大豆根瘤数目显著增加, 表明GmNRT1.2a和GmNRT1.2b在结瘤过程中发挥正向调控作用。
