凡纳滨对虾多酚氧化酶的纯化鉴定与生物信息学分析
2020-07-01刘蒙娜孙钦秀刘书成吉宏武郝记明邓楚津毛伟杰
魏 帅,刘 媛,刘蒙娜,孙钦秀,刘书成,吉宏武,郝记明,邓楚津,毛伟杰
凡纳滨对虾多酚氧化酶的纯化鉴定与生物信息学分析
魏 帅,刘 媛,刘蒙娜,孙钦秀,刘书成,吉宏武,郝记明,邓楚津,毛伟杰
(1. 广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研发中心,广东省海洋生物制品工程重点实验室,水产品深加工广东普通高校重点实验室,广东 湛江 524088;2. 海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁 大连 116034;3. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 524088)
【目的】从凡纳滨对虾()中分离纯化多酚氧化酶(Polyphenol Oxidase,PPO),进行质谱鉴定,分析其生物学信息。【方法】采用硫酸铵沉淀结合柱层析法从虾头胸部中提取纯化PPO,电泳法确定其分子质量,采用液相质谱联用法分析氨基酸序列结构,根据分析结果,同源建模并进行评估。【结果与结论】获得了高纯度的PPO,其纯化倍数为65.7,酶比活力达650.1 U/mg蛋白,得率为29.5%。PPO分子质量约为72 ku。经质谱检测分析和basic local alignment search tool(BLAST)序列比对,纯化蛋白与凡纳滨对虾酚氧化酶原的氨基酸序列相似性为65%,匹配度分值为11 321,确认为PPO。PPO是一种亲水性大于疏水性的两性蛋白,二级结构以α-螺旋和无规则卷曲为主,建立的PPO三维结构模型可靠性较高。
凡纳滨对虾;多酚氧化酶;质谱;鉴定;生物信息学
多酚氧化酶(Polyphenol oxidase,PPO)是动植物和真菌体内广泛存在的一种酶,分为单酚单氧化酶(酪氨酸酶tyrosinase,EC.1.14.18.1)、双酚氧化酶(儿茶酚氧化酶catechol oxidse,EC.1.10.3.2)与漆酶(laccase,EC.1.10.3.1)[1]。PPO可催化单酚羟基化形成二元酚及二元酚氧化成邻醌类[2]。通常PPO以酚氧化酶原(Propolyphenoloxidase,proPPO)形式存在,不具催化活性,但与模式识别蛋白、丝氨酸蛋白酶等一同构成复杂的proPPO激活系统。在生物体受到损伤或死亡后,一些外源多糖与模式识别蛋白结合,会激活proPPO生成PPO[3-5]。Cu2+结合区为PPO的主要功能区,N-端导肽和和C-端疏水区对酶的构象、高级结构的形成和维持起作用[1]。Cu2+结合区富含组氨酸(His)残基,每个Cu2+与3个His残基以配位键相连,形成了具有特定三维结构的活性部位[6]。
虾类捕获后如果未及时处理或处理不当,在后续的贮藏与加工过程中易发生黑变,尤其是在虾体头部、胸部以及尾部和关节处,这是由于PPO催化单酚生成二酚,氧化生无色醌类物质,在非酶促反应下聚合生成黑色素,导致虾黑变[7]。虾体黑变一旦发生就很难去除,虽然对虾营养价值影响较小,但对虾感官品质和商品价值影响较大,影响其市场销售和经济效益[8-9]。低温贮藏等手段可以在一定程度上保持虾的品质,延长贮藏期,但黑变问题仍然存在,需联合其它可能的手段进行控制[10],虾类黑变已成为目前限制虾类保鲜与加工的重要瓶颈技术问题之一。本研究从凡纳滨对虾出分离出高纯度PPO,分析其分子结构和理化特性以及分子生物学信息,以期根据其结构特点采用针对性处理降低其酶活或钝化,进而为研究控制对虾黑变技术提供相应基础。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾购于广东湛江市霞山区东风水产批发市场,选取质量均一〔(15±0.5)g〕鲜活虾,充氧保活运至实验室,自来水清洗后加冰猝死,立即取虾头胸部用于PPO提取。
聚氧乙烯月桂醚和左旋多巴胺[3-(3,4-Dihydroxyphenyl)--alanine,-DOPA]购于美国Sigma公司,三羟甲基氨基甲烷购于上海麦克林生化科技有限公司,Q Sepharose Fast Flow和Superdex 200填料购于通用电气(中国)有限公司,二辛可宁酸(bicinchonininc acid,BCA)蛋白质含量测定试剂盒、牛血清蛋白(bovine serum albumin,BSA)、十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electropheresis, SDS-PAGE)配制试剂盒、非变性PAGE蛋白上样缓冲液(5×)、SDS-PAGE蛋白上样缓冲液(5×)、考马斯亮蓝染色液购于上海碧云天生物技术有限公司,标准蛋白(Marker)购于广州鼎国生物科技有限公司,乙腈购于赛默飞世尔科技(中国)有限公司。
1.2 仪器设备
DLSB-10/20型低温冷却液循环泵(成都一科仪器设备有限公司),Cary 60型紫外可见分光光度计(安捷伦科技有限公司),Thermo Lynx 6000型高速落地离心机、Varioskan Flash型全自动酶标仪、Q-EXACTIVE型串联ESI质谱仪〔赛默飞世尔科技(中国)限公司〕,HH•S21-8-S型电热恒温水浴锅(上海圣科仪器设备有限公司),AKTA purifier 100型制备型蛋白质纯化系统〔通用电气(中国)公司〕,组织匀浆机(九阳股份有限公司),SLI-700型恒温培养箱(上海爱朗仪器有限公司),基质辅助激光解吸电离飞行时间质谱(德国布鲁克公司)。
1.3 实验方法
1.3.1 PPO分离纯化 PPO粗酶液的提取参考Nirmal等[11]法。称取新鲜凡纳滨对虾头胸部850 g,添加2 550 g磷酸盐缓冲液,捣碎匀浆静置3 h;离心后取上清液,添加固体硫酸铵至饱和度40 %,静置30 min;离心,沉淀溶于磷酸盐缓冲液中透析18 h,离心得到清液即为PPO液体,-70℃储存备用(以上操作均在4 ℃条件下进行)。
采用离子交换层析进行粗酶液纯化,参考Fan等[12]法。将45 mL粗酶液上样于Q Sepharose Fast Flow阴离子交换柱(2.6 cm × 30 cm),用Tris-HCl溶液洗脱,测定PPO酶活和蛋白质含量。凝胶层析时取上一步收集的PPO组分3 mL,上样于经平衡的Superdex 200凝胶层析柱(1.6 cm×70 cm),缓冲液洗脱时流速设为1 mL/min,收集洗脱液,每管2 mL,测定PPO酶活和蛋白质含量。合并高PPO活性的洗脱液,测总活力和总蛋白,用超滤管浓缩,-20 ℃储存备用。
1.3.2 PPO酶活力测定 参考黄万有等[13]法,取100 μL PPO液体加入400 μL 0.05 mol/L磷酸盐缓冲液(pH 6.0),加入600 μL 15 mmol/L L-DOPA溶液,45 ℃水浴反应3 min,检测光密度。用100 μL去离子水为空白对照。酶活定义:每分钟每毫升的酶在475 nm下光密度值每增加0.001为1 U,单位:U·min-1·mL-1。
PPO酶活力=(1-2)/(×)×1000,
其中,1为PPO的光密度值;2为空白对照的光密度值;为反应时间,min;为酶液的体积,mL。
1.3.3 蛋白质含量测定 以BSA标准品作为标准蛋白,96孔板中分别加入20 μL质量浓度0、0.025、0.050、0.100、0.200、0.300、0.400、0.500 mg/mL标准品,加入200 µL BCA工作试剂。取20 µL样品,加入200 µL BCA,60 ℃下孵育30 min,用酶标仪在562 nm波长下测其最大光密度值,绘制标准曲线,计算样品蛋白质含量。
1.3.4 电泳分析 将纯化的PPO浓缩液,采用SDS-PAGE检测分子质量。SDS-PAGE蛋白上样缓冲液(5×)与样品以1∶4的比例上样15 µL,上样量为50 μg,电泳完毕后,以考马斯亮蓝染色液染色胶条。采用Native-PAGE电泳检测其活性。分离胶和浓缩胶的体积分数分别为12%和5%,非变性PAGE蛋白上样缓冲液(5×)与样品以体积比1∶4的比例上样15 µL,上样量为50 μg,含样品的上样液未经煮沸,电泳完毕后,用15 mmol/L L-DOPA溶液染色胶条。
1.3.5 质谱分析 将含PPO的SDS-PAGE胶条切下,进行Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry(MALDI-TOF-MS)分析和Liquid chromatography-electrospray ionization-tandem mass spectrometry(LC-ESI- MS/MS)分析,Mascot及BLAST数据库检索比对氨基酸序列。
1.3.6 PPO生物信息学分析 根据测得的PPO氨基酸序列,采用Expasy站点分析预测PPO生物学信息[14],采用ProtParam分析PPO氨基酸组成和特性、ProtScale分析疏水性、GOR和predictprotein seartificial预测二级结构。用BLAST程序在蛋白质结构数据库Protein Data Bank(PDB)中搜索同源蛋白,采用SWISS-MODEL工作站进行三维结构同源建模,并在该工作站对建模结果进行评估。
1.4 统计分析
每个实验重复3次,数据用“平均值±标准差”表示;采用Excel进行方差分析和作图,生物信息学分析相关数据从各工作站读取。
2 结果与讨论
2.1 PPO的分离纯化
对粗酶液进行Q Sepharose Fast Flow离子交换柱层析,可较好分离PPO粗酶液,选取PPO活性较高的收集液进行凝胶层析柱分离。选取PPO酶活力和蛋白质含量都较高的收集液进行再次Q Sepharose Fast Flow离子交换柱层析,获取更高纯度的PPO,以PPO酶活最高的洗脱液进行实验,结果见图1。
A为凝胶层析分离图,B为凝胶层析洗脱液的酶活和蛋白质质量浓度(2 mL/管); C为离子交换层析分离图,D为离子交换洗脱液的酶活和蛋白质质量浓度(5 mL/管)
A means the separation chromatogram using superdex 200, B means the enzyme activity and protein content of the elution (2 mL/tube) using superdex 200; C means the ion exchange separation chromatogram, D means the enzyme activity and protein content of the elution (5 mL/tube) using ion exchange separation
图1 多酚氧化酶PPO凝胶层析谱图和离子交换柱层析图谱
Fig. 1 The separation chromatography using superdex 200 and ion exchange separation chromatography of PPO
凡纳滨对虾PPO粗酶液纯化结果见表1,纯化倍数达到65.7,酶比活力大大提高,达到650.1 U/mg蛋白。Chen等[15]用硫酸铵沉淀和和高效疏水性色谱柱纯化粉红虾和白对虾的PPO,纯化倍数为50,酶比活力为100 U/mg蛋白;用丁醇处理和高效疏水性色谱柱纯化粉红虾和白对虾的PPO,纯化倍数为200,酶比活力在320 U/mg蛋白以上。Rolle等[16]用硫酸铵沉淀和高效疏水性色谱柱(苯基琼脂糖CL-4B)纯化斑节对虾的PPO,纯化倍数和酶比活力为58和1.33 U/mg蛋白。樊廷俊等[17]用Sephacryl S-100凝胶柱和Q Sepharose Fast Flow阴离子交换柱纯化中国对虾的PPO,纯度达到30.2,酶比活力达258.0 U/mg蛋白。虾类PPO纯化方法较多,但其纯化效果不同,产生差异原因可能是由于PPO中酚类化合物浓度和类型不同影响了PPO与其他蛋白质的整体结合,目前已发现PPO-蛋白质会干扰蛋白质的纯化,该酶中所含的离子和疏水特性因与酚类物质的结合而随之改变,这也导致纯化过程中需选择不同的洗脱方式[18]。
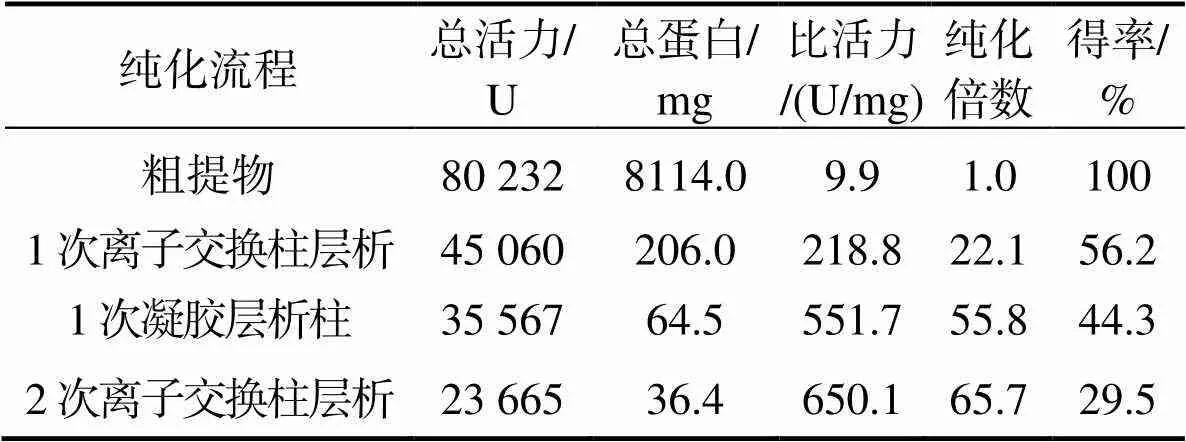
表1 凡纳滨对虾中多酚氧化酶PPO纯化
注:比活力 = 总活力/总蛋白质量,纯化倍数 = 各步骤分离组比活力/粗酶液比活力;得率 = 各步骤分离组分总活力/粗酶液总活力。
Note:Specific activity =total activity /total protein, purification fold = specific activity of each separation step / specific activity of crude extract; yield = total activity of each separation step / total activity of crude extract.
另外,不同品种虾PPO活性以及提取过程所携带杂质存在差异,各纯化方法效率也存在差异,所得到PPO纯度也不相同。
2.2 PPO分子质量
纯化后PPO的SDS-PAGE和Native-PAGE电泳图谱如图2所示,SDS-PAGE电泳中PPO在72 ku处有条带,经LC-MS/MS质谱鉴定,该条带为PPO。Native-PAGE电泳中PPO在210 ku处显示条带,与Nirmal等[8]实验结果一致。PPO分子质量大小依据电泳形式的不同而有所变化,此类蛋白以多聚体形式存在,尤其是在Native-PAGE中,而SDS-PAGE中因所带电荷不同引起的迁移率不一使分子质量分散且有所降低[19]。单个PPO亚基多为低分子质量,分别有71 ku[20]、40 ku[21]、97 ku、88 ku和82 ku[15],甲壳动物的PPO由于表面带电基团较少易形成聚集体[22]。PPO基因有两个区域,一是与铜离子有关的编码区,另一个是引导肽,PPO酶原含有引导肽,酶原去除引导肽后变成有活性的成熟PPO,不同品种虾中的引导肽分子质量不一致,导致PPO分子质量不同[23]。
2.3 PPO的质谱分析
SDS-PAGE胶上蛋白经MALDI-TOF-MS分析,确定72 ku处条带为PPO,为精确鉴定出所纯化PPO的氨基酸序列,进一步采用了LC-ESI-MS/MS进行分析。酶解后的胶上蛋白以多肽片段形式进入LC-ESI-MS/MS进行分析,确定有质谱信号,经Mascot数据库检索后鉴定出PPO,其蛋白质得分与蛋白中所含肽段得分结果见图3。匹配分值的计算方法为-10 lg,值为蛋白可以随机匹配的概率,根据Mascot评分判断(< 0.05),匹配值大于45时有统计学意义,根据此得分的蛋白质鉴定结果可信[24]。选择一级质谱中信噪比大于10的肽段进行LC-MS/MS分析,二级质谱结果共有26个肽段含455个氨基酸残基。将分析结果与BLAST数据库中氨基酸序列进行对比,与凡纳滨对虾的酚氧化酶原(序列号ABQ45957,分子质量为78.985 ku)的序列相似性为65 %,匹配度分值为11 321,等电点为6.05,氨基酸残基比对结果见图4。

M,标准蛋白,ku;1,PPO的SDS-PAGE电泳条带;2,PPO的Native-PAGE电泳条带。

图3 经LC-MS/MS分析后得到的Mascot检索
Fig .3 Mascot result of PPO from SDS-PAGE after LC-MS/MS

灰色背景字母为比对上的氨基酸残基
2.4 PPO的理化特性分析
利用ExPASy站点的ProtParam程序对PPO的氨基酸组成进行分析,分析结果如图5所示。PPO中含量最多的氨基酸为亮氨酸(Leu,9.4%),其次为精氨酸(Arg,7.5%)、天冬氨酸(Asp,7.5%)和缬氨酸(Val,7.1%)。对PPO活性中心起重要作用的组氨酸(His)和半胱氨酸(Cys)含量分别为3.6 %和0.7 %。PPO中疏水性氨基酸含量为43.4 %,分别为亮氨酸(Leu,9.4 %)、缬氨酸(Val,7.1 %)、丙氨酸(Ala,6.5 %)、脯氨酸(Pro,6.2 %)、苯丙氨酸(Phe,5.8 %)、蛋氨酸(Met,3.2 %)、异亮氨酸(Ile,3.8 %)和色氨酸(Trp,1.4 %)。亲水性最强的两种氨基酸为精氨酸(Arg)和赖氨酸(Lys),分别占7.5 %和4.1 %对PPO的理化特性进行分析(表2),不稳定指数是对蛋白质在实验中的稳定性评估,通常蛋白质的不稳定系数大于40时为不稳定蛋白,小于40时为稳定蛋白[25],PPO为不稳定蛋白。脂肪系数为脂肪族侧链所占的相对体积,该值被认为可能与提高球蛋白热稳定性有关,也可表征蛋白质的疏水性,数值越大表明疏水性越强[26],PPO的脂肪系数为78。平均亲水系数可用于表征蛋白质的疏水性,其范围一般在2与-2之间,大于0时为疏水蛋白,小于0时为亲水蛋白[27]。从表2可以看出,PPO既具有一定的亲水性,又具有一定疏水性,是一种两性蛋白。

图5 多酚氧化酶PPO的氨基酸组成分析

表2 多酚氧化酶PPO的理化特性
利用ExPASy中的ProtScale网站对PPO进一步作疏水性分析,氨基酸标度值为赋予每种类型氨基酸的数值。最常用的量表是疏水性或亲水性量表。Hphob./Kyte & Doolittle量表规定疏水性越强的氨基酸标度值越高,当蛋白质的氨基酸标度值大于0时为疏水性蛋白,小于0时为亲水性蛋白[25]。从图6可看出,PPO评分值既有正值也有负值,但稍偏向负值,PPO亲水性大于疏水性。
2.5 PPO的二级结构预测
蛋白质常见的二级结构主要有α-螺旋、β-折叠、β-转角和无规则卷曲等,它们是构成蛋白质三级结构的基本元素。利用PredictProtein seartificial和ExPASy中的GOR网站分别对凡纳滨对虾PPO二级结构进行预测。PredictProtein seartificial对二级结构的预测是以蛋白质的神经网络为依据,预期平均精度超过72%[28]。GOR算法以信息论为基础,同时考虑被预测位置氨基酸残基种类对该位置构象的影响及相邻残基种类对该位置构象的影响两个方面,物理意义清楚明确,数学表达严格,预测的成功率也在70%以上[29]。

纵坐标为氨基酸的标度值
PredictProtein seartificial预测PPO的二级结构主要是以卷曲形式(61.36%)和螺旋形式(24.89%)为主,折叠结构为13.75%,埋藏内部(51.23%)的氨基酸残基稍多于暴露表面(37.48%)的氨基酸残基。GOR预测PPO二级结构中α-螺旋结构占33.29%,β-折叠结构占15.92%,无规卷曲结构占50.8%。两种结构预测方法数据存在差异,但总体趋势是一致的,说明PPO是以卷曲和螺旋结构为主的一种蛋白质。预测的PPO二级结构种类和含量与凡纳滨对虾多酚氧化酶酶原的一致,这也说明了凡纳滨对虾proPPO与PPO在二级结构上是相似的。
2.6 PPO三维结构预测
将PPO序列在predictprotein结构预测软件进行相似性搜索,蛋白序列数为93,与PDB中结构的匹配数为31。蛋白同源性分析得到PPO假定保守域,含功能结构域血蓝蛋白-N、血蓝蛋白-M和血蓝蛋白-C,其中以血蓝蛋白-N和血蓝蛋白-C为主,同源性蛋白信息见表3,其中烟草天蛾酚氧化酶原晶体结构与PPO的同源性最高,达40%,蛋白编号为3HHS_B。
利用SWISS-MODEL工作站,以SMTL ID为3HHS.1的B链为模板进行建模,3HHS.1 B链与实验中凡纳滨对虾PPO序列具有40.36 %的一致性,氨基酸序列号覆盖范围为3 ~ 689,覆盖率为99%,满足同源建模同源性要求25% ~ 30%的标准。对PPO进行同源建模,其三维模型见图7。PPO三维结构中含4个配体,2个Cu2+单体(也为保守结合位点),配体3与链B H369、H373、F405、H409相连,配体4与链B H209、H213、H235相连,配体3和4无保守结合位点。

表3 多酚氧化酶PPO同源性蛋白分析结果

图7 SWISS-MODEL建模的PPO三维结构
对PPO的三维结构模型进行评估,包括整体模型质量评估(Global Model Quality Estimation,GMQE)、复合评分函数值(Qualitative Model Energy Analysis,QMEAN)、整体质量(Global Quality)、局部质量评估(Local Quality)和结构对比(Comparison)等,结果见图8。

A,局部质量评估;B,与PDB中非重复部分的对比
PPO三维结构模型的GMQE值为0.73,表明模型精度较高。PPO三维结构模型的QMEAN值为-3.17,且有“大拇指向上”标志,表明模型结构与类似结构之间有较好的一致性。数值为-4.0或以下表明模型质量非常低,分数旁边的“大拇指向上”符号会变为“向下”以强调。Local Quality表示模型的蛋白质长度(轴,以氨基酸计)与结构相似性(轴)之间的关系。通常显示分数低于0.6的残差预期质量很低,图8-A可以看出PPO三维结构模型残差质量较好。Comparison表示与高分辨率晶体结构得到的分数相比,轴为蛋白质长度(以氨基酸计),轴为归一化的QMEAN得分,每个点代表一个蛋白质结构。最黑的点表示QMEAN得分为-1和1之间的结构,|-Score | 1到2之间是灰色的,|-Score | 超过2为浅灰色,红星代表本模型。由图8-B得本模型的|-Score | 超过2。综合评估PPO三维结构模型具有较高可靠性。
3 结论
采用硫酸铵沉淀结合柱层析从凡纳滨对虾中提取并纯化到高纯度、高比活力PPO,得率为29.5%。经SDS-PAGE电泳分析,纯化PPO的分子质量为72 ku左右,LC-MS/MS进行鉴定,所得结果与数据库比较发现,与凡纳滨对虾的酚氧化酶原序列相似性为65%,匹配度分值为11 321。进一步对PPO进行生物信息学分析,发现其为两性蛋白,亲水性大于疏水性。PPO的二级结构以α-螺旋和无规则卷曲为主,在SWISS-MODEL工作站中建立了PPO三维结构模型,并对模型进行分析,确认建模结构可靠性较高。研究结果为对虾采取合理高效措施以防止和控制黑变提供了理论依据和研究基础。
[1] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222.
[2]GARCIA-MOLINA F, PENALVER M J, RODRIGUEZ-LOPEZ J N, et al. Enzymatic method with polyphenol oxidase for the determination of cysteine and N-acetylcysteine[J]. Journal of Agricultural and Food Chemistry, 2005, 53(16): 6183-6189.
[3] GÓMEZ-GUILLÉN M C, MARTÍNEZ-ALVAREZ Ó, LLAMAS A, et al. Melanosis inhibition and SO2residual levels in shrimps () after different sulfite-based treatments[J]. Journal of the Science of Food & Agriculture, 2005, 85(7):1143-1148.
[4] NIRMAL N P, BENJAKUL S. Inhibition of melanosis formation in Pacific white shrimp by the extract of lead () seed[J]. Food Chemistry, 2011, 128(2): 427-432.
[5] 刘蒙娜, 刘媛, 刘书成, 等. 3种巯基化合物对凡纳滨对虾多酚氧化酶的抑制效果和动力学[J]. 广东海洋大学学报, 2017, 37(3): 67-72.
[6] SHI C H, DAI Y, XU X L, et al. The purification of polyphenol oxidase from tobacco[J]. Protein Expression and Purification, 2002, 24(1): 51-55.
[7] GARCÍA-CARREÑO F L, COTA K, NAVARRETE DEL TORO M A. Phenoloxidase activity of hemocyanin in white leg shrimp: conversion, characterization of catalytic properties, and role in postmortem melanosis[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6454-6459.
[8] 陈胜军, 陶飞燕, 潘创, 等. 虾产品低温贮藏保鲜技术研究进展[J]. 中国渔业质量与标准, 2020, 10(1): 68-75
[9] 钱韻芳, 谢晶, 吴文惠. 虾类保藏过程中酚氧化酶酶促黑变作用机理及其抑制方法的研究进展[J]. 食品工业科技, 2012, 33(22): 400-405
[10] 施佩影, 李仁伟, 刘文营. 不同贮藏温度对南美白对虾黑变的影响[J]. 湖州师范学院学报, 2014, 36(8): 35-39.
[11] NIRMAL N P, BENJAKUL S. Biochemical properties of polyphenoloxidase from the cephalothorax of Pacific white shrimp ()[J]. International Aquatic Research, 2012, 4(1): 1-13
[12] FAN T J, JING Z, FAN X Y, et al. Purification and characterization of phenoloxidase from brine shrimp Artemia sinica[J]. Acta Biochimica et Biophys Sinica, 2011, 43(9): 722-728.
[13] 黄万有, 吉宏武, 刘书成, 等. 凡纳滨对虾PPO的组织分布和活性与其贮藏过程中黑变的关系[J]. 现代食品科技, 2014, 30(2): 89-94.
[14] 付友, 高谦, 文春根, 等. 鲤JAK2基因分子克隆及组织表达分析[J]. 广东海洋大学学报, 2015, 35(1): 8-17.
[15] CHEN J, CHAREST D J, MARSHALL M R, et al. Comparison of two treatment methods on the purification of shrimp polyphenol oxidase[J]. Journal of the Science of Food & Agriculture, 1997, 75(1):12-18.
[16] ROLLE R S, GUIZANI N, CHEN J S, et al. Purification and characterization of phenoloxidase isoforms from Taiwanese black tiger shrimp ()[J]. Journal of Food Biochemistry, 1991, 15(1): 17-32.
[17] 樊廷俊, 汪小锋. 中国对虾()酚氧化酶的分离纯化及其部分生物化学性质[J]. 生物化学与生物物理学报, 2002, 34(5):589-594.
[18] MAYER A M, HAREL E. Polyphenol oxidases in plants[J]. Phytochemistry, 1979, 18(2): 193-215.
[19]ZAMORANO J P, MARTÍNEZ-ÁLVAREZ O, MONTERO P, et al. Characterisation and tissue distribution of polyphenol oxidase of deepwater pink shrimp ()[J]. Food Chemistry, 2009, 112(1): 104-111.
[20]JAENICKE E, DECKER H. Tyrosinases from crustaceans form hexamers[J]. The Biochemical Journal, 2003, 371(Pt 2): 515-523.
[21] SIMPSON B K, MARSHALL M R, OTWELL W S. Phenoloxidases from pink and white shrimp: kinetic and other properties[J]. Journal of Food Biochemistry, 1988, 12(3): 205-218.
[22]ASPÁN A, SÖDERHÄLL K. Purification of prophenoloxidase from crayfish blood cells, and its activation by an endogenous serine proteinase[J]. Insect Biochemistry, 1991, 21(4): 363-373.
[23] 刘芳. 苹果膜结合态多酚氧化酶分离纯化及性质研究[D]. 北京: 中国农业大学, 2015.
[24] 于冰. 产絮菌的差异表达蛋白质及其功能解析研究[D]. 哈尔滨: 哈尔滨工业大学, 2011.
[25] 李晓曼. 乳清蛋白的肽谱和蛋白质组研究[D]. 哈尔滨: 哈尔滨工业大学, 2018.
[26] IKAI A. Thermostability and aliphatic index of globular proteins[J]. The Journal of Biochemistry, 1980, 88(6): 1895-1898.
[27] KYTE J, DOOLITTLE R F. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology, 1982, 157(1): 105-132.
[28] ROST B, SANDER C. Combining evolutionary information and neural networks to predict protein secondary structure[J]. Proteins: Structure, Function, and Bioinformatics, 1994, 19(1): 55-72.
[29] 石鸥燕, 杨晶, 杨惠云,等. 简单的一致性方法预测蛋白质二级结构[J]. 现代生物医学进展, 2007, 7(11):1723-1724.
Purification and Identification of PPO fromand Its Bioinformatics Analysis
WEI Shuai, LIU Yuan, LIU Meng-na, SUN Qin-xiu, LIU Shu-cheng, JI Hong-wu, HAO Ji-ming, DENG Chu-jin, MAO Wei-jie
(1.,,,,,,524088,; 2.,116034,; 3.(Zhanjiang),524088,)
【Objective】To isolate and purify the PPO from, the biological information was identified and analyzed by using mass spectrometry.【Methods】PPO was isolated and purified from the shrimp cephalothorax by using ammonium sulfate precipitation and column chromatography. The molecular weight was determined by electrophoresis, and the amino acid sequence was determined by liquid chromatography-electrospray ionization-tandem mass spectrometry (LC-ESI- MS/MS). Based on these results, homology modeling was constructed and the evaluations were performed.【Results and Conclusion】Purified PPO was obtained with a purification of 65.7 folds, the specific activity of PPO was 650.1 U/mg protein and with a yield of 29.5%. The molecular weight of PPO was about 72 ku. The similarity of amino acid sequence between the purified protein and Propolyphenoloxidase ofwas 65% with a matching score of 11 321 points by identification and analysis of mass spectrometry and basic local alignment search tool (blast) sequence comparison. The results have confirmed that the purified protein was PPO. PPO is an amphoteric protein and it has a higher hydrophilicity than hydrophobicity. The secondary structure of PPO mainly consists of α-helix and random coil. In conclusion, the predicted three-dimensional structure of PPO had a high reliability.
; PPO; mass spectrometry; identification; bioinformatics
Q78;Q959.223+.63
A
1673-9159(2020)04-0100-09
10.3969/j.issn.1673-9159.2020.04.014
2020-05-17
广东省区域联合基金-青年基金项目(2019A1515110419);国家重点研发计划资助(2019YFD0902003);国家自然科学基金面上项目(31771997);南方海洋科学与工程广东省实验室(湛江)资助(ZJW-2019-06);广东海洋大学创新强校重大培育项目(GDOU2017052603);国家虾蟹产业技术体系(G-48);广东省普通高校青年创新人才项目(2019KQNCX040);广东普通高等学校海洋食品绿色加工技术研究团队(2019KCXTD 011)
魏帅(1986—),男,博士,讲师,研究方向为海洋食品加工新技术。E-mail:weishuaiws@126.com
孙钦秀(1986—),女,博士,讲师,研究方向为海洋食品加工新技术。E-mail:sunqinxiugo@163.com;
刘书成(1977—),男,教授,研究方向为海洋食品加工新技术。E-mail:Lsc771017@163.com
魏帅,刘媛,刘蒙娜,等. 凡纳滨对虾多酚氧化酶的纯化鉴定与生物信息学分析[J]. 广东海洋大学学报,2020,40(4):100-108.
(责任编辑:刘朏)
