枸橼酸西地那非联合星状神经节阻滞对男性性功能障碍患者血管内皮功能的影响及机制研究
2020-07-01王伟张珑荆文李银芳赵新建闫付兰邓林清
王伟 张珑 荆文 李银芳 赵新建 闫付兰 邓林清
男性性功能障碍(SD)是男性群体常见的性疾病之一,具有较高发病率,对患者身心健康和生活质量产生严重影响[1,2]。SD发病机制复杂,目前尚未阐明。有研究表明,血管内皮功能障碍在SD发生及进展中发挥重要作用[3]。我们前期研究采用枸橼酸西地那非联合星状神经节阻滞(SGB)治疗SD取得了令人满意的临床疗效。结果显示,联合治疗能够显著改善SD患者勃起功能、精子质量及性生活质量,并降低复发率,但其治疗机制尚不清楚[4]。本研究观察枸橼酸西地那非联合SGB对SD患者血管内皮功能的影响,并从炎性反应和氧化应激方面探讨其治疗机制。
1 资料与方法
1.1 一般资料 选择2011年6月至2012年10月我院收治的SD患者104例,随机分为对照组和研究组,每组52例。对照组:年龄23~67岁,平均年龄(40.38±6.22)岁;病程0.5~12年,平均(3.24±0.98)年;轻度32例,中度15例,重度5例。研究组:年龄22~65岁,平均年龄(39.45±6.13)岁;病程0.5~12年,平均(3.16±0.95)年;轻度30例,中度18例,重度4例。2组基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准:①患者阴茎勃起困难,性功能异常,符合SD诊断标准[5];②病程>3个月;③患者自愿加入本研究,且签署知情同意书。
1.2.2 排除标准:①入组前3个月内接受过相关治疗;②合并心、肝、肺、肾等重要脏器功能障碍者;③引起SD的器质性疾病患者,如生殖器畸形、糖尿病、高血压等;④药物、酗酒、吸毒等其他原因引起的SD患者;⑤对本研究药物过敏者;⑥依从性差者。
1.3 治疗方法 对照组给予枸橼酸西地那非治疗,50 mg 性生活前1 h口服,1~3次/周,后期可视药效调整剂量,疗程4周。研究组在口服枸橼酸西地那非基础上给予SGB治疗。方法如下:患者取仰卧位,颈前部肌肉保持松弛状态,皮肤常规消毒后将患者颈总动脉、胸锁乳突肌推向外侧,选择第六颈椎横突处垂直进针穿刺,直至触及骨质,回抽后确保无脑脊液、血液流出,注入2% 利多卡因3 ml+0.9%氯化钠溶液5 ml,隔日1次,共治疗15次。
1.4 观察指标
1.4.1 标本采集:抽取患者空腹静脉血10 ml,置于2个EDTA抗凝管中(5 ml/管),一管常规离心后分离血清,另一管采用Ficoll密度梯度离心法提取外周血单个核细胞(PBMCs)。
1.4.2 性激素:采用电化学发光仪测定总睾酮(TT)、游离睾酮(FT)、性激素结合球蛋白(SHBG)含量。
1.4.3 血管内皮功能:采用硝酸还原酶法测定一氧化氮(NO)含量;放射免疫法测定内皮素(ET-1)含量;血管彩超测定肱动脉血流介导的血管舒张功能(FMD)。
1.4.4 炎性因子:采用酶联免疫吸附实验(ELISA)测定白介素6(IL-6)、肿瘤坏死因子-α(TNF-α)、超敏C-反应蛋白(hs-CRP)含量。
1.4.5 氧化应激:采用酶联免疫吸附法(ELISA)测定丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)含量。
1.4.6 SIRT1 mRNA:采用Real time-PCR测定沉默信息调节因子2相关酶1(SIRT1)mRNA表达。Trizol提取PBMCs总RNA,逆转录合成cDNA第1链, ABI 7500型荧光定量PCR仪上进行扩增反应,根据各样本测得的Ct值,以2△△Ct表示各样本相对表达量。
1.4.7 SIRT1蛋白:采用Western blot测定SIRT1蛋白表达。提取PBMCs总蛋白, 10% SDSPAGE电泳分离,电转移至PVDF膜上,10%脱脂奶粉封闭2 h,分别加入特异性一抗、二抗,TBST洗膜3次。ECL化学发光法显色、定影,设GAPDH为内参照基因。
2 结果
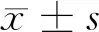
2.1 2组性激素比较 2组治疗后TT、FT、SHBG均较治疗前显著提高(P<0.05),且研究组TT、FT、SHBG变化幅度大于对照组(P<0.05)。见表1。
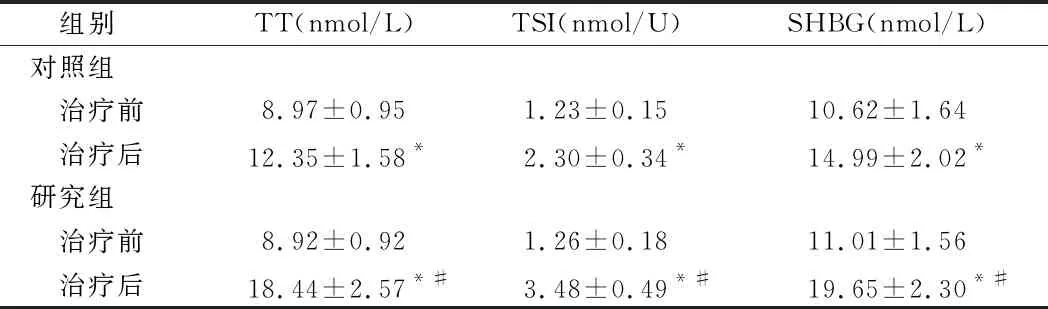
组别TT(nmol/L)TSI(nmol/U)SHBG(nmol/L)对照组 治疗前8.97±0.951.23±0.1510.62±1.64 治疗后12.35±1.58*2.30±0.34*14.99±2.02*研究组 治疗前8.92±0.921.26±0.1811.01±1.56 治疗后18.44±2.57*#3.48±0.49*#19.65±2.30*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.2 2组血管内皮功能比较 2组治疗后NO、FMD均较治疗前显著提高,ET-1均较治疗前显著降低(P<0.05),且研究组NO、ET-1、FMD变化幅度大于对照组(P<0.05)。见表2。
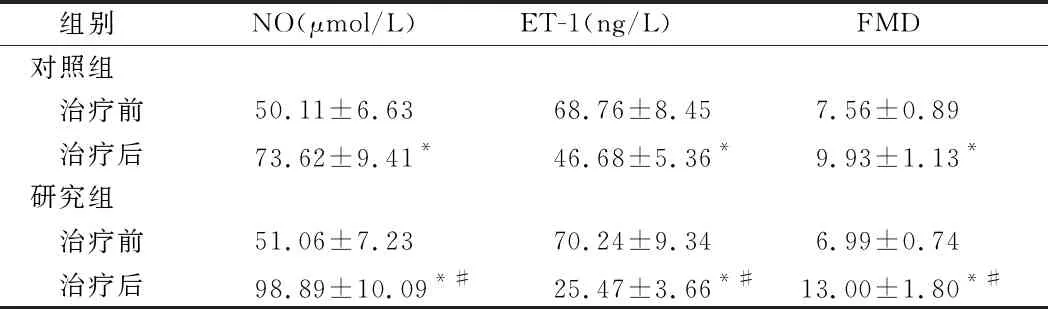
组别NO(μmol/L)ET-1(ng/L)FMD对照组 治疗前50.11±6.6368.76±8.457.56±0.89 治疗后73.62±9.41*46.68±5.36*9.93±1.13*研究组 治疗前51.06±7.2370.24±9.346.99±0.74 治疗后98.89±10.09*#25.47±3.66*#13.00±1.80*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组炎性因子比较 2组治疗后IL-6、TNF-α、hs-CRP均较治疗前显著降低(P<0.05),且研究组IL-6、TNF-α、hs-CRP变化幅度大于对照组(P<0.05)。见表3。
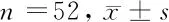
组别IL-6(ng/L)TNF-α(mg/L)hs-CRP(mg/L)对照组 治疗前14.15±2.145.20±0.633.25±0.46 治疗后10.64±1.56*3.79±0.56*2.49±0.37*研究组 治疗前13.56±1.895.23±0.583.20±0.50 治疗后6.03±0.75*#2.12±0.34*#1.52±0.22*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 2组氧化应激比较 2组治疗后MDA均较治疗前显著降低,SOD、GSH-Px均较治疗前显著提高(P<0.05),且研究组MDA、SOD、GSH-Px变化幅度大于对照组(P<0.05)。见表4。
2.5 2组SIRT1表达比较 2组治疗后SIRT1 mRNA和蛋白表达均较治疗前显著提高(P<0.05),且研究组SIRT1 mRNA和蛋白表达变化幅度大于对照组(P<0.05)。见表5。
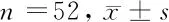
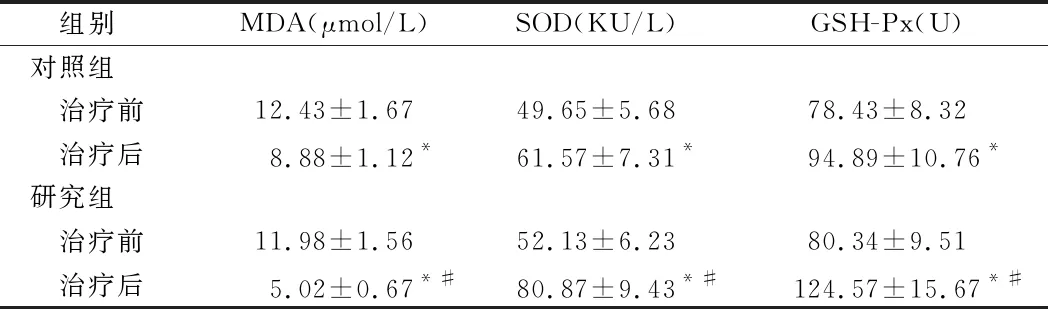
组别MDA(μmol/L)SOD(KU/L)GSH-Px(U)对照组 治疗前12.43±1.6749.65±5.6878.43±8.32 治疗后8.88±1.12*61.57±7.31*94.89±10.76*研究组 治疗前11.98±1.5652.13±6.2380.34±9.51 治疗后5.02±0.67*#80.87±9.43*#124.57±15.67*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
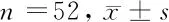

组别SIRT1 mRNASIRT1蛋白对照组 治疗前0.98±0.120.89±0.10 治疗后1.25±0.18*1.18±0.15*研究组 治疗前0.95±0.160.91±0.12 治疗后1.57±0.23*#1.47±0.20*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3 讨论
有报道提出,我国乃至全球范围内SD患病率逐年上升,SD在40~70岁的男性群体中患病率高达52%左右[6,7]。该病主要是由于阴茎勃起障碍、射精障碍、性欲障碍等原因导致无法完成满意的性生活,不仅影响患者身心健康,也给其家庭生活带来困扰[8]。 迄今为止,SD尚无系统性治疗措施,药物治疗效果欠佳。
目前,口服枸橼酸西地那非是临床治疗SD的首选治疗方案,该药是一种磷酸二酯酶抑制剂,通过抑制其水解活性增加阴茎组织cGMP含量,后者具有促进阴茎平滑肌松弛作用并增加海绵体血液充盈量,从而改善阴茎勃起功能和射精功能[9]。星状神经节阻滞(SGB)是目前应用于疼痛性和非疼痛性疾病的一种微创治疗手段,可通过调节性激素分泌和交感神经活性、增加NO含量等作用促进SD患者射精功能恢复[10,11]。我们前期研究采用枸橼酸西地那非联合SGB治疗SD患者,结果显示联合治疗组疗效优于单用枸橼酸西地那非治疗组。但是,联合治疗组发挥药理作用的可能机制仍未阐明。
阴茎勃起是神经、血管、内分泌等多种因素共同参与的复杂过程。研究显示,SD患者血清性激素含量显著降低,与阴茎勃起功能障碍密切相关[12]。血管内皮功能异常是各种原因导致SD的共同病理机制之一[13,14]。血管内皮功能异常将导致阴茎组织微循环障碍、海绵体平滑肌收缩及阴茎血流量减少,从而抑制阴茎勃起功能。因此,改善血管内皮功能被认为是治疗SD的重要靶点之一。NO、FMD、ET-1是反映血管内皮功能的主要指标,其中NO是血管平滑肌细胞分泌的小分子物质,可促进血管平滑肌舒张;FMD是评估血管内皮舒张程度的常用指标;ET-1是血管内皮细胞分泌的一种细胞因子,能够拮抗NO的舒血管作用,从而发挥强烈的血管收缩作用。本研究结果显示,治疗后,2组TT、FT、SHBG、NO、FMD均较治疗前显著提高,ET-1均较治疗前显著降低(P<0.05),且研究组以上指标变化幅度大于对照组(P<0.05)。说明枸橼酸西地那非联合SGB能够发挥协同作用,显著提高SD患者血清性激素含量,改善血管内皮功能,疗效优于单独枸橼酸西地那非治疗。
研究证实,血管内皮功能异常与炎性反应、氧化损伤、细胞凋亡等多种因素有关。其中炎性因子参与阴茎勃起过程,其分泌过多直接导致SD发生发展。IL-6、TNF-α、hs-CRP是机体重要的炎性因子,检测其含量可作为SD发病的预测因子[15]。氧化应激在SD患者血管内皮损伤中同样发挥重要作用。其中MDA是反映氧化应激损伤程度的主要指标,而SOD、GSH-Px是机体发挥抗氧化作用的酶。本研究结果显示,治疗后,2组SOD、GSH-Px均较治疗前显著提高,IL-6、TNF-α、hs-CRP、MDA均较治疗前显著降低(P<0.05),且研究组以上指标变化幅度大于对照组(P<0.05),提示枸橼酸西地那非联合SGB能够有效抑制SD患者机体炎性因子分泌和氧化应激,从而改善血管内皮功能。
SIRT1是一种NAD依赖性去乙酰酶,具有调控转录因子、组蛋白和非组蛋白表达等作用,参与包括能量代谢、凋亡等生理和病理过程[16]。有研究表明,SIRT1能够激活eNOS,促进NO的合成和释放,从而导致血管舒张[17]。本研究结果显示,治疗后,2组SIRT1 mRNA和蛋白表达均较治疗前显著提高(P<0.05),且研究组SIRT1 mRNA和蛋白表达变化幅度大于对照组(P<0.05),提示枸橼酸西地那非联合SGB治疗SD能够通过上调SIRT1表达发挥抗炎、抗氧化及血管内皮保护作用。
综上所述,枸橼酸西地那非联合SGB能够显著提高SD患者机体性激素含量,并改善血管内皮功能,其机制与调节SIRT1表达,从而抑制炎性反应和氧化应激有关。以SIRT1为靶点有可能为SD治疗提供新思路和新方法。
