不同剂量CRRT对严重脓毒症患者免疫功能、肠黏膜屏障功能及预后转归的影响研究
2020-07-01白准刘旭丽曾维忠彭苏娜吴双华
白准 刘旭丽 曾维忠 彭苏娜 吴双华
脓毒症是一种全身性的炎性反应疾病,可由大手术、烧伤、创伤、感染等因素诱发,具有病情危重、预后差等特点。当脓毒症患者合并有脓毒性休克或器官功能衰竭,称为严重脓毒症[1]。严重脓毒症可促使机体多器官功能障碍,增加脓毒症患者的病死率,最高可高达70%[2]。其可由炎性反应加重、胃肠道功能障碍、凝血功能紊乱及免疫功能低下等因素引起,其中肠道黏膜屏障功能损伤是其最为常见及主要的诱发因素。脓毒症可损伤肠道黏膜屏障功能,而肠道黏膜屏障功能损伤也可促发或加剧脓毒症,进而导致多器官脏器功能衰竭[3]。故保护肠黏膜屏障功能对于防治严重脓毒症有重要意义。连续性肾脏替代疗法(CRRT)通过超滤、吸附及滤过等步骤可清除炎性因子、有毒物质,平衡代谢紊乱,稳定内环境,既往常应用于肾脏疾病治疗[4]。随着重症医学的发展,CRRT目前已在急性出血坏死性胰腺炎、多器官功能衰竭、脓毒症等危重疾病中广泛应用。但是不同剂量的CRRT治疗剂量应用在严重脓毒症中治疗效果也不尽相同,基于此本研究旨在探讨不同剂量CRRT对严重脓毒症患者免疫功能、肠黏膜屏障功能及预后转归的影响,报告如下。
1 资料与方法
1.1 一般资料 选择2016年5月至2019年3月于我院就诊收治的92例行CRRT治疗的严重脓毒症患者为研究对象,对患者临床及随访资料进行回顾性分析。根据治疗剂量不同分为A组(20 ml/kg)29例,B(40 ml/kg)32例,C组(60 ml/kg)31例。A组:男18例,女11例;年龄30~70岁,平均年龄(52.01±4.26)岁;诱因:创伤感染8例,重症胰腺炎10例,烧伤后感染7例,其他4例。B组:男20例,女12例;年龄31~68岁,平均年龄(51.85±4.31)岁;诱因:创伤感染7例,重症胰腺炎11例,烧伤后感染9例,其他5例。C组:男20例,女11例;年龄32~69岁,平均年龄(52.83±4.32)岁;诱因:创伤感染10例,重症胰腺炎10例,烧伤后感染8例,其他3例。3组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准:①患者均符合2014年版中华医学会重症医学分会制定的《中国严重脓毒症/脓毒性休克治疗指南》中相关诊断标准[5];②患者均能正常的阅读、听写及交流;③患者及家属知晓本研究治疗方案,并签署知情同意书。
1.2.2 排除标准:①近期应用过免疫抑制剂、激素、抗生素等药物治疗者;②合并慢性疾病终末期、胃肠道恶性肿瘤者;③既往有胃肠道手术史者;④合并能增加病死率的因素这:如脑死亡、外伤所致严重颅脑损伤、完全房室传导等;⑤合并严重脏器功能不全者。
1.3 治疗方法 患者入院后均予以治疗病因、液体复苏、抗感染、生命支持、保护脏器功能、纠正内环境等常规治疗。所有患者在常规治疗基础上进行CRRT,采用德国O3血液净化仪治疗,以低分子肝素钙抗凝,操作如下:双腔导管留置在颈内静脉或股静脉建立血管通道,通过前稀释及连续性静脉-静脉血液滤过方法,血流量设置为160~250 ml/min,连续治疗24 h。A组的治疗剂量为20 ml·kg-1·h-1,B组的治疗剂量为40 ml·kg-1·h-1,C组治疗剂量为60 ml·kg-1·h-1。3组患者均治疗1周。
1.4 观察指标
1.4.1 炎性指标:患者治疗前后抽取静脉血酶联免疫吸附法(ELISA)检测白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平,免疫透射比浊法检测C-反应蛋白(CRP)水平。
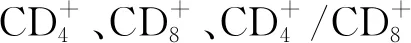
1.4.3 肠黏膜屏障功能生化指标:患者治疗前后抽取静脉血酶联免疫吸附法(ELISA)检测血浆细菌内毒素(BT)、血浆二胺氧化酶(DAO)水平,血浆D-乳酸(D-Lac)采用分光光度法检测。
1.4.4 预后指标:通过急性生理学及慢性健康状况评分(APACHEⅡ)、序贯器官衰竭估计评分(SOFA)对患者的病情预后情况进行评估。APACHEⅡ评分最高为71分,总评分越高表明患者预后越差,死亡危险性越大。SOFA总评分为24分,分数越低表明预后越好。
2 结果
2.1 3组患者治疗前后炎性指标水平比较 3组患者治疗后IL-6、TNF-α、CRP水平均较治疗前下降(P<0.05),且B组、C组各炎性指标水平下降程度高于A组,C组各炎性指标水平下降程度高于B组(P<0.05)。见表1。
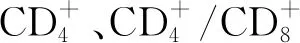


组别IL-6(pg/ml)治疗前治疗后TNF-α(ng/L)治疗前治疗后CRP(mg/ml)治疗前治疗后A组(n=29)178.62±23.7572.52±12.85*357.25±45.86258.63±22.23*42.96±13.0129.02±8.91*B组(n=32)176.28±24.0146.24±8.38*#359.01±46.01172.38±19.25*#43.01±13.1522.35±6.32*#C组(n=31)177.58±24.1226.45±7.86*#△358.86±46.12121.25±16.76*#△41.98±12.9613.02±4.01*#△F值0.070352.1600.010379.2600.06043.880P值0.930<0.0010.987<0.0010.941<0.001
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05

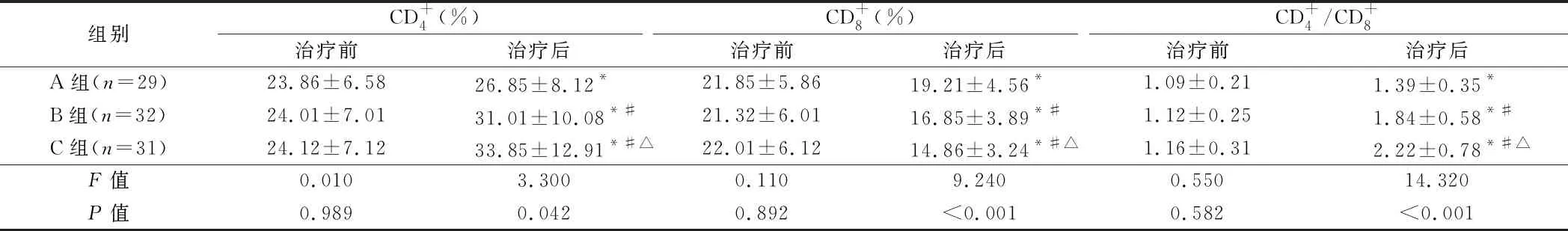
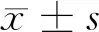
组别CD+4(%)治疗前治疗后CD+8(%)治疗前治疗后CD+4/CD+8治疗前治疗后A组(n=29)23.86±6.5826.85±8.12*21.85±5.8619.21±4.56*1.09±0.211.39±0.35*B组(n=32)24.01±7.0131.01±10.08*#21.32±6.0116.85±3.89*#1.12±0.251.84±0.58*#C组(n=31)24.12±7.1233.85±12.91*#△22.01±6.1214.86±3.24*#△1.16±0.312.22±0.78*#△F值0.0103.3000.1109.2400.55014.320P值0.9890.0420.892<0.0010.582<0.001
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05
2.3 3组患者治疗前后肠黏膜屏障功能生化指标水平比较 3组患者治疗后BT、DAO、D-Lac水平均较治疗前下降(P<0.05),与A组比较B组、C组BT、DAO、D-Lac水平下降明显(P<0.05),与B组比较C组CBT、DAO、D-Lac水平下降明显(P<0.05)。见表3。

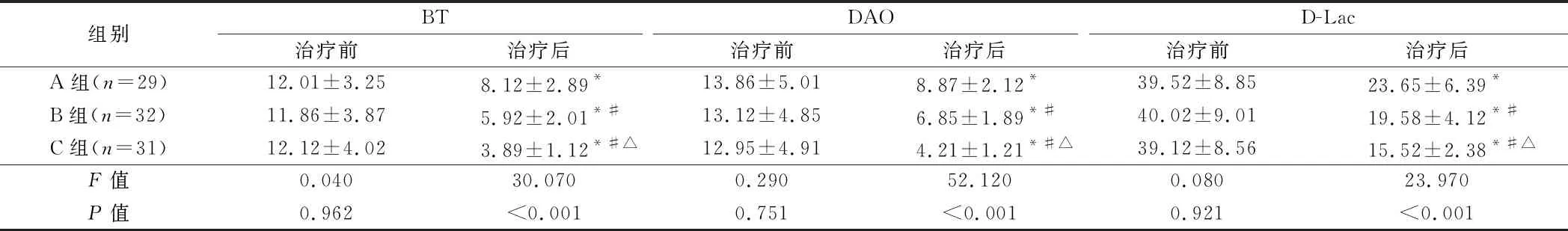
组别BT治疗前治疗后DAO治疗前治疗后D-Lac治疗前治疗后A组(n=29)12.01±3.258.12±2.89*13.86±5.018.87±2.12*39.52±8.8523.65±6.39*B组(n=32)11.86±3.875.92±2.01*#13.12±4.856.85±1.89*#40.02±9.0119.58±4.12*#C组(n=31)12.12±4.023.89±1.12*#△12.95±4.914.21±1.21*#△39.12±8.5615.52±2.38*#△F值0.04030.0700.29052.1200.08023.970P值0.962<0.0010.751<0.0010.921<0.001
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05
2.4 3组患者治疗前后预后指标水平比较 3组患者治疗后APACHEⅡ、SOFA评分均较治疗前下降(P<0.05),与A组比较B组、C组APACHEⅡ、SOFA评分水平下降明显(P<0.05),与B组比较C组APACHEⅡ、SOFA评分水平下降明显(P<0.05)。见表4。

表4 3组患者治疗前后预后指标水平比较 分,
注:与治疗前比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05
3 讨论
脓毒症的治疗有一定的难度,且病死率高,是临床上常见的危重疾病。当脓毒症患者因各种因素表现为少尿、酸中毒及意识改变即为严重脓毒症,这也是脓毒症患者病死率高的重要原因[6,7]。炎性反应不可控导致的机体紊乱是脓毒症发生发展公认为最为主要的原因。当致病菌侵袭机体时,其所生成的物质如内毒素等可激活机体内环境免疫功能,生成大量的CRP、TNF-α、IL-6等炎性介质,释放入血,导致不可控的炎性反应发生,从而进展为脓毒症[8]。严重脓毒症患者大多伴有机体多器官功能障碍,其中胃肠道是其最常见且最易受累的器官[9]。肠黏膜屏障有着保持菌群平衡,隔绝肠道病原微生物及细菌的作用。脓毒症常可损伤肠黏膜屏障功能,引起肠道菌群失衡,免疫功能降低,增加胃排空延迟、喂养不耐受综合征并发症发生的危险性,这也是增加患者死亡率及住院时间的主要因素[10]。反之肠黏膜屏障功能受损可释放内毒素,引起肠道菌群失衡及菌群移位促进脓毒症的发生发展,二者相互影响,形成恶性循环,从而对患者预后造成严重威胁[11]。
BT、DAO、D-Lac均是临床上反映肠黏膜屏障功能的常用生化指标。内毒素是一种革兰氏阴性菌细胞壁的脂多糖成分,正常情况下内毒素广泛存在于机体肠道中,但肠黏膜屏障功能受损时,可增大肠黏膜通透性,细菌内毒素可入血,从而引发内毒素血症[12]。DAO在肠黏膜上皮绒毛细胞中广泛存在,尤为回肠及空肠中浓度较高。当各种病因损伤肠黏膜上皮时DAO可释放进入血液中,从而可升高其血液中浓度[13]。D-Lac是细菌发酵产生的代谢产物,常用于反映肠通透性及黏膜受损,机体正常情况下肠道中存在各种细菌,当肠黏膜屏障功能受损时可导致菌群失衡,过度增生条件致病菌,从而引起血中进入大量的代谢产物D-Lac,升高其血液中浓度[14]。
CRRT目前是临床上救治脓毒症的重要手段之一,其相比传统药物有着更为有效、快捷的作用。其通过体外循环,可连续性的对炎性介质及内毒素起到清除作用,且可动态调节内环境电解质及体液容量负荷,抑制Th1细胞向Th2细胞转变,降低了淋巴细胞的异常凋亡率。其通过清除炎性介质,阻止了炎性介质损伤肠黏膜屏障功能,缓解了炎性介质直接抑制免疫细胞功能的作用,从而可起到保护肠黏膜屏障,调节免疫功能的作用[15]。但是目前在临床上尚未统一CRRT的治疗剂量,不同治疗剂量的CRRT治疗效果也不尽相同。在本研究结果中,B、C组炎性因子指标下降水平优于A组,免疫功能指标改善程度优于A组(P<0.05);C组炎性因子指标下降水平优于B组,免疫功能指标改善程度优于B组(P<0.05),可提示为较大剂量CRRT相较于小治疗剂量,减轻炎性反应,调节免疫功能作用更为显著。而BT、DAO、D-Lac水平及APACHEⅡ、SOFA评分也是随着治疗剂量增加呈现下降的趋势(P<0.05),可提示为较大剂量CRRT相较于小剂量,对于肠黏膜屏障功能保护更为显著,更有利于预后转归。这可能和其减轻炎性反应,调节免疫功能作用更为明显相关,也符合既往吴晓弟等[16]研究结果。但是本研究仅对比了3种剂量,到底哪一种CRRT剂量为最适剂量及剂量的最高阀值临床日后还需进一步增大样本含量进行探讨。
综上所述,不同剂量CRRT可有效的改善严重脓毒症患者免疫功能,提高肠黏膜屏障功能保护能力,降低炎性因子水平,促进预后转归。
