不同角膜接触镜对角膜内皮细胞形态的影响研究
2020-07-01唐平李雷陈执吕博琦李蒙恩
唐平 李雷 陈执 吕博琦 李蒙恩
人角膜正常的透明性和厚度和透明性是通过角膜内皮细胞的屏障功能和主动液泵来维持的,在正常情况下人的角膜内皮细胞不进行分裂,不过数量可随着年龄的增长而减少[1,2]。同时一些眼部及全身疾病、眼外伤、眼内手术等均可损伤角膜内皮细胞。正常角膜有足够的内皮细胞储备维持一生角膜的清澈,比如通过体积的增大来覆盖角膜后面出现损伤的区域[3]。不过当角膜内皮细胞数目不足,内皮细胞的代偿性增大也不足以维持角膜的透明时,出现角膜内皮失代偿,角膜水肿,导致视力减退甚至失明[4,5]。角膜接触镜从形态学和光学上模拟人眼角膜,可以通过镜片下形成的泪液透镜与自身的屈光力来重建角膜前表面光学特性,从而达到完美的视觉效果[6,7]。随着角膜接触镜配戴者逐年增多,报道的角膜损伤并发症也逐渐增多。硬镜由质地较硬、含水量低、舒适性差[8];软镜由含水的高分子化合物制成,在矫正屈光不正的情况下还可将角膜接触镜而产生的视网膜成像视野大小失真、缩小等诸多缺点去除[9,10]。本文探讨不同角膜接触镜对角膜内皮细胞形态的影响,报告如下。
1 资料与方法
1.1 一般资料 选择2017年2月至2018年5月在海南医学院第一附属医院眼科就诊的近视患者89例(177只眼)为研究对象,根据佩戴角膜接触镜的不同分为观察组50例和对照组39例。2组患者年龄、性别比及近视度等差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者知情并同意。见表1。
1.2 纳入与排除标准
1.2.1 纳入标准:年龄18~35周岁,双眼真性近视;等效球镜度数-1.00 D~-9.75 D;患者自愿签署知情同意书;最佳矫正视力均>1.0;佩戴角膜接触镜≥1年;临床资料完整。
1.2.2 排除标准:配合程度不理想者;保证每天戴镜时间8~10 h;临床资料缺乏者;有眼部或全身疾病的患者;有眼部手术史、眼外伤史的患者;合并有严重心血管、脑血管、肝脏和造血系统疾病的患者。
1.3 治疗方法 (1)对照组:佩戴硬性接触镜。(2)观察组:佩戴软性接触镜。全部选用同一公司生产的同一品牌角膜接触镜,镜片内表面的组成共包括4个弧区:定位弧区,基弧区,反转弧区,周弧区。镜片材料由氟硅丙烯酸脂等聚合材料制作。患者在验配接触镜前由专业人员进行常规眼部检查,反复调整镜片的基弧和直径,确定基弧和直径。戴镜时指导患者朝正前方直视,且保持一段时间,快速将镜片接近角膜中央,要求所有患者每天戴镜8~10 h,观察6个月。
1.4 观察指标 (1)患者治疗前后进行选择裂隙灯前置镜、三面镜进行眼轴长度和角膜散光度测定,每个数值都测定3次取平均值。(2)患者治疗前后采用日本NIDEK公司提供的EM-1000型接触型角膜内皮镜进行角膜内皮分析,取角膜中央区0.25×0.5 mm的角膜内皮细胞,测定中央角膜内皮细胞密度(CCD)和细胞变异系数(CV)。(3)记录2组患者治疗前后角膜地形区参数变化,包括角膜厚度、角膜前表面高度图的前表面顶点距理想球面的距离(diff值)。(4)记录2组患者在治疗期间出现的高眼压、角膜水肿、眼底出血等并发症情况。
2 结果
2.1 2组眼轴长度和角膜散光度变化比较 2组治疗前后的眼轴长度和角膜散光度差异无统计学意义(P>0.05)。见表2。

2.2 2组角膜内皮细胞变化比较 2组治疗后角膜内皮的细胞密度都显著低于治疗前(P<0.05),且观察组高于对照组(P<0.05);2组治疗前后变异系数比较差异无统计学意义(P>0.05)。见表3。

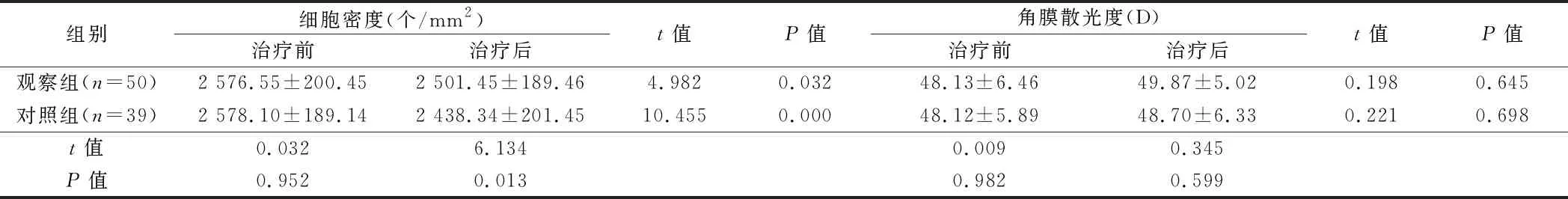
组别细胞密度(个/mm2)治疗前治疗后t值P值角膜散光度(D)治疗前治疗后t值P值观察组(n=50)2 576.55±200.452 501.45±189.464.9820.03248.13±6.4649.87±5.020.1980.645对照组(n=39)2 578.10±189.142 438.34±201.4510.4550.00048.12±5.8948.70±6.330.2210.698t值0.0326.1340.0090.345P值0.9520.0130.9820.599
2.3 2组角膜地形区参数变化比较 观察组治疗前后的角膜厚度与diff值比较差异无统计学意义(P>0.05),对照组治疗后的角膜厚度显著低于治疗前(P<0.05),与观察组对比差异也有统计学意义(P<0.05)。见表4。
2.4 2组患者并发症情况比较 观察组高眼压1例、眼底出血1例,对照组高眼压1例、角膜水肿3例、眼底出血2例。观察组的并发症发生率为4.0%显著低于对照组的17.9%,差异有统计学意义(P<0.05)。见表5。

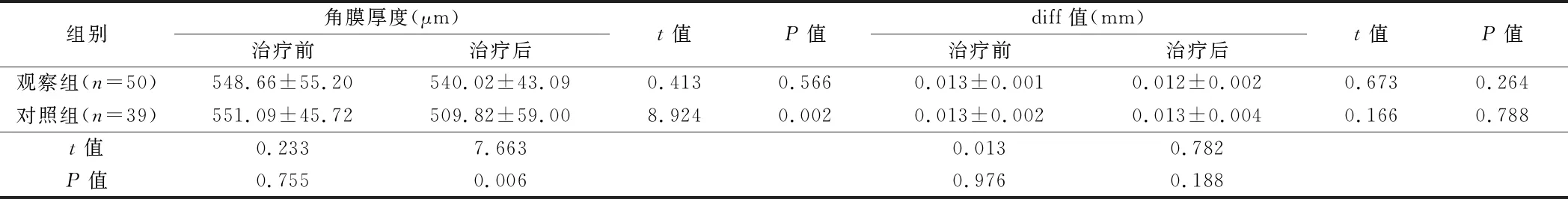
组别角膜厚度(μm)治疗前治疗后t值P值diff值(mm)治疗前治疗后t值P值观察组(n=50)548.66±55.20540.02±43.090.4130.5660.013±0.0010.012±0.0020.6730.264对照组(n=39)551.09±45.72509.82±59.008.9240.0020.013±0.0020.013±0.0040.1660.788t值0.2337.6630.0130.782P值0.7550.0060.9760.188

表5 并发症发生情况比较 例
3 讨论
角膜的高度透明是视觉器官实现正常生理功能的重要条件之一,正常角膜内皮细胞为位于角膜后表面、后弹力层内表面的单层细胞[11]。正常角膜内皮细胞膜上存在Na+-K+-ATP酶,角膜内皮主要通过调控角膜含水量来维持角膜透明性[12]。正角膜内皮细胞Na+-K+-ATP酶在进行离子转运过程中同时具有转运水分子的能力,消除基质通过角膜上皮及内皮被动性水吸收,将多余的水分子从内皮细胞的基质侧转运到房水侧,从而维持角膜基质的相对脱水状态[13]。
随着近视逐年增加以及佩戴角膜接触镜治疗水平不断完善与提高,医学界愈加注重此项技术的临床效果。许多患者其家长也希望接受角膜接触镜治疗,但是也存在一定的顾虑。角膜接触镜根据制作材料不同的硬度及是否亲水,分为如下两种:(1)软性接触镜。基质选择的是甲基丙烯酸羟乙酯,具有多量微孔的三维网状结构,含有双甲丙烯酸羟乙二醇酯[14]。(2)硬性接触镜主要以聚甲丙烯酸为主要材料,具有更好的湿润性和抗沉淀性,保证了镜片的成形性[15]。本研究显示2组治疗前后的眼轴长度和角膜散光度差异都无统计学意义(P>0.05),表明佩戴角膜接触镜并不会影响近视患者的眼轴长度和角膜散光度。
角膜内皮细胞是维持正常角膜功能的基本条件,对维持角膜透明性和保证角膜正常代谢具有重要作用。但角膜内皮细胞并不具备再生能力,其损伤后的修复通过邻近细胞的移行和扩张来进行代偿[16]。角膜内皮细胞为单层,由规则的六角形细胞组成,每年正常的丢失速率为0.5%左右,长期佩戴角膜接触镜对角膜具有显著的干扰作用,甚至会超越角膜的生理负担,对弱角膜应激反应的代偿能力可起到不同程度的削弱作用,从而严重影响到内皮细胞[17]。特别是接触镜配戴引起CO2滞留而导致的碳酸增加,使乳酸堆积,化引起内皮细胞膜通透性和/或泵活性降低,从而导致无氧代谢,细胞壁伸长。本研究显示2组治疗后角膜内皮的细胞密度都显著低于治疗前(P<0.05),且观察组高于对照组(P<0.05),2组治疗前后变异系数对比差异无统计学意义(P>0.05)。说明佩戴软性角膜接触镜能满足角膜代谢的需要。但是在佩戴前需要对其治疗前角膜内皮的具体情况进行充分的评估,尤其是需要保护角膜内皮,从而更好的避免导致角膜内皮功能失代偿[18]。
近视的机制尚未完全阐明,不过视网膜成像清晰对眼轴增加具有一定抑制效果,减缓近视度的增加。传统的框架眼镜安全经济有效,但存在视野缩小、物像被放大、视觉效果差等缺点,而手术治疗有一定的风险性。长期配戴硬性角膜接触镜对眼表的正常代谢具有一定的干扰作用,导致角膜生化与生理的改变,从而使角膜组织发生变化。 有研究表明长期佩戴软性角膜接触镜可导致结膜上皮细胞形态改变,杯状细胞密度降低[19]。本研究显示观察组治疗前后的角膜厚度与diff值差异无统计学意义(P>0.05),对照组治疗后的角膜厚度显著低于治疗前(P<0.05),与观察组对比差异也有统计学意义(P<0.05)。主要在于软性角膜接触镜的湿润角小、弹性模量高、抗沉淀性强,可以修改角膜前表面曲率,从而减少与角膜厚度的影响。
佩戴角膜接触镜对角膜的影响有以下几个方面:机械摩擦损伤、角膜组织缺氧、水肿、代谢障碍等[20]。比如通常认为角膜的水肿率在5%左右为生理性水肿,在佩戴角膜接触镜的情况下,睁着眼睛时,佩戴软性角膜接触镜的水肿率约为6%,佩戴硬性角膜接触镜的角膜水肿率约为10%左右[21]。本研究显示观察组治疗期间的高眼压、角膜水肿、眼底出血等并发症发生率为4.0%显著低于对照组的17.9%(P<0.05)。主要在于硬性角膜接触镜的矫正角膜散光差、容易沉着、容易破损和老化和吸附蛋白质、杂质,从而导致更多并发症的发生。
综上所述,相对于硬性角膜接触镜,佩戴软性角膜接触镜在近视患者中的应用能减少对于角膜内皮细胞形态的影响,促进恢复角膜内皮细胞数量与角膜厚度,减少并发症的发生。
