肠道菌群经肠-脑轴参与多囊卵巢综合征发病机制的研究进展
2020-07-01陈志静欧燕兰杨滢李荔
陈志静 欧燕兰 杨滢 李荔
广东省妇幼保健院暨广州医科大学附属广东省妇儿医院1妇产科,2体检科(广州510010)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄女性常见的内分泌和代谢性疾病[1],是一种临床表现多样,以月经稀发、不孕、高雄激素血症及卵巢多囊样改变为主要表现,伴有以胰岛素抵抗为基础的多种糖脂代谢异常,同时可增加2 型糖尿病、心脑血管疾病、子宫内膜癌、焦虑症及抑郁症等远期并发症[2-3]。根据国内外的报道PCOS 在育龄女性中的患病率为5%~10%[4],而PCOS 也是无排卵女性不孕的主要原因。因此,积极寻找PCOS 的发病机制,可为临床治疗提供新的靶点,并有效解决患者生育障碍及相关近、远期并发症。
PCOS 病因尚不清楚,既往认为PCOS 与遗传及环境等因素有关,但缺乏有效的防治策略。目前PCOS 发病机制研究已成为妇科内分泌领域最为复杂的研究热点之一。近几年国内外学者研究发现肠道菌群紊乱与PCOS 存在密切相关,肠道菌群多样性的紊乱可能通过改变短链脂肪酸(short chain fatty acid,SCFA)、脂多糖(lipopolysaccharide,LPS)等小分子的产生,经神经及体液系统上传信号至大脑中枢(包括下丘脑及垂体),最终导致促性腺激素及性激素分泌异常[5-6]。因此,笔者总结近年来肠道菌群在多囊卵巢综合征中的相关研究,认为肠道菌群可能通过肠-脑轴参与PCOS发病,提供了一个新视角重新认识PCOS 的发病机制。
1 肠道菌群概述
肠道微生物的数量由消化道的近端到远端逐渐增加,其总数量是1014个,相比人体细胞总数高出10 倍[7]。肠道内环境主要由厌氧细菌控制,微生物与宿主之间的共生关系构成了一个复杂和动态变化的生态系统。在过去的十几年里,人类的研究打开了肠道微生物世界的大门,随着粪菌检测技术的兴起和发展,人类逐渐了解到胃肠道内微生物对人体的重要性。尽管肠道内微生物存在个体差异,但其中占主要地位的是4 种,包括:厚壁菌门、拟杆菌门、放线菌门和变形菌门[8],而肠道微生物群落的多样性是维持肠道内免疫和肠道内稳态的关键。
由于人体胃肠道内存在大量肠道微生物,所以了解肠道菌群在人体健康中的作用非常必要。影响肠道菌群组成的诸多因素中,有饮食[9]、年龄[10]、疾病[11]、治疗[12]和宿主遗传学[13]等,其中饮食为主要影响因素。微生物菌落失衡会扰乱人体生理状态,从而导致各种疾病,如结肠癌、炎症性肠病、肠易激综合征、肥胖、糖尿病及心血管等疾病。随着对肠道菌群深入研究,肠道微生物对人体健康的重要性也逐渐被大家重视。
2 肠-脑信号轴
肠-脑轴最初在神经精神系统疾病中被大量报道,是一个双相调节的信号通路[14],其机制尚不明确,但在肠道菌群与疾病中发挥重要作用。随着研究工作的深入,学者们已逐渐重视肠-脑轴在人肥胖[15]、胰岛素抵抗[16]、2 型糖尿病[17]及PCOS[6]等代谢疾病中的作用。肠-脑轴的调节可分为两部分,肠道菌群对中枢系统的调节及中枢系统发出信号调节胃肠道的作用。
2.1 肠道菌群对中枢神经系统自下向上的调节肠道菌群对中枢神经系统自下向上的调节,目前认为主要包括神经、内分泌和免疫信号3 条相互作用的通路[14]。微生物及其代谢产物产生包括SCFA、脑肠肽、神经递质及炎症因子等[18]作为信号通路的起始因子,最初通过肠内分泌细胞、肠嗜铬细胞及免疫系统,也有分子直接通过肠道黏膜屏障进去循环,然后经迷走神经或体液循环等传递信号诱导中枢反应[17],从而控制人体的摄食反应及物质代谢。
2.2 大脑中枢对肠道菌群自上而下的调节大脑中枢对肠道菌群自上而下的调节,其中下丘脑弓状核可整合信号在控制能量摄入及消耗中起着重要作用[19],主要通过多条路径与胃肠道相通,包括自主神经系统、下丘脑-垂体-肾上腺轴和交感神经-肾上腺轴和下行的单胺能途径[20],占主要地位的是自主神经,其调节胃肠道内的神经丛控制着胃肠道的功能。胃肠道的交感神经节后神经不仅能引起脑肠肽,包括Ghrelin、缩胆囊素、胰高血糖素样肽(glucagon-like peptides,GLP)及多肽YY(peptide YY,PYY)等,控制葡萄糖和脂质的吸收及人体代谢的作用;而且也参与胃肠道黏膜免疫调节,从而控制着肠道内环境的平衡及肠道菌群的分布。
3 肠道菌群与PCOS
3.1 肠道菌群紊乱与肥胖PCOS 肥胖患者的患病率占30% ~60%[21]。肥胖的PCOS 患者常常合并胰岛素抵抗(IR),两者能加重PCOS 高雄激素血症和代谢紊乱,导致生殖、内分泌等紊乱[22]。肥胖与高脂饮食有关,高脂饮食能改变胃肠道革兰氏阴性菌的组成,增加(LPS)、减少(SCFA)产生以及改变肠道通透性。有文献报道,肥胖患者体内肠道菌群紊乱可导致LPS 产生并改变肠道黏膜的渗透性,作用于肠上皮细胞表面的toll 样受体激活核因子κB 途径诱导炎症反应[23-24],这与PCOS 患者体内的慢性炎症激活状态密切相符[25]。另外,MUSCOGIURI 等[15]发现肠道菌群中拟杆菌门类数量与粪便中SCFA 的浓度直接相关,而SCFA 通过与G 蛋白偶联受体相互作用,刺激外周神经影响肠道及脂肪吸收。
3.2 肠道菌群紊乱与胰岛素抵抗PCOS 患者胰岛素抵抗占50%~70%[26],IR 和高胰岛素血症是PCOS 患者重要的病理生理改变。高胰岛素血症能影响卵泡膜细胞和间质细胞过多增生、抑制肝脏的性激素结合球蛋白合成,从而导致高雄激素血症。在肥胖与胰岛素抵抗中,肠道菌群失衡破坏肠道粘膜屏障及LPS 等炎症因子增多,激活toll样受体4/应激活化蛋白激酶(c-Jun N-terminal kinase,JNK),能使胰岛素受体底物-1 丝氨酸307磷酸化,并激活细胞内质网应激激酶,从而引起肝脏和肌肉胰岛素信号的下调,导致胰岛素抵抗[27-28]。有实验发现伴糖脂代谢异常的小鼠体内变形杆菌门和拟杆菌门减少、厚壁菌门增加,经抗生素治疗后代谢异常逆转、糖耐量敏感性增高,同时移植代谢异常小鼠的肠道菌群至正常小鼠,能增加后者的体重及胰岛素抵抗[27]。另有研究[29-30]证明通过粪菌移植或补充益生菌治疗胰岛素抵抗及PCOS女性,肠道菌群产生SCFA增多、LPS减少,GLP-1和PYY 分泌增加上调胰岛素的分泌,也能刺激调节性T 细胞产生发挥抗炎作用,从而改善胰岛素的敏感性、LH 及性激素水平[6,31]。
3.3 肠道菌群紊乱与高雄激素血症高雄激素血症是PCOS 重要临床表现之一。高雄激素血症能使卵泡发育成熟障碍及卵泡壁过度增生,引起卵泡闭锁,造成排卵障碍[32]。SHERMAN 等[33]发现因妊娠晚期暴露在高雄激素血症条件下的小鼠,成年后其体内肠道菌群存在明显差异,且肠道菌群的差异与SCFA 增加有关。TORRES 等[34]对正常、卵巢多囊样及PCOS 3 组女性进行了研究,排除卵巢多囊样改变这一因素后,结果发现高雄激素血症与肠道菌群α多样性呈负相关,但具体菌株尚不清楚。也有研究表明在PCOS 小鼠中移植乳酸菌或正常小鼠粪便能降低雄激素水平及促进排卵[6]。这表明肠道菌群与高雄激素血症存在相互影响的密切联系。
4 肠道菌群经肠-脑轴参与PCOS 的调控机制
随着近几年对肠道菌群的分离培养、质谱分析及宏基因组测序等检测技术快速的掌握,人们逐渐认识到肠道菌群在PCOS 中的重要作用。有研究表明在排除性别、肥胖对肠道菌群的干扰,PCOS 患者粪便中肠道菌群的存在特征性的差异[35]。PCOS 患者与正常女性之间对比,PCOS 患者肠道菌群中α多样性降低[36],β多样性升高[23,37],其中拟杆菌与PCOS 呈密切相关[36]。拟杆菌是一种革兰氏阴性厌氧细菌,在健康的个体中是典型的非致病性细菌,在肠道菌群紊乱中它可通过LPS 及SCFA 等在IR 及肥胖等疾病起到重要作用[37-38]。同时,体内高雄激素水平与肠道菌群中α多样性降低有关[35]。移植PCOS 粪便或者拟杆菌至正常小鼠,能导致黄体生成素及雄激素升高、卵巢功能紊乱、胰岛素抵抗、胆汁酸代谢改变甚至不孕[39]。以上均已说明了肠道菌群与PCOS 存在密切联系。
肠-脑轴可能在肠道菌群与PCOS 之间起重要作用。肠道菌群影响SCFA 及炎症因子的产生、脑肠肽的分泌、肠黏膜渗透性、胃肠蠕动和排空情况[5-6,23],从而将人体的饥饿及饱腹等信号上传至下丘脑及大脑中枢[40],进一步大脑中枢发出反馈信号:(1)影响胃肠激素分泌及肠道内环境,调控肠道菌群多样性[14,41];(2)控制人体的摄食行为及脂质、胰岛素及胆汁酸等物质的代谢[7,42];(3)影响下丘脑-垂体-卵巢轴(Hypothalamic-pituitaryovarian axis,HPO axis)[6,23]。
肠道菌群通过发酵复合碳水化合物产生SCFA,如抗性淀粉或膳食纤维。SCFA 可通过主要激活肠内分泌细胞表面G 蛋白偶联受体(包括G 蛋白偶联受体41、43),其中G 蛋白偶联受体43 主要在肠内分泌细胞中表达,而G 蛋白偶联受体41主要在白细胞中表达,在肠内分泌细胞少量表达[43]。SCFA 与肠内分泌细胞分泌GLP-1、Ghrelin和PYY[30]密切相关,有研究证实G 蛋白偶联受体43 基因敲除,GLP-1 和PYY 分泌明显减少[44]。SCFA 调控脑肠肽分泌的机制可能通过G 蛋白偶联受体43 激活下游mTOR/STAT,使mTOR/STAT 磷酸化控制着下游蛋白表达[45],但其具体机制尚待进一步研究。近期有学者在交感神经元或感觉神经元内检测到G 蛋白偶联受体43-单体红色荧光蛋白及编码G 蛋白偶联受体43 的mRNA[46],因此SCFA 不仅通过肠内分泌系统起作用,而且也可通过神经系统调节体内代谢及胃肠功能。
脑肠肽受神经及体液双重调节,在胃肠和神经系统双重分布,脑肠肽能作用其中枢受体,影响HPO 轴中激素的释放。Ghrelin 能通过生长激素促分泌1a 受体(主要存在脑垂体及大脑的部分区域)刺激食物的摄入,并将信号传导到控制能量平衡的下丘脑调节核,可以控制促性腺激素释放激素、黄体生成素(luteinizing hormone,LH)分泌,影响女性生殖功能[47]。PYY 也可通过神经肽2 受体(主要存在大脑内)控制垂体促性腺激素分泌作用[48]。ZHANG 等[6]发现PCOS 患者体内Ghrelin、PYY 较正常女性明显降低,通过在PCOS 患者体内移植益生菌乳酸双歧杆菌V9,益生菌移植成功组LH、LH/FSH 比值明显减少,并能改善PCOS 相关临床指标及增加SCFA 水平;而益生菌移植不成功组LH、SCFA 及性激素水平变化不明显。因此,笔者认为肠道菌群的紊乱不仅与PCOS 相关,而且能通过肠-脑轴与大脑中枢形成广泛的联系,影响体内代谢及性激素水平,从而参与PCOS发病(图1)。
目前对于PCOS 女性的治疗方式多以饮食、运动及对症治疗为主,对于PCOS 导致的不孕及近、远期并发症治疗仍然有较大局限性,寻找PCOS 病因目前是妇科内分泌领域热点之一。随着肠道菌群测序技术的发展及无菌小鼠模型的技术建立,探讨PCOS 发病机制与肠道菌群之间联系的研究大量开展,同时临床及动物研究也发现益生菌及粪菌移植可改善PCOS 症状,但机制尚不明确。肠道菌群是否通过肠-脑轴参与PCOS的发病机制,其中作用靶点及相关信号通路仍不清晰。希望在未来关于肠道菌群与PCOS 的研究中,有更多关于肠-脑轴在PCOS 发病机制中的作用有利证据,能进一步明确PCOS 与肠道菌群、中枢神经系统、脑肠肽和内分泌代谢之间的相互作用关系,这将为预防及治疗PCOS 提供新的有效途径。
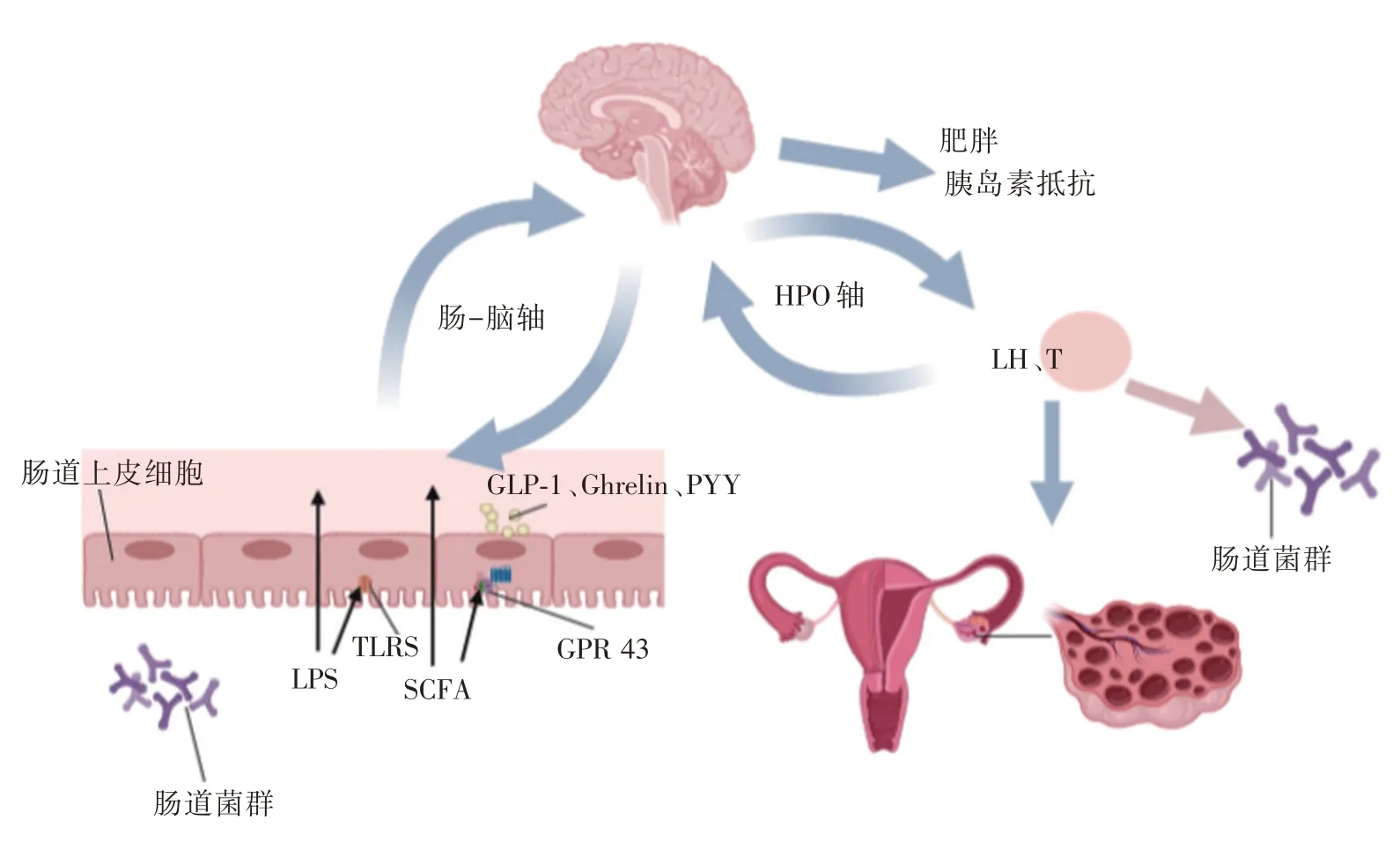
图1 肠道菌群通过肠-脑轴参与PCOS 发病的示意图Fig.1 The diagram of the gut microbiota involving in the pathogenesis of the disease through the gut-brain axis
