刺梨中活性物质的提取与性能探讨
2020-07-01陈代秀夏伟丽胡思前郭艳华张玉敏
陈代秀,夏伟丽,胡思前,郭艳华,张玉敏
(江汉大学化学与环境工程学院,湖北 武汉 430056)
随着经济的发展和人们物质生活水平的不断提高,食品安全和环保已成为消费者最关心的问题。利用天然植物提取的无毒食用活性成分更是成为被追寻和探索的对象。许多研究表明,刺梨果实中含有大量黄酮、SOD、维生素、有机酸及抗坏血酸和多糖等成分,具有抗癌防癌、有抗氧化、增强免疫、抗突变、防治糖尿病、降低重金属负荷等药理作用[1]。刺梨中含有的具有药理活性的黄酮类物质,可与超氧阴离子自由基反应来阻断自由基引发的连锁反应,与脂质过氧基反应来阻断脂质过氧化进程等,还具有扩张冠状动脉、消炎、调节血压、保护心血管、解毒镇静、降血脂和抗肿瘤等重要的生物活性。刺梨活性成分不光对治疗人体铅中毒有特殊疗效,对改善动脉粥样硬化也有明显作用[2]。可见,刺梨不仅营养丰富,而且食用安全,所以在食品、保健品及药品等方面具有巨大的开发前景。针对刺梨活性成分,许多研究者分别采取碱性水或碱性稀醇提取法、有机溶剂提取法、微波法、超声波法、酶解法、水提法、大孔树脂吸附法、超滤法、超临界萃取法等提取,采用质谱、色谱等技术鉴定野生刺梨中的微量营养成分,并对其药效、药理进行研究[3]。
本文采用有机溶剂浸提提取野生刺梨黄酮,结合单因素试验对提取工艺进行优化,探索提取刺梨中总黄酮的最佳工艺条件,探讨刺梨中总黄酮的耐热、耐光、抗氧化稳定性[4-9],为深入开发利用刺梨资源、促进刺梨产业发展提供了一定的理论依据。
1 材料与方法
1.1 材料、试剂和仪器
主要材料和试剂:刺梨干果(网售、河南省开封市),烘箱烘干,粉碎,放入保鲜袋中密封保存。
乙酸、丙酮、乙酸乙酯 、石油醚、硝酸铝、亚硝酸钠、氢氧化钠、无水乙醇、DPPH等,均为分析纯。
主要实验仪器与设备:电子天平,上海精密科学仪器有限公司;中草药粉碎机,天津市泰斯特仪器有限公司;数显恒温水浴锅,国华电器有限公司;超声波清洗仪,昆山市超声波仪器有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 总黄酮含量的测定1.2.1 标准曲线的绘制
精确称取20.9 mg的芦丁,用适量70%乙醇溶液溶解,再转移到100 mL容量瓶中定容,即得浓度为0.020 9 mg/mL的芦丁溶液。
移取芦丁标准溶液0 mL、1 mL、2 mL、3 mL、4 mL、5 mL、6mL,分别置于25 mL具塞比色管中,各加入30%乙醇溶液体积为 6mL;然后加入0.75 mL的5%亚硝酸钠溶液摇匀,静置5min;加入0.75 mL的10%硝酸铝溶液摇匀,静置5min;加入5 mL的1 mol/L氢氧化钠溶液,用30%乙醇溶液定容至刻度并摇匀,静置10min。用紫外分光光度计以30%的乙醇为对照,以最大波长处测其吸光度。以吸光度为横坐标,芦丁标准溶液浓度为纵坐标,绘制标准曲线。
1.2.2 提取条件探讨
(1)浸提剂的选取。准确称取6份干燥刺梨干粉0.200 g,料液比为1∶100(g∶mL),分别加入乙酸乙酯、乙酸、丙酮、石油醚、乙醇等试剂,常温下提取时间为1 h。分别得到几种野生刺梨总黄酮提取液,在最大波长处测其吸光度,选取最佳浸提剂。
(2)提取时间的选择。准确称取6份干燥刺梨粉M=0.200 g,料液比为1∶125,放入恒温水浴锅,设置温度为25℃,提取时间分别为0.5 h、1 h、1.5 h、2 h、2.5 h、3 h,过滤出的提取液体积为V1,然后取提取液滤液V2=1.4 mL,按测定芦丁标准曲线中的方法测吸光度,从回归方程中查出黄酮相应的浓度,计算出黄酮的提取率(Y=C×(V1/V2)/M),选择最佳提取时间。
(3)浸提剂浓度的选择。准确称取7份干燥野生刺梨粉0.200g,在上述最佳提取时间下,在料液比为1∶125时,放入恒温水浴锅,设置温度为25℃,用浓度分别为35%、45%、55%、65%、75%、85%和100%(体积分数,下同)提取剂浸泡刺梨粉,过滤,分别取V1=2 mL提取液,同样方法测定吸光度,选择最佳浸提浓度。
(4)料液比的选择。准确称取5份干燥刺梨粉0.200 g,在上述最佳提取条件下,放入恒温水浴锅,设置温度为25℃,在料液比分别为1∶100(g∶mL,下同),1∶125、1∶150、1∶175、1∶200,控制在最佳提取时间下,测定吸光度,选择最佳的提取料液比。
(5)提取温度的选择。准确称取5份干燥野生刺梨粉0.200 g,在上述最佳浸提剂浓度、料液比条件下,提取时间为1 h,恒温温度分别为30℃、40℃、50℃、60℃、70℃,得到刺梨总黄酮提取液,测定吸光度,选择最佳的提取时间。
1.2.3 正交实验
根据单因素试验结果,选择浸提剂浓度(A)、浸提剂用量(B)、浸提时间(C)、浸提温度(D)为影响因素,设计成L9(34)正交实验(见表1),探讨对总黄酮提取效果的最优组合和因素的主次关系。
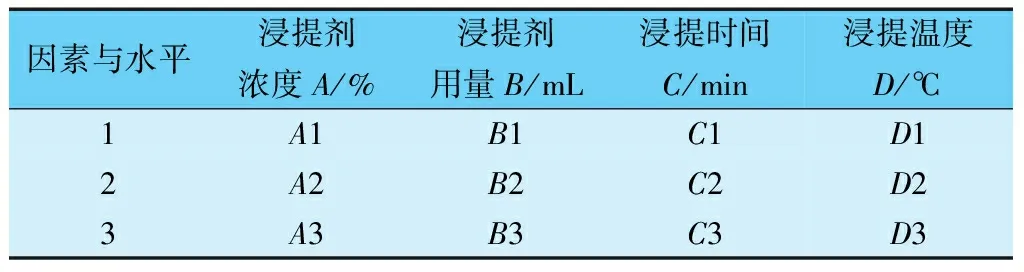
表1 L9(34)正交实验
根据上述实验结果,判断各因素对野生刺梨中总黄酮提取率影响的大小,得出最优方案,确定最佳工艺条件。
1.2.4 总黄酮提取量的测定
准确称取干燥、粉碎、过40目筛的刺梨粉末0.200 g,按照上述最佳料液比、温度、浸提剂浓度、浸提时间条件下提取,过滤去渣,得到刺梨总黄酮提取液。取提取液0.5 mL,按照前述方法测其吸光度值,依次测定5次,取平均值。从回归方程中查出相应的黄酮浓度,计算刺梨总黄酮得率。
按下式计算黄酮含量:
Y=C×(V1/V2)/M
式中,Y为黄酮含量(mg·g-1),C为测定液黄酮浓度(mg·L-1),V1为提取液体积(mL),V2为测量时取液体积(mL),M为提取时天然植物质量(g)。
黄酮的提取率=黄酮含量(g)/天然植物皮粉末质量(g)。
1.3 稳定性探讨
(1)光照对刺梨黄酮稳定性的影响:各取5组黄酮提取液10mL,放在紫外光灯下照射0 h、0.5 h、1 h、1.5 h、2 h后,测定在最大波长下吸光度的变化。
(2)温度对刺梨黄酮稳定性的影响:各取5组黄酮提取液10mL,分别放在30℃、40℃、50℃、60℃、70℃的恒温水浴锅中各1 h,测定在最大波长下吸光度的变化。
(3)刺梨黄酮提取液的抗氧化性:可用自由基的清除情况,来评价刺梨黄酮提取液的抗氧化能力。其抗氧化能力用抑制率来表示,抑制率越大,抗氧化能力越强。
抑制率=[1-(Ai-Aj)/Ac]×100%
式中,Ai为加抗氧化剂后的DPPH溶液的吸光值;Aj为50%乙醇溶液和抗氧化剂混合后的吸光值;Ac为未加抗氧化剂的DPPH溶液的吸光值。
2 结果与讨论
2.1 标准曲线的绘制
通过文献,波长在510 nm附近芦丁和黄酮均有最大吸收波长。在实验1.2.1的条件下,绘制芦丁的标准曲线,芦丁溶液浓度与吸光度的关系见图1。
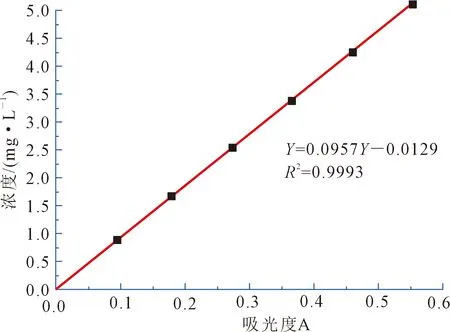
图1 吸光度与浓度的关系
根据图1不同浓度下的标准芦丁溶液与其吸光度的关系,得出芦丁的标准曲线方程,后续实验的相关计算可以按照此方程进行计算。
2.2 浸提剂的选取
在1.2.2浸提剂的选择实验条件下,测量不同浸提剂提取出的提取液的吸光度,采用无水乙醇、乙酸乙酯、丙酮、石油醚、乙酸分别浸提刺梨,分别测得浸提液的吸光度结果(见图2)。

图2 浸提剂的选择
由图2中可以看出,无水乙醇的浸提效果最好,其次是乙酸、丙酮。乙酸乙酯和石油醚的浸提效果很差,即无水乙醇为最佳的浸提剂,在后续的提取条件探讨中均选择无水乙醇作为浸提剂。
2.3 提取时间的选择
根据1.2.2实验中提取时间的选择,在其他提取条件相同的前提下,改变提取时间,得出提取时间与提取率的关系(见图3)。

图3 浸提时间的选择
由图3可以看出,随着浸提时间的延长,在0.5~1.5 h之间,提取率也随之增大,并且提取率的上升幅度很大,但是在超过1.5h后,提取率随提取时间的延长而减缓,且提取率随着时间的延长开始缓慢地减小,然后慢慢趋于稳定,变化幅度不大,由此可知,提取刺梨黄酮的最佳时间为1.5 h,在后续提取实验中以此时间为标准进行。
2.4 提取剂浓度的选择
根据1.2.2实验中浸提剂浓度的选择,在其他提取条件相同的前提下,改变浸提剂浓度,测量吸光度并计算不同浸提剂浓度下的提取率,同时绘制不同浸提剂浓度与其提取率的关系(见图4)。

图4 浸提剂浓度的选择
由图4可以看出,浓度为55%乙醇的提取效果最好,乙醇浓度低于55%时,测得的吸光度和计算的提取率随浓度的增大而增大;乙醇浓度高于55%时,测得的吸光度和计算的提取率随浓度的增大而减小,故选择浓度为55%的乙醇为提取剂。
2.5 料液比的选择
为测量料液比对刺梨黄酮提取效果的影响,根据1.2.2实验中料比液的选择,在其他提取条件相同、不同料液比的条件下,测量吸光度并计算不同料液比下的提取率,得出料液比与其提取率的关系(见图5)。
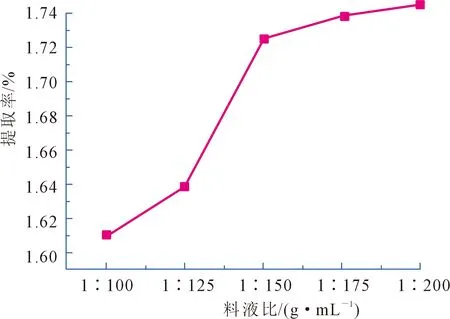
图5 料液比的选择
由图5可知,随着乙醇料液比的增大,刺梨中黄酮的提取率随之增大,当液料比低于1∶150(g∶mL)时,提取率的上升幅度大,当液料比高于1∶150(g∶mL)时,黄酮提取率的上升幅度变小并逐渐趋于稳定,从节约浸提剂的角度考虑,故选择液料比1∶150(g∶mL)为提取野生刺梨黄酮的最佳液料比。
2.6 提取温度的选择
根据1.2.2实验中提取温度的选择,在其他提取条件相同、不同提取温度的条件下,测量吸光度,并计算不同温度下的提取率,绘制不同温度与其提取率的关系(见图6)。

图6 温度的选择
由图6可以看出,随着温度的升高,测得的吸光度和计算的提取率随之增大,当温度升高到40℃时,提取率达到最大,温度再升高后吸光度呈下降趋势。原因可能是随着温度的升高增加了黄酮的溶解度,同时提取液黏度减小,加快了黄酮的析出。当温度过高时,可溶性蛋白质析出变性,黏度加大而影响细胞破裂,阻碍黄酮物质的析出。故40℃是提取野生刺梨黄酮的最佳温度。
2.7 正交实验
选择用乙醇浓度A、浸提剂用量B、浸提时间C、浸提温度D为影响因素设计成L9(34)正交实验,具体情况见表2,实验结果见表3。
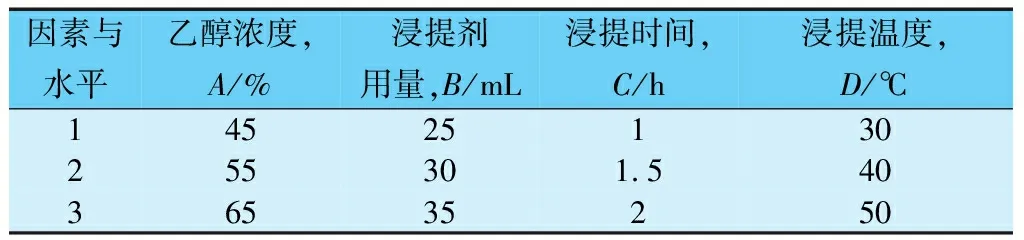
表2 L9(34)正交实验
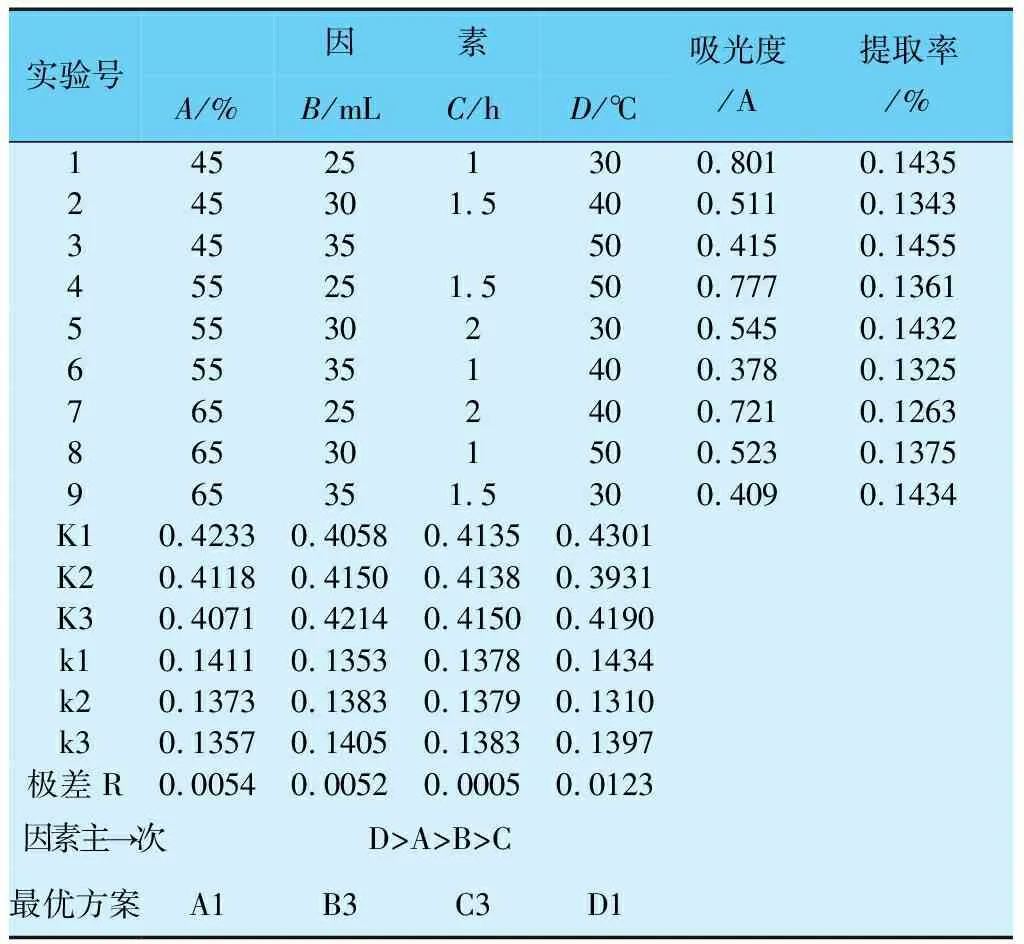
表3 正交实验L9(34)结果
由表3可知,4种因素对野生刺梨中黄酮提取效果的影响主次因素顺序为D、A、B、C,即温度、浓度、料液比、时间。野生刺梨提取黄酮的最佳工艺为提取温度30℃,乙醇浓度为45%,料液比为1∶175(g∶mL),提取时间为2h。由方差分析结果可知,温度对提取液浓度的影响较大,时间对其的影响较小。由于实验中各条件存在交互作用或者实验误差,所以需要作进一步的分析。在表3中,第3组实验在9组中提取率最大,温度与最佳提取温度差异较大,所以需再次进行比较(见表4)。
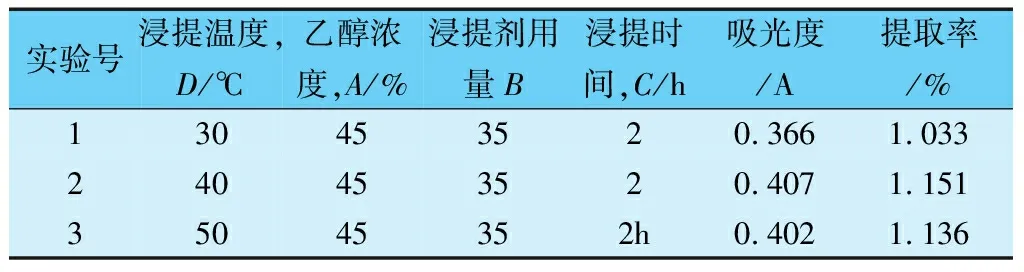
表4 温度的影响
由表4数据可知,温度在40℃的时候提取率达到最大,也是探究的单因素最佳温度,故刺梨提取总黄酮的最佳条件温度是40℃,乙醇浓度是45%,料液比为1∶175(g/mL),提取时间为2h。
根据正交试验结果,在最佳条件测得的吸光度为0.407,代入前面标准曲线的回归方程:
Y=9.095 7X-0.021 9,并计算可得出提取液的浓度为6.468 mg/L,总黄酮提取率为28.29 %。
2.8 提取液的稳定性2.8.1 提取液耐光性的测定
各取5组野生刺梨黄酮提取液10mL,在其他条件相同的情况下,放在紫外光灯下分别照射0 h、0.5 h、1 h、1.5 h、2 h后,再测量不同照射时间的吸光度,绘制不同照射时间及与其吸光度的关系(见图7)。
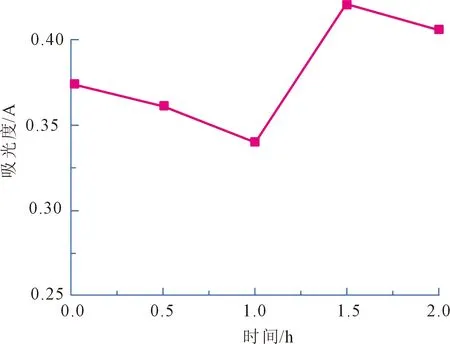
图7 提取液的耐光性
由图7可知,随着紫外光照时间的增长,提取液的吸光度明显下降,可能是由于光照破坏了黄酮的结构,当时间超过1 h后吸光度又增加,可能是野生刺梨中的黄酮类物质分解成其他强吸收物质,影响吸光度,故刺梨中黄酮的耐光性较弱。
2.8.2 提取液耐温性的测定
取5组刺梨黄酮提取液10 mL,分别放在30℃、40℃、50℃、60℃、70℃的恒温水浴锅各加热1 h,测其吸光度,绘制不同温度与其吸光度的关系(见图8)。
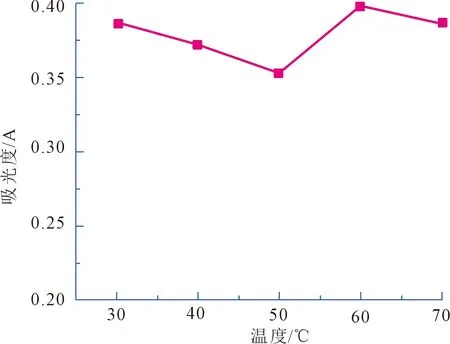
图8 提取液的耐热性
由图8可知,随着温度的提高,提取液的吸光度明显下降,可能是由于高温会破坏黄酮的结构,当温度高于50℃后吸光度又增加,推测可能是野生刺梨中的黄酮类物质分解成其他强吸收物质影响吸光度,故野生刺梨中黄酮的耐热性较弱。
2.9 提取液的抗氧化性
各取10 mL具塞比色管,编号为1、2、3,在1号中加入1 mL DPPH溶液,再加提取液定容,在2号中加入1 mL 50%乙醇溶液,再加提取液定容,在3号中加入1 mL DPPH溶液,再加50%乙醇溶液定容,提取液抗氧化性测定见表5。

表5 提取液的抗氧化性
由抑制率=[1-(Ai-Aj)/Ac]×100% 可得:
抑制率=[1-(0.185-0.180)/0.022]×100%= 77.27%,由结果可以看出,野生刺梨中黄酮的抗氧化性较强。
3 结语
野生刺梨黄酮提取的最佳浸提剂是无水乙醇,最佳条件为提取温度40℃、乙醇浓度45%、料液比1∶175(g∶mL)、提取时间2h。用正交实验所得出的最优条件下提取刺梨活性成分总黄酮,提取率为28.29%。野生刺梨中黄酮的耐热性、耐光性较差,但抗氧化性较强。
