“肠漏-免疫激活”的弱化
——运动减轻抑郁性神经炎症的新通路
2020-07-01漆正堂刘微娜
章 森,漆正堂,刘微娜*
(1.华东师范大学“青少年健康评价与运动干预”教育部重点实验室,上海 200241;2.华东师范大学 体育与健康学院,上海 200241)
抑郁症是一种常见且易复发的情绪障碍,并伴有高的死亡率和发病率,尽管学界已提出多种假说,但抑郁症的潜在病理机制仍未完全揭露。有研究指出,全球有超过2.64亿各个年龄层的人患有抑郁症(James etal,2018)。研究发现,作为全球健康问题之一的肥胖与抑郁症具有共病机制(Jantaratnotai et al.,2017)。其中一个可能机制就是肥胖者的血浆内脂多糖(lipopolysaccharide,LPS)水平较高,使身体处于慢性炎症状态,进而增加神经退行性疾病的风险(Rorato et al.,2017)。成人体内,大约有一百万亿个细菌存在于肠道中,构成庞大的肠道菌群生态系统,这些肠道菌群与宿主有着共生的关系。其中,硬壁菌门和拟杆菌门在肠道中占绝大多数,约90%,这些肠道菌群的稳态与人体的健康息息相关(Qin et al.,2010)。早在1986年,就有研究发现了肠道微生物改变大脑物质组成的现象(Hegstrand et al.,1986)。近来对抑郁症的研究中,学界越来越关注对肠道菌群的探究,提出肠道菌群影响机体的免疫系统、神经系统,并形成肠-脑轴对话机制,进而影响脑神经功能(Lach et al.,2018)。
肠道菌群紊乱和“肠漏”可能是抑郁行为产生的关键病理因素,肠道微生物群会影响肠道完整性和通透性,并将病菌及其产物转移至组织中(Slyepchenko et al.,2016)。在慢性应激作用下,肠道功能紊乱会导致肠道通透性发生变化,并使得革兰氏阴性菌表层的脂多糖(lipopolysaccharide,LPS)进入血浆中,形成内毒素血症(endotoxemia),再由血液运输至大脑产生一系列反应,进而产生抑郁等相关情绪(Stevens et al.,2018)。慢性应激作用下LPS的生成与移位会导致固有免疫系统的激活,通过与免疫细胞膜上 Toll样受体 4(Toll like receptor-4,TLR4)的结合,产生一系列级联反应,并使大脑产生神经炎症和海马神经发生减少,最终导致抑郁行为的产生(Wang et al.,2018)。适度运动可以弱化由LPS诱导的免疫激活产生的抑郁性炎症反应,降低LPS应激介导的海马神经发生减少。因此,本文主要梳理了“肠漏”诱导免疫激活产生抑郁行为的发病机制、运动干预对“肠漏”下抑郁行为改善的相关文献,进而从“肠道-免疫-大脑”的角度对现有研究进行总结,旨在为运动抗抑郁机制提供新的视角和依据。
1 “肠漏”诱导的免疫激活与抑郁行为
1.1 “肠漏”及其形成过程
“肠漏”(leaky gut)这一概念最早于1984年在Lancet杂志上提出,起初这一概念主要是用于阐述酒精中毒者体内有毒物质的转运路径(Bjarnason et al.,1984)。后来随着肠道菌群与抑郁行为的研究增多,学界越来越关注“肠漏”这一现象在抑郁行为中的作用,并提出抑郁症的“肠漏理论”(Maes et al.,2008)。在人体消化系统中,肠道粘液层和单层上皮细胞共同构成了一道“肠道屏障”,这层屏障是调控各类物质进入循环系统的“门户”(Farhadi et al.,2003)。其中含有革兰氏阴性菌和免疫球蛋白IgA、IgM(Vanuytsel et al.,2014)。而在单层上皮细胞间,跨膜蛋白zonulin是主要的调节因子,可以调节肠道和血脑屏障(blood brain barrier,BBB)的通透性(Stevens et al.,2018),其他的调节因子还包括claudin和occludin等(Ivanov et al.,2010)。有研究显示,跨膜蛋白zonulin的失调可以被细菌、应激、饮食方式所诱导(Linninge et al.,2018)。因此,肠道屏障受肠道微生物及其代谢产物的调控,同时也可能受下丘脑-垂体-肾上腺轴(HPA轴)的调控(Park et al.,2013)。在小鼠慢性应激抑郁模型中,中枢促肾上腺皮质激素释放激素CRF表达升高与肠道微生物同时发生变化(Rodiño-Janeiro et al.,2015)。急性应激源引起肠道通透性增加、肠道屏障功能失调会导致革兰氏阴性菌移位至肠系膜淋巴结(mensenteric lymph nodes,MLNs)产生免疫反应(Maes et al.,2013),这种免疫反应通过多种途径对大脑产生影响(Stevens et al.,2018)。同时,临床上也发现,抑郁症患者血液中有较高水平的IgA和IgM,提示这作为对肠道革兰氏阴性菌LPS的免疫应答(Roomruangwong et al.,2017),而LPS的免疫应答又会使肠道通透性进一步增加(Zhao et al.,2017)。近年的一项临床研究证实,增加肠道通透性标记蛋白zonulin和FABP2的表达,对内毒素血症引起的抑郁焦虑状态有明显改善作用(Stevens et al.,2018),这在抑郁行为的病理机制中扮演着重要作用。
1.2 “肠漏”后产生的免疫激活剂:脂多糖
LPS是肠道革兰氏阴性菌外膜的重要组成成分,又被称为内毒素,其主要结构由3个部分组成:脂质A、核心区域的低聚糖、O侧链,其中脂质A是激活宿主免疫反应中病原体相关分子模式(pathogen associated molecular patterns,PAMPs)的主要部位(Miller et al.,2005)。LPS在体内的丰度对机体健康水平有重大影响,因此,宿主体内自主免疫系统对LPS的反应是机体对革兰氏阴性菌水平监测的关键(Rathinam et al.,2019)。LPS作为一种免疫激活剂在抑郁症以及帕金森综合症(Parkinson's disease,PD)、精神分裂症(schizophrenia,SCH)、阿尔茨海默症(Alzheimer's disease,AD)等神经退行性疾病发病过程中起着重要作用(Catorce et al.,2016;Rudzki et al.,2018;Zhang et al.,2018)。在“肠漏”后,由于革兰氏阴性菌移位导致LPS触发PAMPs作用,它可以引发一系列的免疫级联反应,并作为细菌感染的早期预警信号。其传递过程是由血清中游离的LPS结合蛋白(lipopolysaccharide binding protein,LBP)结合转运至细胞膜上的 CD14(Lu et al.,2008)。CD14存在于固有免疫细胞的胞膜,或以游离的形式存在于血浆中,其作用可将LBP分离成单体的LPS,从而与细胞膜上TLR4-MD2跨膜受体结合,激活下游通路,触发核内细胞炎症因子的释放(Park et al.,2013)。另有研究发现,啮齿类动物的天冬氨酸蛋白水解酶Caspase-11、人体内的Caspase-4、Caspase-5也在启动机体免疫过程中发挥重要作用(Shi et al.,2014)。这一启动方式与LPS激活TLR4不同,细胞内Caspase引起的免疫级联反应也会产生炎症因子,这可能为研究LPS诱导免疫激活提供新的途径(Yi,2017)。
1.3 脂多糖识别受体TLR4产生的免疫激活与抑郁
在LPS诱导的免疫激活中,TLR4作为唯一识别病原体相关分子模式的受体,在这一过程中起着“开关”的作用,是激活固有免疫的主要受体之一(Park et al.,2017)。Toll样受体家族最初被发现在果蝇体内,共有13种,后经研究发现,人类体内共含有Toll样受体10种,其中对TLR4的研究最为深入(Lee et al.,2012)。当MLNs免疫细胞膜上的TLR4识别到LPS时,TLR4通过与TIR结构域(Toll-interleukin-1 receptor,TIR)的相互作用,激活下游两条信号转导通路(Rocha et al.,2016):髓样分化蛋白88(myeloid differentiton primary response 88,MyD88)通路,β-干扰素Toll-白介素1受体结构域蛋白(Toll-IL-1 receptor-domain-containing adaptor inducing IFN-β,TRIF)通路(Rahimifard et al.,2017)。在 MyD88通路中,TLR-4通过其细胞质域TIR结构与MyD88结合,然后激活IL-1受体相关激酶 4(interleukin-1 receptor-associated kinase-4,IRAK4),IRAK4结合并激活TNF受体相关因子6(TNF receptor associated factor-6,TRAF6),从而使得下游的转化生长因子激酶(transforming growth factor activated kinase-1,TAK1)磷酸化,以及丝裂原活化蛋白激酶MAPK的激活(Walsh et al.,2015),最终分别生成活化蛋白1(activator protein-1,AP-1),TNF-α、IL-1、IL-6等炎症因子(O’Neill et al.,2013;Plotnikov et al.,2011)。而在 TRIF 通路中,TRIF与肿瘤坏死因子受体相关因子3(TRAF3)相互作用,使得干扰素调节因子3(interferon regulatory factor 3,IRF3)和干扰素调节因子7(IRF7)的复合体转移至核内,并释放出干扰素 γ(interferon γ,IFNγ)(Qin et al.,2005;Yamamoto et al.,2003)。这一过程通过免疫级联反应将外周炎症转向大脑,其路径可能是一方面通过迷走神经导致前额皮质小胶质细胞激活,以及MAPK的表达升高(Martín-Hernández et al.,2016),小胶质细胞激活会在脑内产生炎症因子、破坏海马功能、减少脑源性神经营养因子的产生(Lindqvist et al.,2017),将身体生理改变转化至协调焦虑、觉醒、食欲、警觉、应激等的脑区(Wang et al.,2019)。另一方面,随着“肠漏”加剧,肠道粘液层的革兰氏阴性菌LPS进入血浆,形成内毒素血症(Whitfield et al.,2014),对血脑屏障产生破坏作用,使得外周炎症因子影响大脑,并在抑郁相关脑区释放氧化和亚硝化应激信号(O&NS),以此来影响神经元网络和功能(Lucas et al.,2013)。这提示,心理应激作用可能是造成肠道通透性增加,有毒物质进入循环系统的诱因,同时肠道革兰氏阴性菌释放的LPS也会产生中枢、外周炎症。
TLR4作为识别内外源病菌入侵的受体,能够产生中枢和外周的免疫反应,其对抑郁行为产生的可能影响包括:使与抑郁相关的脑区产生炎症因子,如前额皮质、海马、纹状体(Mohamed et al.,2013);炎症因子的产生诱导了前额皮质、海马的吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)的表达(Zhao et al.,2017)。有研究表明,IFNγ在抑郁症的病理过程中,也扮演着诱导外周巨噬细胞和小胶质细胞表达IDO的作用,这一过程使得色氨酸代谢至犬尿氨酸途径(kynurenine pathway),减少了中枢神经单胺类递质5-HT的产生,并伴有小鼠的快感缺失症状(O’Connor et al.,2009);刺激HPA轴,导致皮质酮浓度上升(Kanczkowski et al.,2013)。临床研究表明,抑郁患者外周血液中TLR4 mRNA的表达是与抑郁严重程度相关的独立危险因素。此外,在抑郁患者的外周血单核细胞中发现,TLR4通路的TRIF、MyD88 mRNA表达上调(Hung et al.,2014)。
外周血液中LPS升高诱发的免疫激活,还可引起脑内胶质细胞的活化,使神经炎症加剧,进一步损害神经元,使海马神经发生减少(Tang et al.2016;Wang et al.,2019)。以往研究提出,海马神经发生的减少与抑郁行为的形成机制有密切关系。长期应激或血液LPS浓度升高会提高海马中小胶质细胞的标记物Iba1的表达(Wang et al.,2019)。循环LPS水平的升高会导致脑内趋化因子2(CCL2)mRNA的表达,提示CCL2可能参加免疫细胞向脑内的转移(Thompson et al.,2008)。在LPS作用下,发现CCL2基因敲除小鼠中,脑内促炎因子的下调和脑免疫细胞激活的减少有关(Cazareth et al.,2014)。CCL2是脑部免疫细胞的整体活化、内源性的脑炎症、5-HT释放减少、海马神经发生减少的关键因素(Heinisch et al.,2009)。这提示LPS刺激会导致海马小胶质细胞活化,进而使神经发生减少,诱发抑郁行为(Hu et al.,2012)。
针对以上研究结果,“肠漏”诱导的免疫激活是抑郁行为的一大诱因。最近的研究指出,LPS诱发抑郁的潜在机制可以通过“Two-hit model”来解释,这一模型是基于免疫激活和外界应激的双重影响,以更好地解释抑郁症的病理机制(Géa et al.,2019)。基于“Two-hit model”,本文梳理了“肠漏”诱导的免疫激活导致抑郁发生的生理机制,如图1所示。
2 运动对“肠漏”和免疫激活通路的调节作用
2.1 运动对肠道通透性的调节
运动对“肠漏”研究主要集中于不同运动强度对肠道通透性的影响。在动物研究中,自主跑轮运动能够降低肠道淋巴细胞中炎症介质和凋亡标记物的表达,提示运动对肠道有保护作用(Hoffman-Goetz et al.,2009)。中等强度运动可改善反复应激所致的肠道通透性的紊乱(Campbell et al.,2016)。适度运动可减少氧化应激,增加热休克蛋白,使血液流向肠道,这对肠道通透性有间接的益处(Karper,2011)。运动过程中血液重新分配,使得消化系统血液灌注量减少,肠道处于低氧环境,其中低氧诱导因子 1α(hypoxia-inducible factor-1α,HIF-1α)参与调节肠黏膜免疫稳态。中小强度运动对肠道屏障通透性和肠黏膜免疫稳态可能有改善作用,这些现象与运动过程中HIF-1α表达的上调有着密切联系,肠道HIF-1α稳定表达可改善肠道屏障通透性(吴嵽等,2018)。自主跑轮运动通过抑制小鼠环氧合酶2(cyclooxygenase 2,COX-2)的表达,阻止高脂饮食诱导的肠道通透性的改变,提示规律运动可降低高脂饮食引起的肠道菌群转移作用,以及肠道炎症反应。中等强度运动可限制小鼠的肠道通透性上升,改善小鼠的厌食行为(Campbell et al.,2016)。也有研究表明,每天30 min的游泳运动可以显著提高小鼠肠道的抗菌肽的表达,进而限制小鼠菌群移位,保护肠道通透性(Luo et al.,2014)。中等强度跑台运动和高强度间歇运动(HIIT)都可显著上调肠道通透性调节蛋白ZO-1(zonula occludens-1,ZO-1)和结连蛋白Occludin的表达,尤其是HIIT,并且两种运动方式都能降低大约50%左右的内毒素水平和LBP的表达(Maillard et al.,2019)。
同时,大强度运动尤其是力竭运动作为一种应激源,会造成肠道上皮细胞损伤,并增大肠道通透性,产生菌群的移位(Karhu et al.,2017)。通过9周的力竭性运动研究发现,力竭运动组的大鼠小肠绒毛数目明显减少,小肠粘膜上皮细胞出现肿胀、变性,肠道清除自由基的能力下降,氧化自由基生成增加,从而使得小肠粘膜屏障被破坏,引起小肠粘膜通透性增加,引起“内毒素移位”(杨加玲等,2011)。长时间剧烈运动时血液重新分配,胃肠道的血流量减少,长时间肠低灌注损伤肠黏膜稳态及上皮细胞,使得肠道通透性增加(Pugh et al.,2017)。近来研究指出,血浆中肠道脂肪酸联结蛋白(intestinal fatty acidbinding protein,I-FABP)是运动后肠道通透性改变的标记物,20 min 80%最大摄氧量的跑台运动导致受试者小肠道上皮细胞损伤,I-FABP表达上调,肠道通透性增加(March et al.,2017)。另外,大强度运动训练以及低氧环境导致肠道粘膜功能受损,这可能是通过增加小肠内TNF-α、NF-κB 的含量,从而降低结连蛋白 occludin的表达,最终导致小肠通透性增加,肠道粘膜受损(刘霞等,2017)。其分子机制尚未阐明,但可以肯定的是,适度运动对于肠道菌群的稳态有着明显的改善作用,表现为运动可以提高拟杆菌门的丰度和降低硬壁菌门的丰度(Evans et al.,2014),从而改善由肠道菌群诱发的抑郁行为。
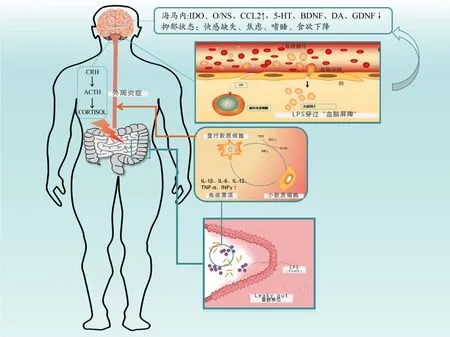
图1 “肠漏”诱导免疫激活导致抑郁的“Two-hit model”Figure 1.The“Two-hit Model”of Depression Induced by Immune System Activation Following“Leaky Gut”
2.2 运动对脂多糖识别受体TLR4的调节
运动与LPS诱导的免疫激活通路研究主要集中于LPS的识别受体TLR4的表达。规律的中等强度运动可以诱发胰岛素样生长因子 1(insulin-like growth factor,IGF-1)水平的升高(Derezendegomes et al.,2004)。IGF-1是TLR4的调节因子,IGF-1会抑制TLR4的表达,并产生抑炎因子IL-10(Lee,2011),而抑炎因子IL-10 的释放可以抑制TNF-α水平、NF-κB信号转导(Schottelius et al.,1999)。规律运动的抗炎作用可能与内脏脂肪的减少有关,并因此减少促炎脂肪因子的释放,产生细胞的抗炎环境,这一环境的形成与中等强度运动对TLR4的抑制有关(Gleeson et al.,2011)。在高脂膳食诱导的肥胖大鼠研究中发现,不管是急性运动还是慢性有氧运动,都可以对肌肉、脂肪组织的TLR4表达进行抑制,降低血液LPS水平(Oliveira et al.,2011)。运动时抑制TLR4而产生的抑炎因子IL-10可能与PI3K/AKT/mTOR信号通路激活有关(Li et al.,2013)。持续8周的中低强度跑台运动可显著降低小鼠海马TLR4的表达,激活TLR4/miR223/NLRP3通路轴,促进海马组织修复,并改善海马功能(屈红林等,2019)。
在急性运动或者大强度运动对TLR4的表达研究中发现,力竭运动使小鼠体内活性氧增加(ROS)(Lee et al.,2015),导致TLR4的表达上调,促炎转录因子NF-κB、AP-1表达增加,产生一系列的炎症因子(Lira et al.,2010;Rodriguez-Miguelez et al.,2015),这一影响是否会对神经退行性疾病产生负面影响,尚未有研究表明。同时,也有研究指出,急性运动时,肌肉收缩产生热休克蛋白HSP可能在运动调控肠道通透性以及TLR4表达中起重要作用,但此方面文献有限,未能阐明其分子调控机制(Matsuo et al.,2009)。总之,可以肯定的是,中等强度运动或有规律的有氧运动对肠道通透性和LPS识别受体TLR4的表达均有良性的调节作用,关于这方面的研究主要集中于对AD、PD、SCH等神经退行性疾病,以及一些代谢疾病,对抑郁症的研究较少,但这可为抑郁症的运动干预提供一个潜在靶点(图2),仍需更多的运动相关研究来证明。
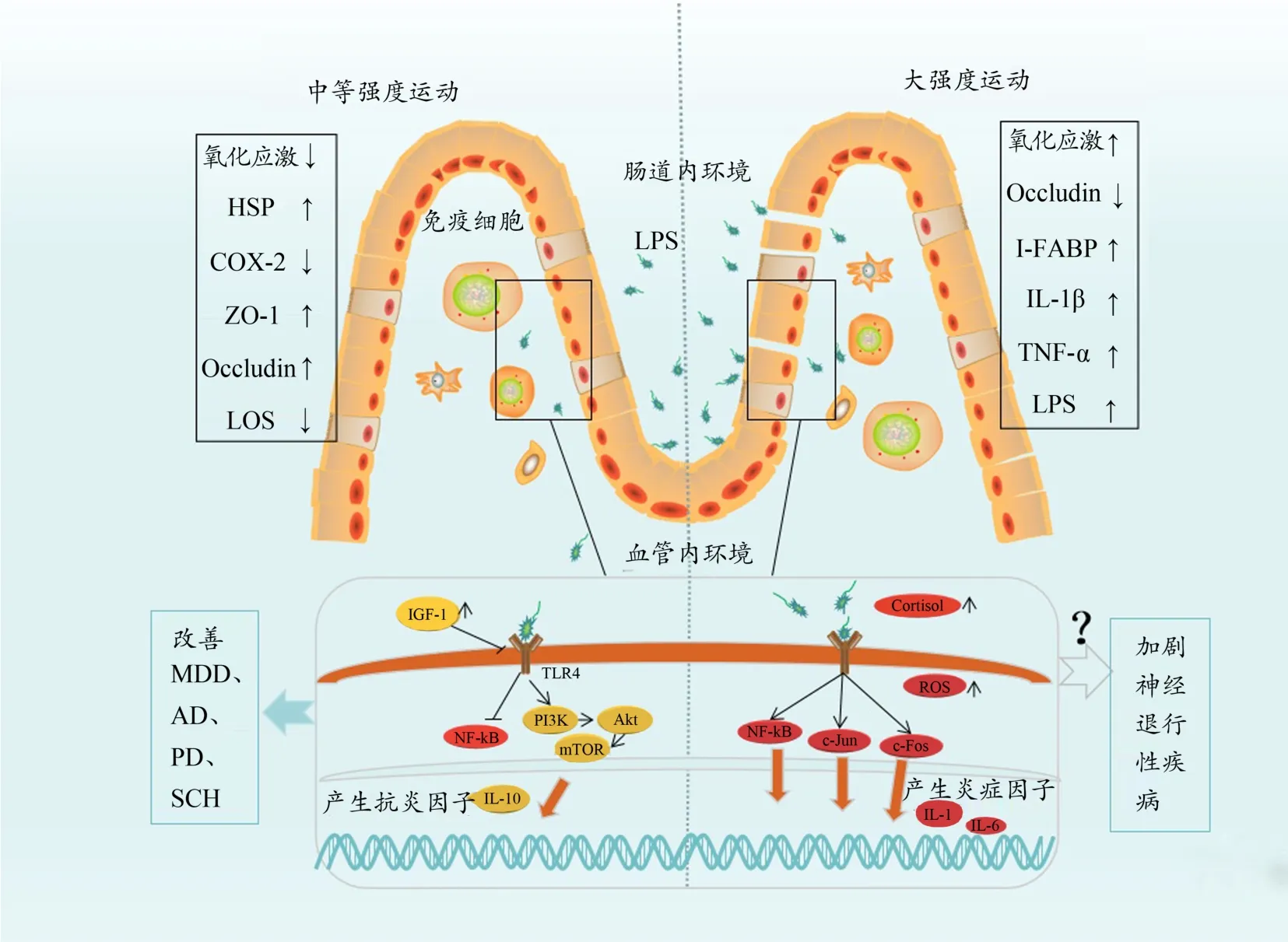
图2 不同运动强度对“肠漏”下免疫激活的影响Figure 2.Effects of Different Exercise Intensity on Leaky Gut Induced Immune Activation
3 “肠漏-免疫激活-神经炎症”介导的运动抗抑郁机制
3.1 运动调控脂多糖诱导的细胞因子改善抑郁
以往研究表明,LPS水平升高会有快感缺失、厌食、对奖励反应性降低、糖水消耗显著降低等抑郁行为(Henry et al.,2008;Lawson et al.,2013)。内毒素血症会激活外周免疫,产生炎症因子TNF-α和IL-6,并对血脑屏障进行破坏(Stevens et al.,2018)。TNF-α mRNA 在血脑屏障的脉络丛上皮细胞中选择性的表达增加,提示TNF-α可能在血脑屏障中过度表达,从而增加其通透性(Cazareth et al.,2014),进而使促炎因子经过血液运输通过血脑屏障至颅内,这可以解释外周免疫激活导致的脑神经炎症的产生,从而诱发抑郁行为(Mayerhofer et al.,2017)。进入脑内的LPS会使脑内海马、前额皮质等区域免疫激活,产生炎症因子,包括 IL-1β、IL-6、TNF-α、NLRP3、CRP 等,诱发抑郁行为的发生(Tang et al.,2016;Wu et al.,2016;Zhu et al.,2017)。虽然已有不少研究证明,LPS诱发的神经炎症与抑郁行为的关系,但其具体的分子病理机制仍需要进一步探索。
对运动与LPS诱导的抑郁行为研究发现,运动会降低LPS造成的抑郁性神经炎症表达,进而对抑郁行为产生改善作用。运动能显著抑制由LPS诱导的细胞炎症表达、提高抑炎因子的表达(表1)。近期一项研究发现,有氧运动可诱导炎性因子IL-1β及NF-kB转录子的低表达,调控miR-223的高表达,激活TLR4/imRNA-223/NLRP3通路,靶向抑制NLRP3蛋白活性,抑制炎性因子的释放,减弱抑郁小鼠海马组织炎症,调控其抗炎效果(屈红林等,2019)。运动在对LPS诱导的免疫激活中起着重要的调节作用,降低炎症因子的表达,缓解抑郁行为的发生。但也有少数研究表明,小鼠的自主跑轮运动不会对LPS诱导的炎症水平产生影响(Martin et al.,2013-2014)。这一结果差异可能受小鼠品系、基因差异、运动方案、实验条件的影响。
3.2 运动改善脂多糖诱导的海马神经发生减少
前面指出,外周LPS水平的升高会导致海马小胶质细胞、星状胶质细胞的活化,从而诱发神经炎症,降低BDNF mRNA的表达,而这些因素均是抑郁发生的诱因(Hritcu et al.,2014)。运动对LPS诱导的海马神经减少研究主要集中于对脑内BDNF的调节,以及改变海马胶质细胞的数量,调控海马相关蛋白的表达。
近期研究发现,LPS的注射使得小鼠神经递质5-HT、DA水平下降,脑内小胶质细胞活化,导致脑内BDNF和GDNF水平下降,这一变化存在抑郁风险,对小鼠进行中等强度跑台运动可缓解这一症状(Scheffer et al.,2019)。自主跑轮运动使小鼠前额皮质的CCL2显著降低,对其表达有阻断作用。CCL2作为脑内LPS诱发5-HT减少、海马神经发生减少的重要因素,其表达降低可对抑郁起缓解作用(Heinisch et al.,2009)。6周的自主跑轮运动后,对小鼠海马进行单胺类神经递质水平、线粒体活性、神经营养因子分析得出,运动刺激了大脑线粒体活性、神经可塑性,从而改善抑郁样行为,提示中等强度水平运动会对LPS引起的抑郁、焦虑行为起到改善作用(Aguiar et al.,2014)。这种改善作用的分子机制目前仍缺乏研究,但可能与前文提到的运动对脑内免疫细胞的炎症通路调控有关。

表1 运动对细胞因子诱导的免疫激活的干预机制Table 1 The Intervention Mechanism of Exercise on LPS Induced Immune Activation
此外,阻力跑轮运动可以促进齿状回神经发生和新生细胞成熟,表现为神经发生标记物BrdU蛋白的阳性表达,并且发现阻力跑轮运动比自主跑轮运动的效果要好,30%体重的阻力跑轮运动不会引起血浆皮质酮和肾上腺素的变化,这说明阻力跑轮运动没有负面应激影响(Lee et al.,2013)。12周跑台运动能降低海马中促凋亡蛋白Bax的水平和上调抗凋亡蛋白Bcl-2的水平(Um et al.,2011)。自主运动具有促海马神经发生的作用,提高了BDNF水平,跑台运动增强小鼠海马BDNF受体突触相关激酶B(TrkB)和突触蛋白的水平,对LPS引起的海马神经发生减少有改善作用(Yau et al.,2014)。运动后海马齿状回 BDNF mRNA 表 达 上 调 ,IGF-1增 加(Maass et al.,2016)。大多数临床研究显示,急性有氧运动后外周BDNF水平会短暂升高,但没有临床研究显示,外周BDNF对运动有长期的适应(Yau et al.,2014)。在一项针对老年人的实验中发现,中等强度有氧运动使海马前区体积增加约2%,这间接说明中等强度有氧运动会引起人脑的神经发生(Erickson et al.,2011)。LPS引起的海马神经减少诱导抑郁行为已被证实,但不同运动通过抑制LPS引起的海马神经减少,从而改善抑郁的分子机制,仍需进一步研究。
3.3 运动弱化“肠漏-免疫激活-抑郁性神经炎症”
“肠漏”后肠道内革兰氏阴性菌产生的LPS进入循环系统,产生一系列的级联反应。这些反应包括中枢单胺类神经递质表达的降低、HPA轴的过度激活、神经炎症产生、海马神经发生和神经营养因子下降、神经毒害物质产生,并外显为快感缺失、食欲下降、嗜睡等抑郁行为。关于运动弱化“肠漏-免疫激活-抑郁性神经炎症”,动物研究和临床研究均有证实。这些研究集中表现为运动对“肠漏-免疫激活”介导的抑郁性神经炎症的弱化,或对相关脑区的靶向作用。
在动物研究中,LPS常用于模拟“肠漏”后的免疫激活,LPS水平的持续升高会使脑内DA及其代谢物3,4二羟基苯乙酸(DOPAC)水平下降,基底神经节的DA分泌功能可能是LPS诱发的外周炎症靶点,这一作用与抑郁行为密切相关。中等强度的跑台运动使DA神经功能修复,使不同脑区的BDNF和GDNF水平升高,提示对神经退行性疾病以及中度抑郁有缓解作用(Scheffer et al.,2019)。另有研究证明,中等强度运动减少LPS诱发的海马、脑皮质的OS水平和NO代谢物浓度的聚集,同时使海马的炎症因子水平下降,这些炎症因子的升高对负责情感、记忆的海马区神经元功能、长时程增强、突触可塑性起损害作用(Jahangiri et al.,2019)。有趣的是,在一项抗阻训练的研究中发现,LPS诱发的认知损害可由抗阻训练改善,表现为抗阻训练使海马齿状回的IGF-1、蛋白激酶B、GSK-3β磷酸化,同时也增加了突触蛋白SYN1的表达,提示力量练习可能通过海马齿状回的IGF-1信号通路改善认知功能和情绪状态(Kelty et al.,2019)。临床上,关于运动减弱LPS诱导的免疫激活进而改善抑郁的研究较少,其主要限制在于,对“肠漏”的检验只能通过几种标记物判断,而这些标记物的升高也依赖于其他因素(Simeonova et al.,2018)。因此,更多的临床研究倾向于运动改善神经炎症水平,但在一项认知行为疗法联合运动的抑郁干预效果研究中发现,中等强度运动可以降低抑郁患者血清的CRP水平和增加抗炎因子IL-10水平,但对LPS注射诱导的IL-6水平没有显著影响,这提示运动对抑郁患者的炎症因子表达影响具有靶向性(Euteneuer et al.,2017)。有研究假设认为,运动可能通过激活肌肉的过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptorγ,PPARγ)辅助激活因子-1α(PPARγ coactivator-1α,PGC-1α)的表达,使外周促炎因子表达和OS水平下降,进而调节脑内色氨酸代谢,使5-HT水平上升,神经炎症减弱(Ignacio et al.,2019)。
综上,中等强度运动对“肠漏”后LPS诱发的免疫反应起调控作用,这一作用在不同程度上缓解抑郁性神经炎症。本文探究了“肠漏”诱导的免疫激活与抑郁症之间的相关性,以及“肠漏-免疫激活”介导的运动改善抑郁性神经炎症的潜在生物学机制(图3)。这一潜在机制包括不同强度运动对应激后“肠漏”的调控,运动对LPS受体TLR4的表达的调节,以及运动对大脑的保护和改善作用以应对“肠漏-免疫激活”诱发的抑郁性神经炎症。然而,尚未有关运动调控“肠漏-免疫激活-抑郁性神经炎症”的完整通路研究,对这一通路的深入研究对正确认识“肠-脑”对话机制,以及寻找运动干预的靶点具有重要意义。
4 研究展望
近年来,对于肠道功能及菌群与抑郁症的研究逐渐增多,“肠漏”诱导的免疫激活也被证明与抑郁行为的发生具有密切关系。运动对抑郁行为的改善作用已得到认可,但其相关机制研究主要集中于中枢神经系统的适应性变化,忽视了机体不同系统、不同组织的相互影响。因此,运动对肠道功能及菌群移位的作用为改善抑郁行为的研究提供了新的思路。

图3 适度运动通过调控“肠漏-免疫激活”改善抑郁行为的潜在机制Figure 3.The Potential Mechanism of Moderate Exercise in Attenuating Depression-like Behaviors Via Regulating Leaky Gut-Induced Immune Activation
运动改善“肠漏-免疫激活-抑郁性神经炎症”的通路仍需更多的机制研究予以完善,这一过程存在如下需要明确的问题:1)当前的研究仅显示,运动对“肠漏”产生的炎症因子以及海马神经发生等的影响,是否存在运动通过调节血脑屏障、前额皮质、杏仁核等部位的细胞因子表达来改善抑郁症?2)关于运动通过影响LPS/TLR4来缓解抑郁症的研究,目前均在现象层面进行阐述,其系统的分子调节研究仍不足。3)LPS产生的外周免疫反应情绪相关脑区的作用机制是怎么样的,LPS产生的炎症因子种类较多,运动是否对其具有靶向性和运动方式的相关性?4)过度运动是否作为一种应激诱发肠道菌群移位,进而使大脑产生抑郁性神经炎症?对于上述问题的阐明将有助于进一步明确肠道功能改变在抑郁症中的角色,以及运动在此过程中调控的分子机制,同时为治疗抑郁症提供新的靶点。
