近红外二区成像中通过靶向磷脂酰肌醇蛋白聚糖-3 早期诊断肝癌转移实验研究
2020-06-30占美晓忻勇杰陆骊工
李 佳,李 勇,占美晓,忻勇杰,赵 炜,陆骊工
肝癌是全球第5 大常见恶性肿瘤,外科肝切除术是首选治疗方法,然而目前术后复发率高[1]。肝肿瘤周边伴有微转移灶,肉眼难以识别,为手术彻底切除病灶带来一定困难[2]。 近年实时光学手术导航技术发展为此带来新机遇,近红外二区(second nearinfrared region,NIR-Ⅱ)成像较传统近 NIR-Ⅰ成像穿透度更深、分辨率更高、自发荧光更少,故可极大提高术中成像灵敏度[3-4]。以肝癌高表达的磷脂酰肌醇蛋白聚糖(glypican,GPC)-3 为靶点,通过特异性靶向多肽[5]与荧光探针相偶联,可大大提高荧光探针主动靶向肝癌的能力。 本研究通过构建靶向肝癌GPC-3 特异性NIR-Ⅱ荧光探针、肝癌裸鼠转移模型[6]并在体观测NIR-Ⅱ荧光区,探讨NIR-Ⅱ成像对肝癌微小转移灶早期诊断的优势。
1 材料与方法
1.1 实验器材
硝酸银(AgNO3)、牛血清白蛋白(BSA)、氢氧化钠(NaOH)、 硫化钠 (Na2S)(北京伊诺凯科技公司),GPC-3 抗体(ab129381,英国 Abcam 公司),人 LO-2、HepG2、MHCC97-H、HCC-LM3 细胞系(北京中源合聚生物科技公司),多肽TJ12P1(杭州中肽生化公司),NIRvana 640ST 型 NIR-Ⅱ成像系统、 IVIS LuminaⅡ型小动物光学成像系统(中国科学院分子影像重点实验室)。
1.2 实验方法
纳米探针制备:BSA 用超纯水配制浓度为0.5%白蛋白溶液,浓度为0.1 mmol/L 硝酸银水溶液缓缓滴入10 mL 白蛋白溶液,避光反应1 h;反应溶液中逐滴加入0.1 mol/L 氢氧化钠溶液,调节溶液pH 至12;逐滴加入 0.4 mmol/L 硫化钠水溶液,控制 Ag∶S离子摩尔比为1∶1,控制温度40 ℃,避光反应过夜;所得溶液置于截留分子量为100 kD 半透膜透析袋中进行透析,冷冻干燥得到固体粉末;粉末重新溶解于磷酸缓冲液(PBS),通过1-乙基-(3-二甲基氨丙基)碳二亚胺(EDC)-N-羟基琥珀酰亚胺(NHS)交联法偶联多肽片段TJ12P1,得到纳米探针Ag2S@BSATJ12P1。
基本表征检测:采用JEM-1200EX 型透射电子显微镜(TEM)获得纳米探针形貌结构电镜图,岛津UV-3600 型紫外可见光分光光度计检测紫外可见光吸收曲线,日立F-7000 型荧光分光光度计检测荧光发射光谱。
穿透深度验证:配制 0.1 mol/L Ag2S@BSATJ12P1 和等量IRdye800-CW 溶液作为对照,制备不同厚度冰冻鸡胸肉切片覆盖样本并进行成像;采集780~900 nm 波段 NIR-Ⅰ信号和 1 100~1 300 nm 波段NIR-Ⅱ信号并采集数据,Light-field 软件读取信号值。
免疫印迹和免疫荧光验证:取对数期生长LO2、HepG2、MHCC97-H、HCC-LM3 细胞于共聚焦培养皿中贴壁生长,与Cy-5 染料标记的Ag2S@BSATJ12P1 共 孵 育 12 h;4',6- 二 脒 基 -2- 苯 基 吲 哚(DAPI)对细胞核进行染色,激光共聚焦显微镜观察样本荧光,Imaris 图像分析软件计算平均光密度(OD,平均OD=积分OD/区域全面积),取平均值。
另取上述细胞样品加入放射免疫沉淀测定(RIPA)裂解液,进行重悬,于冰上裂解30 min 行蛋白提取,依照电泳上样量需要用水和5 倍体积上样缓冲液(loading buffer)调整蛋白浓度,100℃煮沸变性,12%分离胶和5%浓缩胶行凝胶电泳,每孔上样40 μg,控制浓缩胶恒压 80 V,20 min;分离胶恒压120 V,电泳至溴酚蓝到达凝胶底部;300 mA 恒流转膜2 h;5%脱脂奶粉封闭1 h,依次与一抗(1∶1 000)与二抗(1∶5 000)孵育,洗膜后暗室曝光、显影并定影;以肌动蛋白(actin)为内参,Quantity One v4.6.2 软件读取并记录GPC-3 相对表达水平。
1.3 活体NIR-Ⅱ成像与病理学验证
收集对数生长期HCC-LM3 细胞,胰酶消化后用 PBS 重悬,调整浓度为 5×106个/mL,选取 6 周龄雄性Balb/c 小鼠并尾静脉注射细胞悬液制备转移模型,观察小鼠体重及精神状态变化。2 周后通过尾静脉注射200 μg/mL Ag2S@BSA-TJ12P1 纳米探针,分别在注射后 1、2、6、12、24、48 h 于 NIR-Ⅱ成像系统中成像。
2 结果
TEM 显示Ag2S@BSA-TJ12P1 纳米探针表征为量子点,粒径约为10 nm(图1①);经多肽修饰后,吸收光谱可见400 nm 左右处有一特征性吸收峰,证明多肽与 Ag2S 成功偶联(图 1②);NIR-Ⅱ荧光光谱可见最大发射峰位于波长1 080 nm 处,处于NIR-Ⅱ谱段(图 1③);IRDye-800CW 作为 NIR-Ⅰ对照,采用不同厚度冻鸡胸肉遮盖样品并测试荧光穿透深度显示,NIR-Ⅱ荧光较NIR-Ⅰ荧光具有更强的穿透深度(6 mm 对 9 mm)(图 1④)。

图1 Ag2S@BSA-TJ12P1 纳米探针表征
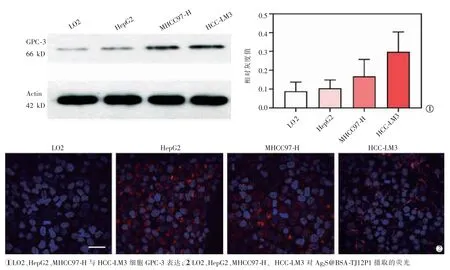
图2 Ag2S@BSA-TJ12P1 可特异性靶向肝癌细胞
免疫印迹检测结果显示,HepG2、MHCC97-H、HCC-LM3 细胞GPC-3 表达均显著高于LO2 细胞(图 2①)。 Cy-5 染料标记纳米探针 Ag2S@BSATJ12P1 并与4 种细胞共孵育后,激光共聚焦成像可见纳米探针被 HepG2、MHCC97-H、HCC-LM3 细胞特异性摄取,而LO2 细胞几乎不摄取(图2②)。
裸鼠注射纳米探针后 1、2、6、12、24、48 h 成像显示,探针首先富集于肝脏区域,12 h 后探针信号对转移灶具有最佳信噪比,48 h 后信号基本消失(图3①);离体肝脏可见数枚直径约1 mm 微小转移灶,散在分布于肝表面(图3②);苏木精-伊红(HE)染色组织病理切片可见病灶内大量异形细胞(图3③)。
3 讨论
肝癌早期以手术治疗为主,中晚期治疗包括介入为主的综合治疗[1,7]。 然而肝癌起病隐匿,早期症状不明显,诊断时多为中晚期。 肝癌外科手术过程中,术者判断肝癌边界通常依赖术中触诊和肉眼观察,缺乏实时、客观、有效的辅助方法。 活体荧光成像技术通过荧光靶向探针在肿瘤区域特异性富集,借助高灵敏度成像仪器,可在术中实时定位肿瘤,为术者彻底切除肿瘤提供实时反馈。 NIR-Ⅱ荧光成像(900~1 700 nm)与 NIR-Ⅰ荧光成像(750~900 nm)相比穿透强度更深,生物自发荧光更少,大大提高了肿瘤区域信噪比,有望突破现有光学手术导航的瓶颈[8-9]。 此外,荧光探针需与高特异性肿瘤抗体相耦合,以实现对肿瘤长效、稳定标记,满足外科医师对术中导航的时间要求。 近年研究表明,GPC-3 作为肝癌特异性标志物在肝癌发生发展过程中具有重要作用,高达90%患者肝癌表面存在GPC-3 高表达,为肝癌精准靶向与诊疗提供了重要证据[10]。
本研究所设计的Ag2S@BSA 纳米探针在NIR-Ⅱ区具有优越的光学性质,将荧光探针与GPC-3 特异性靶向多肽TJ12P1 通过EDC-NHS 交联法相耦合获得靶向探针Ag2S@BSA-TJ12P1,大大增强了荧光探针靶向性,并实现了肝癌原发灶与转移灶长效、稳定标记。 裸鼠肝癌转移模型体外实验证实,本研究设计的Ag2S@BSA-TJ12P1 荧光探针与传统NIR-Ⅰ荧光探针(IRdye800-CW)相比,NIR-Ⅱ成像具有更强的穿透深度,更少受到生物自发荧光干扰;在体实验证实,Ag2S@BSA-TJ12P1 荧光探针NIR-Ⅱ成像可成功观测到最小为1 mm 肝癌转移灶,并经病理证实。
综上所述,本研究结果在肝癌转移灶精准诊断及荧光手术导航方面具有一定的转化前景。 但本研究也有局限性,所应用的裸鼠肝癌转移模型模拟肝癌血行转移病理情况,可能较人类肝癌肝内转移位置及特性存有一定差异,需要结合更多疾病动物模型加以验证,以及进一步优化靶器官成像时间窗等加以探讨。
